数形结合 素养立意
沈锋


一、題型概述
化学反应原理最容易失分的是图像题,原因是图像的呈现方式变得越来越新颖,如试题中涉及的图像已不仅仅是速率与简单的化学平衡,研究体系也已不是单纯的气相体系,往往根据实际工业生产,更多的是研究复杂液相反应体系,坐标参数也不再局限于时间、温度、压强、速率、转化率、百分含量,而是有更多的变量,像物质的量之比、气体分压或离子浓度的对数或负对数等,分析投料比、转化率、产率的变化。这样的变化使试题新颖,信息量增大的同时,也增大了试题的难度,读懂图形变得更困难。多变量图像题是高考考查的一个方向和趋势,它是指在一个坐标系中存在多个变量的图像,此类题的特点是:一方面信息量大,考查了读图能力;另一方面多变量的存在,考查了分析推理能力,在新课标高考中受到命题者的青睐。
二、构建思维模型
第一步:识别图像类型。
需要界定纵坐标参数与横坐标参数,把握点与线的内在联系。
(1)看面:仔细审读坐标系,清晰纵、横坐标分别所代表的意义,结合有关化学原理知识解析。
(2)看线:①理清坐标系曲线的变化趋势,关注变化趋势和变化的拐点,关注正、逆反应,从而判断反应特点;②明确拐点具有的意义。比如,在转化率-时间图像上,曲线先到达拐点便会取得平衡,对其推理和剖析后可以发现,曲线可以反映出压强大和浓度大的情况。
(3)看点:①观察清楚起点,对指向生成物或指向反应物加以明确,生成物浓度不断增大,而反应物浓度不断减小;②注重终点。比如,对于浓度一时间图像,应把握终点部分增加的生成物与消耗的反应物,与相关原理相结合开展判断和推理才能得出结果。
第二步:把握反应特点。
分析可逆反应对应的化学方程式,观察物质的状态、反应前后气态物质化学计量数和的变化、反应的放吸热等。
第三步:联系结合平衡原理。
联系结合化学反应速率、平衡移动原理,特别是反应的影响因素及反应实现的前提条件等。
第四步:数形结合解答。
化学原理知识与图像的整合,逐一进行图表参数研究,重视图表能够满足化学平衡移动原理和可逆反应特性。
三、典题分析
b.体系压强不变
c.气体平均相对分子质量不变
d.气体密度不变
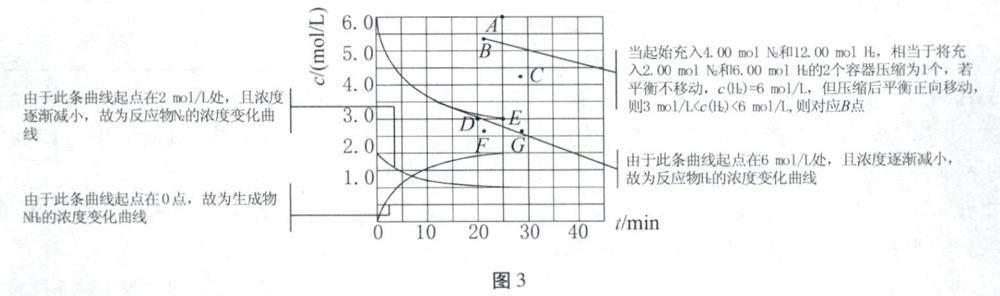
(2)处于这一温度,如果在起始状态将4.0mol N2、12.0mol H,分别充入该容器,反应达到平衡时,c(H2)-t曲线上体现为点____(选填图标中字母)。
解析 (l)①a项,3v正(N2)=v逆(H2)的状态是平衡状态,所以v正(N2)=3v逆(Hz)的状态不是平衡状态,故a错误;b项,该反应正向气体分子数减小,恒温恒容条件下,若反应正向进行、气体物质的量减小、压强降低,所以体系压强不变时达到平衡状态,故b正确;c项,体系中各物质均为气体,气体质量不变,恒温恒容条件下,反应正向进行、气体物质的量减小,气体平均相对分子质量增大,所以气体平均相对分子质量不变时达到平衡状态,故c正确;d项,体系中各物质均为气体,气体质量不变,恒温恒容条件下,气体平均密度始终不变,故气体平均密度不变,不能判定反应已达到平衡状态,故d错误;选bc。
(2)由图可知,将2.00mol N2和6.00mol H2充入1L密闭容器中,达到平衡时,c(H2)=3mol/L,即E点;若起始充入4.00mol N2和12.00molH2,是恒容容器中充入的2.00mol N2和6.00molH2的2倍,相当加压、反应速率加快、先达到平衡状态,但加压时平衡正向移动,使c(H2)小于6mol/L。图像分析如图3所示。
四、归纳总结
1.外界条件给可逆反应的逆反应速率和正反应速率带来的影响(见表1)
反应方向存在一致性,但影响程度未必保持一致。
2.化学平衡的主要影响因素(见表2)
五、方法论证
1.关于化学平衡移动方向解析
客观来讲,化学平衡状态属于恒定物质参数的一种状态,化学平衡移动的主要原因在于条件变化使得化学反应方向变化;化学平衡移动导致有关状态参数发生改变,不过化学平衡移动未必改变部分化学平衡状态参数,其参数改变的趋势也不具有恒定性。因此,化学平衡移动方向主要由正反应速率、逆反应速率变化产生的具体变化量所决定,这样一来,化学平衡移动方向在本质上由v(正)、v(逆)内在联系所决定;变化条件的瞬间如果存在组分参数改变的情况,如平衡常数K、浓度商Q出现变化,则化学平衡一定会移动。由此不难得出,把v(正)、v(逆)内在联系和平衡常数K、浓度商Q内在联系当成辨别平衡移动方向、平衡移动的依据具有一定合理性,若以此来判断平衡的移动,可能产生结果的偏差。
2.关于几类不能用平衡移动原理解释的问题分析
(1)如果外界的条件出现变化,不管平衡向正反应方向移动还是向逆反应方向移动,都难以让外界条件改变得到本质上的削弱,此时平衡未移动。例如反应:反应前、反应后气体系数和不变,当外界压强增大或减小时,平衡无论正向或逆向移动都不能减弱压强的改变,故对于该反应,压强改变,平衡不发生移动。
(2)无论是正催化剂,还是负催化剂,都会使正反应速率、逆反应速率出现相同程度的变化,因此催化剂无法导致化学平衡移动。
3.图形结合的一般思路及方法
(1)分析图像纵、横坐标轴上的数据,观察图像上曲线的走向和变化趋势。
(2)若图像上的曲线有2条或者2条以上时,注意观察和理解曲线的交点和拐点所代表的意义,先出现拐点的“温度高或压强大”。
(3)若图像中有3个变量时,应“定1议2”。
(4)加入催化剂或对反应前后气体分子数不变的反应改变压强,平衡不移动,但会改变到达平衡的时间。
(5)曲线斜率大表示反应速率快,可能是升温、加压或使用催化剂。
(6)综合运用勒夏特列原理解决问题。
从设置问题的角度看,题目往往是围绕某一个主题,有多个小题,从多方面提出问题,每个小题不一定有必然的关联,目的是考查不同的化学反应原理知识。纵观近几年的高考试题,不难发现命题点主要有以下几点:①化学反应速率和化学平衡的分析,化学平衡常数的表达式及计算、反应物转化率的分析及计算,反应条件的选择;②溶液中的离子浓度关系、酸碱中和滴定、氧化还原滴定、沉淀滴定以及各平衡常数的关系、计算和应用等。
试题的旱现方式,叙述、图像、图表等多种形式相结合,以选题或填空的方式提出问题,从而实现对学生的从图表获取信息的能力、审题能力、计算能力、文字表述能力、对化学用语的应用能力的考查,而且还可以很好的联系生产生活实际,体现由理论到应用的转化过程,同时也能很好地体现“变化观念与平衡思想”和“宏观辨识与微观探析”化学核心素养内容的落实。
(收稿日期:2024-02-28)

