枸杞多糖研究进展
牛忻?袁继承?吴北霞
摘 要:枸杞是我国传统的药食两用功能食品。枸杞多糖是一类结构复杂的糖蛋白缀合物,具有调节免疫、降血糖等功效,是枸杞的重要成分之一。本文对现有的关于枸杞多糖的提取、纯化、分离等方面的研究进行较为全面的综述,对各种方法进行对比,阐明其优缺点,其中包括传统的提取分离方法以及各种新技术新方法,如亚临界水提取法、高压脉冲电场提取技术、高速剪切技术、反复冻融提取法等。本文对现存的新方法新技术进行整理归纳,为枸杞多糖的进一步研究与开发提供参考依据。
关键词:枸杞;多糖;提取;分离;结构分析
Research Progress of Lycium barbarum Polysaccharides
Abstract: Lycium barbarum L. is a traditional Chinese functional food used in both medicine and food. Lycium barbarum polysaccharide is a complex glycoprotein conjugate, which has the functions of immune regulation and lowering blood sugar, and is one of the important pharmacodynamic substances of Lycium barbarum. In this paper, the existing researches on extraction, purification and separation of Lycium barbarum polysaccharide were reviewed comprehensively, and various methods were compared to clarify their advantages and disadvantages, including traditional extraction and separation methods and various new technologies and methods, such as subcritical water extraction method, high voltage pulsed electric field extraction technology, high-speed shear technology, repeated freeze-thaw method and so on. In this paper, the existing new methods and technologies were summarized to provide reference for further research and development of Lycium barbarum polysaccharide.
Keywords: Lycium barbarum; polysaccharides; withdraw; separate; structural analysis
枸杞子,又名苟起子、甜菜子、杞子、红青椒,为茄科(Solanceae)枸杞属(Lycium L.)植物枸杞或宁夏枸杞的成熟果实。枸杞在全球皆有分布,在我国多分布于华北、西北等地,主要有宁夏、河北、内蒙古、新疆四大产区[1],共有7个品种(截萼枸杞、黑果枸杞、新疆枸杞、宁夏枸杞、云南枸杞、柱筒枸杞、枸杞)与3个变种(新疆枸杞的变种红枝枸杞、宁夏枸杞的变种黄果枸杞、枸杞的变种北方枸杞)[2],其中宁夏枸杞(Lycium barbarum L.)、黑果枸杞(Lycium ruthenicum Murr.)和中华枸杞(Lycium chinense Mill.)是我国常见栽培种。但仅宁夏枸杞为药用种类,收录于《中国药典》2015年版一部作为中药材,其他种类枸杞只可以保健品或食品形式在市场流通。其呈类纺锤形或椭圆形,表面红色或暗红色,气微,味甜[3]。目前,许多国内外学者对枸杞多糖的提取、分离、纯化以及结构方面都做了大量的研究,已有多名研究人员分离得到枸杞多糖。
枸杞多糖(Lycium barbarum Polysaccharide,LBP)以传统的水提法最为常见。近年来,随著学科的不断渗透和交流,开始在传统水提多糖法的基础上辅以多种新技术新手段,如微波、超声波、高压脉冲电场提取技术、超临界流体、双水相萃取、酶法和微生物发酵等提取方法,为枸杞多糖的提取提供了新的思路与方向。枸杞多糖提取方法多样,但大致过程相似:药材烘干粉碎、预处理(脱脂、单糖及低聚糖)、溶液提取、提取液预处理(醇沉、透析、脱色、除蛋白等)、分离纯化等几个阶段。
1 枸杞的预处理
据统计,研究者对枸杞药材的烘干方法关注较少,对于鲜果枸杞,吴中华等[4]研究结果显示40~60 ℃分阶段变温干燥速度快、多糖含量最高。赵丽娟[5]研究结果显示60 ℃真空远红外烘干比热风干燥效果更佳。对于枸杞干果多采用50~60 ℃低温烘干后粉碎的方式处理。此外,张琪等[6]对比了直接粉碎与减压干燥法(40 ℃)、液氮冻干法、冻干法干燥后粉碎4种处理方法,结果显示其枸杞多糖含量并无明显差异。同时初步得出结论,鲜果枸杞的烘干温度对糖含量影响较大,干果枸杞的烘干温度对糖含量的影响较小,但为了避免焦化,应选择80 ℃以下的温度烘干。
目前,研究者对枸杞药材的粉碎程度研究也不多,部分研究者以多糖提取率为指标,对比了枸杞粉粒度对枸杞多糖得率的影响,如邹东恢等[7]与王启为等[8]分别对比了40目、60目、80目和100目4种粒度的枸杞粉,结果显示80~100目时多糖提取率最高。有研究者研究了枸杞药材的粉碎程度对提取多糖得率及抗氧化能力的影响,如YANG等[9]、ZHANG等[10],结果显示,超细粉碎处理可以提高枸杞多糖得率,使枸杞多糖的分子量变小,提高枸杞多糖的抗氧化活性。此外,在预处理阶段,学者多采用有机溶剂脱脂、除杂,如采用乙醇回流[11]或超声法[12]除小分子杂质与单糖、氯仿-甲醇2∶1[13]、石油醚[14]回流脱脂等。
2 水提
2.1 热水浸提
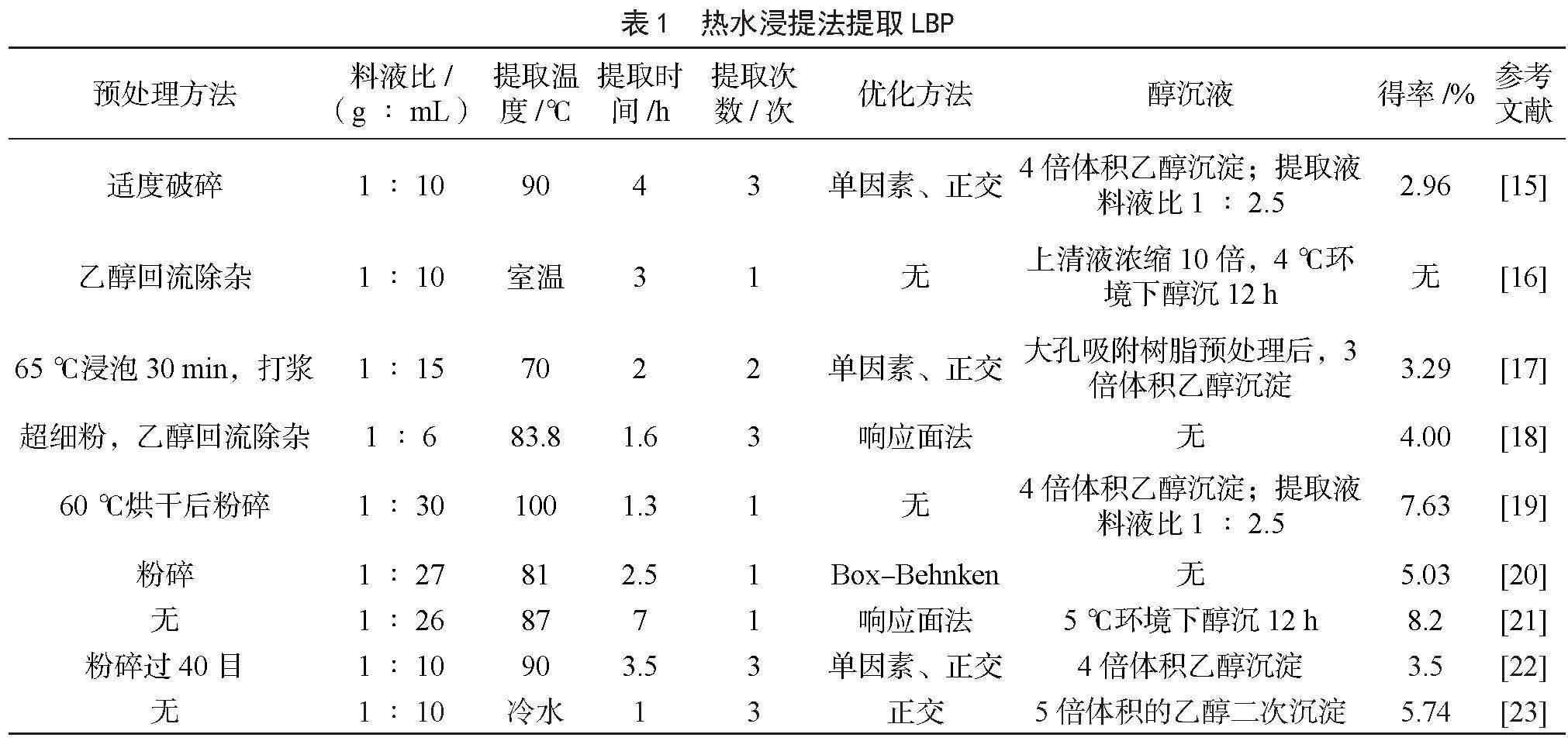
枸杞多糖作为极性大分子,最传统的提取方法是水提醇沉。水提法提取枸杞多糖主要考察的影响因素为提取温度、浸提时间、浸提次数、料液比。本文统计了近几年的热水浸提法的提取工艺,数据见表1。由表1可知,经方法优化后,枸杞多糖热水浸提温度多在70~90 ℃,提取时间在2~4 h,提取次数多为3~4次。但不同研究者采用料液比相差较大,从表1中可总结得出,其他条件相似的情况下,料液比是枸杞多糖的主要影响因素,最大可相差1.72倍。
不少研究者们也考察了其最佳醇沉比例,由表1可知,高春燕[15]研究结果显示,将提取液体积浓缩至原料质量的2.5倍后开始醇沉,此时多糖得率最高。KE等[16]研究结果显示,将提取液体积浓缩至与原料质量相同,加入4~5倍体积乙醇,并将醇沉液
4 ℃下放置12 h,此时多糖得率最高。徐鹏等[17]则采用大孔吸附树脂配合不同浓度的乙醇溶液分阶段洗脱的方式对枸杞多糖进行初步纯化,有较好的除杂效果。有些研究者采用二次或三次反复醇沉的方式除杂,YIN等[19]、李丹丹等[20]采用乙醇、丙酮或乙醚等试剂反复洗涤沉淀,以除去多糖中的杂质。
2.2 碱水浸提
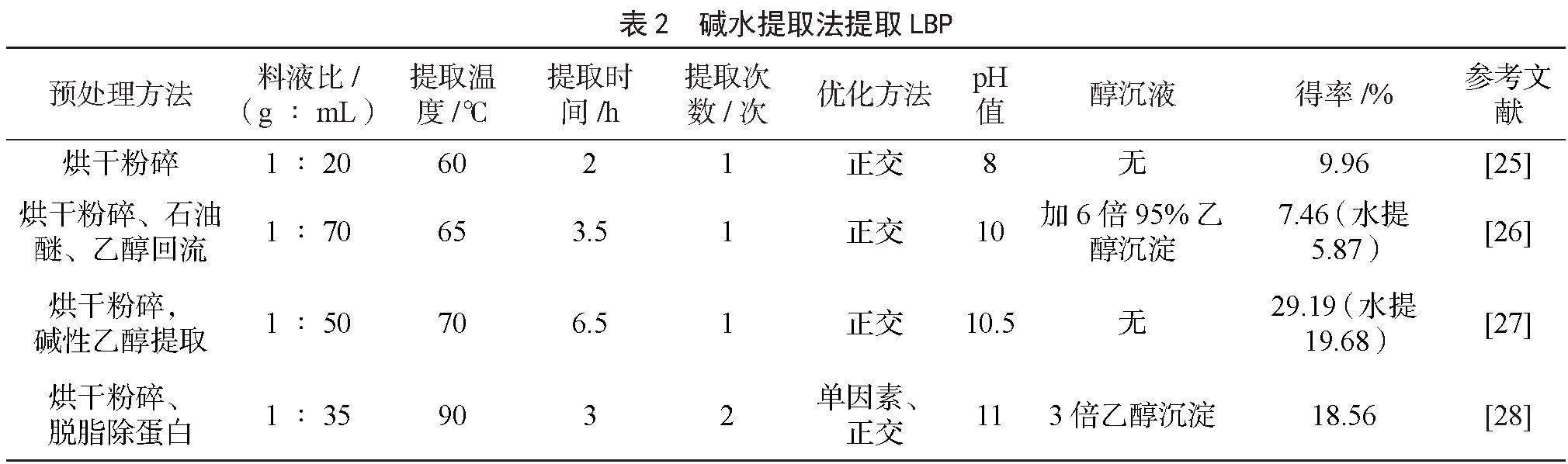
碱溶液具有腐蚀性,可破坏植物细胞组织,从而增加多糖成分的溶出,提高得率。此外,枸杞多糖为酸性多糖,其糖苷键在pH值适宜的碱液中较为稳定[24],使其在碱溶液中溶解度增加,这也提高了其得率。但温度过高、pH值增大会使糖的一些副反应加快,引起多糖发生水解,使多糖的活性结构被破坏、从而导致多糖得率减少[25]。在浸提过程中,料液比、提取温度、时间、pH值等条件的优化显得尤为重要。本文统计了近几年的碱液提取法的提取工艺,数据见表2。由表2可知,经优化后的碱液提取法的pH值多在8~11,提取温度多在60~70 ℃,料液比相差较大,提取次数多为1次。
2.3 超声波辅助提取
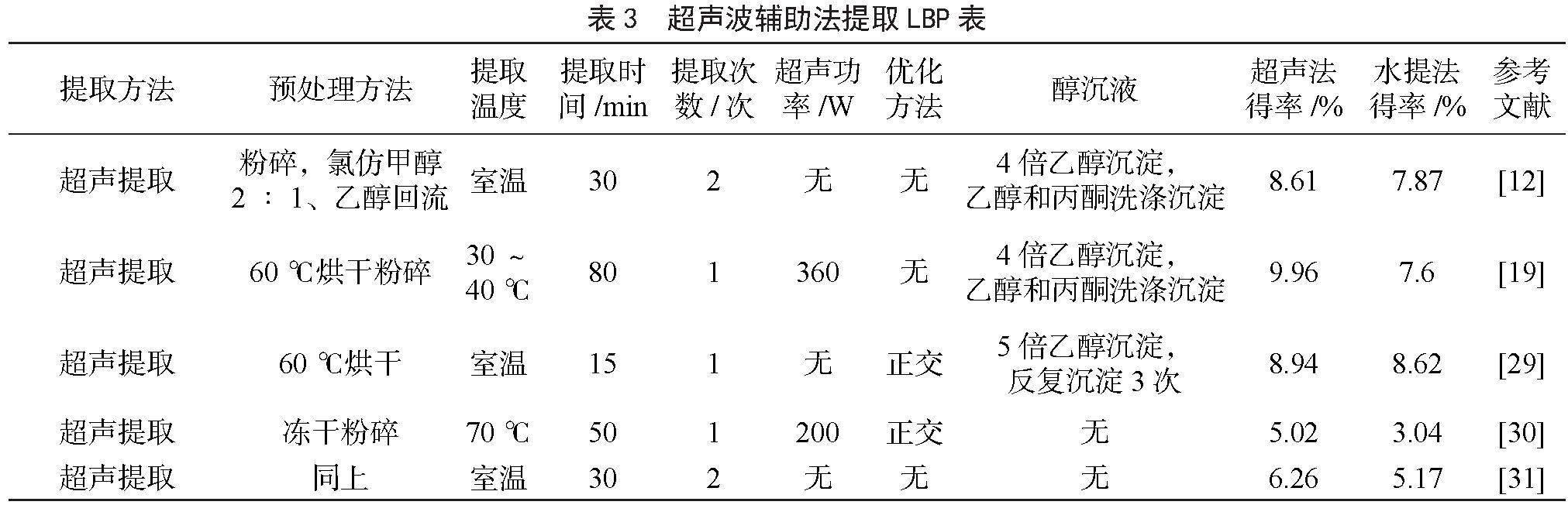
超声波辅助提取是依靠超声波辐射压强形成的空化效应、机械效应等多种次级效应,促使溶剂破碎植物细胞和组织,从而加快多糖溶出速度,提高多糖提取效率。本文统计了近几年的超声辅助提取法的提取工艺,部分数据见表3,研究人员通过对比枸杞多糖得率对超声提取与水提法两种提取方法进行对比评价(部分文献没有注明超声功率数值,故表中写无)。对文献中的实验条件进行分析可知,超声法提取所需温度比水提法低,部分研究者直接选择室温;提取次数多为1次;提取时料液比的选择有较大差异,但多集中在1∶20~1∶30;提取时间较浸提法显著缩短,在15~50 min,多集中在30 min 左右;超声功率大多在200 W左右。由表3可知,超声提取效率要比水提法高。根据YANG等[18]的研究结果,超声提取枸杞多糖的抗氧化能力和多糖分子量皆弱于热水提取法所得的枸杞多糖,可能是因为大功率超声引起了枸杞多糖的降解,使其分子量减小,活性结构被破坏。综上所述,与水提法相比,超声波提取可以在较低的温度下完成提取,且工艺简便、提取高效,无论是单独使用还是与其他技术相结合,提取效率都优于传统水提法。但当超声功率过高时,易破坏大分子多糖结构,使其发生降解。
2.4 微波辅助提取
在微波交变磁场的作用下,极性分子产生极性振荡,细胞内结构被破坏,溶剂被加热,提取组分加速溶出。研究者在研究微波辅助提取枸杞多糖时多以其得率、含糖量、生物活性作为指标,将料液比、浸提温度、浸提时间、浸提次数及功率等参数作为优化对象。本文统计了近几年的微波辅助提取法的提取工艺,数据见表4。由表4可知,料液比多在1∶10~1∶30;多提取2次;提取温度40~140 ℃;提取时间的选择则差异较大,其中10 min以内居多。其中,邱志敏、史高峰、郑玲利、严成等[32-35]对比了微波法、超声法与水提法,研究结果显示,总体而言,微波提取多糖得率最高,超声法次之。但采用密闭高压微波提取法提取得到的枸杞多糖,得率与相对分子质量却均低于水提法。可能是其采用的功率、压力与温度过高所致。微波辅助提取法提取效率高,所需温度低。但当微波提取的功率过高或时间过长时,可能引起爆沸,阻碍多糖溶出,甚至会导致多糖的得率低于水提法;且过高的功率会造成多糖结构的破坏而使其降解,导致多糖的得率不佳,分子量变小,从而使其生物活性受到影响。
2.5 生物酶提取
利用酶降解枸杞细胞壁和细胞间质中纤维素、果胶、蛋白等物质,释放多糖以提取枸杞多糖。目前研究常见的酶为果胶酶、纤维素酶和木瓜蛋白酶等。多糖得率受到复合酶的配比、种类、加入量、酶解温度、酶解时间和酶解 pH 值等条件的影响。本文统计了近几年酶法提取的提取工艺,数据见表5。由表5可知,酶解温度集中在50~60 ℃;酶的种类多为木瓜蛋白酶、纤维素酶和果胶酶;提取溶液的pH多在3~5。其中吴素萍、李阳等[38-39]发现酶提法效率高于水提,且所用时间短,耗能低,缪凤、师婷婷等[40-41]研究结果显示相对于单一酶而言,复合酶提取效果最佳。陈建双、王杉杉等[42-43]研究结果显示复合酶提取法辅以微波或超声波等先进方法,提取率更佳。酶法提取多糖是一种条件温和、过程可控且高效的环境友好型提取方法,同时酶独有的底物专一性优势,使其减少了对目标多糖的破坏。但由于酶的价格高昂,使得该法成本较高,难以适用于产业化生产。
2.6 多法联用提取
部分学者采用多法联用的方式进行提取,以多糖得率为指标,通过正交法、响应面法、Box–Behnken设计等方式优化提取工艺,并取得了较好的效果。其中,陈吉生等[44]以超声技术辅助碱液提取,使枸杞多糖得率達到7.44%。LIU等[45]以超声辅助纤维素酶浸提,发现该法下枸杞多糖得率与热水提取法相比提高了75.5%。ZHAO等[46]以超声强化亚临界水提取法(Ultrasound-Assisted Subcritical Water Extraction,USWE),与普通的亚临界水提取法相比,超声辅助使其对枸杞多糖的提取率提高了11.38%,与传统水提法相比,超声提取的提取率提高了9.4%。张倩等[47]采用超声协同微波法得到的枸杞多糖,得率比水提法提高43%;DONG等[48]采用超声协同微波法,结果显示该法的枸杞多糖得率达到87%,比单纯的水提法、微波提取、超声波提取都要高,但需要关注微波可能引起的多糖结构破坏。王启为等[8]采用了微波辅助酶法提取LBP,得率达13.2%。
2.7 新提取技术的应用
随着枸杞多糖研究的深入以及多学科领域的相互渗透,近些年不断有新技术、新方法应用到枸杞多糖的提取中来。例如,亚临界水提取法、高压脉冲电场提取技术、高速剪切技术辅助提取法、反复冻融提取法等。
亚临界水提取法是通过改变亚临界水的水温和压力,使水成为在100 ℃以上、临界温度374 ℃以下时仍能够保持液态的亚临界水,此时水的极性发生改变,可以选择性地提取目标成分。ZHAO[46]研究结果显示,亚临界水提取枸杞多糖的得率比热水浸提法提高30%,抗氧化能力也优于热水提取。吴健永[49]研究结果显示,超声增强亚临界水提法提取枸杞多糖的得率为水提法的1.66倍,为超声提取法的1.35倍,为亚临界提取法的1.14倍。
高压脉冲电场提取技术利用脉冲电场产生的脉冲磁场,对溶剂反复施加高电压的短脉冲,引发细胞膜穿孔效应,可瞬间破坏细胞膜组织,使目标组分溶出。高压脉冲电场提取法使用溶剂少,有高效、多糖得率高的优势。蔡光华等[50]采用该法结合碱液对枸杞多糖进行提取,其得率达到13.26%。
高速剪切技术辅助提取即利用高速剪切分散乳化技术,使用高剪切分散乳化机对样品进行预处理,使样品被各种机械效应均质粉碎。杜津昊等[51]采用该法提取枸杞多糖,得率达27.86%。
反复冻融提取法利用反复冷冻与融化时细胞中形成的冰晶对细胞壁的机械作用,以及液体中增高的盐浓度使细胞破裂。该法不需要特殊仪器,操作简单,且所需成本小,适合工业放大生产。温梓辰等[52]通过正交实验优化了反复冻融法提取枸杞多糖的工艺流程,使其得率可达到15.651%,较传统水提法得率要高,但相关研究较少,有待进一步研究。
3 枸杞粗多糖的分离纯化
枸杞粗多糖中仍含有较多杂质,如游离蛋白、色素、小分子糖等。需要进一步对其进行分离纯化,常见的方式有分级醇沉、溶剂法、透析法、超滤法、离子交换色法纯化、大孔树脂法纯化和凝胶过滤法等。
3.1 提取液的预处理
(1)除蛋白。除去游离蛋白质是纯化多糖的第一步。多糖除蛋白常见的方法有Seveage法、盐酸法、三氯乙酸法、三氟三氯乙烷法、酶法和聚酰胺吸附法等。近年来,部分研究者也尝试引入了一些新的除去游离蛋白的方法,如双水相萃取法[53]、浊点萃取法以及膜分离法等。彭强等[54]以多糖和蛋白质质量分数为考察指标,对比了Seveage法、三氯乙酸法、盐酸法除蛋白效果,发现三氯乙酸法脱蛋白率最高且多糖保留率最小,为最佳脱蛋白方法。胡晓玮等[55]采用浊点萃取法PEO10PPO23PEO10(聚环氧乙烷-环氧丙烷-环氧乙烷,L44)浊点萃取体系去除了LBP中的蛋白杂质,LPB回收率与杂质蛋白质除杂率高达到81%与87%。胡钰涛等[56]利用不同两相系统间分配系数的差异,采用双水相萃取法L44-NaH2PO4体系(24%NaH2PO4,20%L44)对枸杞多糖进行萃取,其下相中多糖的回收率可达到96.31%,蛋白质残留率为5.64%。王赟等[57]使用聚环氧乙烷-聚环氧丙烷-聚环氧乙烷(EO-PO-EO)与无机盐形成的双水相体系,使枸杞多糖回收率达96.3%,而游离蛋白质残留率仅5.6%。
(2)脱色素。常见的多糖脱色方法有活性炭脱色、双氧水脱色法和大孔树脂吸附法、离子交换脱色法。彭强等[54]以枸杞多糖回收率和脱色程度为考察指标,对比了活性炭吸附脱色法、过氧化氢法、树脂法和乙醇法脱色效果,结果显示,活性炭吸附脱色法和树脂吸附法会吸附大量多糖,且效果不佳,但过氧化氢法脱色效果较好。鲁晓丽等[58]采用9种大孔吸附树脂进行LBP提取液脱色实验,结果表明,树脂吸附脱色的效果较好,其中D318树脂效果最佳,其脱色率、多糖回收率和杂质蛋白清除率分别为67.32%、85.49%和58.76%。许程剑等[59]采用单因素试验确定为枸杞多糖脱色的最佳大孔树脂型号与最佳脱色条件,结果显示AB-8 大孔树脂的脱色效果最好;最佳脱色条件为温度60 ℃,料液比1∶7,脱色时间3 h。此外,DEAE-纤维素是当前最常用的脱色方法,通过离子交换填料不仅可达到脱色目的,而且能够初步分离多糖。
(3)除脂肪。潘泰安等[60]、杨鑫[61]采用超临界CO2萃取法,除去枸杞中油和蜡质,后再以水提法萃取枸杞多糖,使其含量在65%~90%,得率60%~78%,可溶性好,且有较强的抗氧化活性。当CO2处于其临界温度和临界压力以上时,兼有气液两种特性,且密度大、黏稠度小、扩散系数高,故萃取效果好,过程无有机溶剂残留,高效,无污染。但该法所需设备复杂,提取范围有限,难以放大到生产中。
3.2 膜分离
膜分离是一种广泛应用的物理分离方法,可在分离纯化的同时达到浓缩的效果,相较于传统的旋蒸法,膜分离更加高效且能最大限度保证目标产物的活性。LIN等[62]与曹丽春等[63]将该法引入枸杞多糖的提取分离工艺之中,结果显示酵母在代谢过程中消耗了大量单糖或寡糖,而多糖含量基本不变,可以提高多糖的纯度。ZHANG等[64]采用了截留分子量为80 kDa、30 kDa、10 kDa、4 kDa的超滤膜,截留LBP提取液,并都得到了5个组分,并对其进行结构解析。姚瑞棋等[65]用超滤法处理LBP提取液,得到6种不同分子量的LBP样品。张桂[66]采用了微滤结合超滤的方法分离枸杞多糖,并优化了操作压力、操作时间及料液温度等参数,以达到最佳膜通量,可使枸杞多糖的截留率达到90.4%。唐仕荣等[67]采用超滤方法对枸杞多糖进行分级后进行氧自由基清除能力分析,证明分子量在30~50 kDa的LBP抗氧化能力最强。李越鲲等[68]采用膜分离技术将枸杞多糖LBP分离成4种分子量范围的多糖。
3.3 离子交换层析
离子交换色谱实现分离效果的基础是目标物质分子表面所带电荷的差异,即使不同物质之间所带电荷差异非常微小,也能够将其分开。离子交换色谱法中,根据基质的不同,可以将填料分为纤维素(Cellulose)、聚合物(Sephadex)或琼脂糖(Sepharose)3种;根据功能基团的不同,离子交换填料可分为强阴(Q)、弱阴(DEAE、ANX)、强阳(S、SP)、弱阳(CM)。其中弱阴离子交换层析填料具有更好的选择性,故目前在多糖分离方面,弱阴离子交换层析应用最广。王岸娜等[69]采用离子交换法分离壳聚糖,分离条件:线性梯度洗脱;缓冲液为0.05 mol·L-1 pH值为5.3的乙酸-乙酸钠缓冲液;洗脱液为0.2 mol·L-1 NaCl。陈永等[70]采用离子交换色谱法纯化红毛五加多糖,分離条件:DEAE- cellulose32离子交换柱(OH-型,2.6 cm×26 cm);缓冲液为0.01 mol·L-1磷酸缓冲液(pH=6.0);洗脱液为1.0 mol·L-1NaCl磷酸缓冲液(pH=6.0);直线梯度洗脱;流速为 1.0 mL·min-1。所得多糖组分经凝胶层析进一步纯化得多糖纯品。何进等[71]采用DEAE-纤维素(OH-型)柱分离LBP,以水为流动相;以NaCl为洗脱液。级分经G-25柱纯化,得到4组均一多糖。张倩等[72]采用DEAE-52(OH-型)柱分离LBP,以水为流动相;以NaCl为洗脱液,级分经葡聚糖凝胶G-50进一步纯化后得到两个均一组分。王娅[73]采用超滤与DEAE-纤维素相结合对枸杞粗多糖分离纯化,并采用蒸馏水、各浓度NaCl为洗脱液,得到5种多糖组分。除了多糖的分离,周迅[74]采用离子交换层析,除去了LBP提取液中重金属杂质,结果显示其捕捉金属离子效果颇佳。
3.4 分子排阻色谱
分子排阻色谱在枸杞多糖分离纯化方面应用极广。多数研究者将凝胶色谱常与离子交换色谱结合使用来分离枸杞多糖。常见的联用顺序一般是先采用DEAE离子交换层析柱对枸杞多糖分级,所得到的级分分别经凝胶色谱层析进一步层析。有些级分经凝胶色谱层析后,洗脱曲线已经为单一对称的峰,则可被鉴定为均一多糖,有些级分经凝胶色谱层析后,洗脱曲线仍为2个或3个峰,则应由此进一步分离纯化得到亚组分。本文统计了近些年关于柱色谱联用法在枸杞多糖分离纯化的应用情况,如表6所示。田庚元[75]将LBP经DEAE结合Sephadex G-100得到5种均一多糖。齐春会等[76]进一步将LBP1、LBP3、LBP4经Sephadex凝胶层析柱纯化得到3种均一的糖缀合物及其糖链。黄琳娟等[77]进一步将LBP3、LBP4和LBP5分别经Sephadex凝胶层析柱纯化,得到3种均一多糖。张晶等[78]将LBP经DEAE(OH-)纤维素分离得到4个组分;苟春林等[79]将LBP经DEAE-32纤维素分离、Sephacryl S-300葡聚糖凝胶纯化,所得产物用以协助枸杞多糖指纹图谱分析的建立。牛忻等[80]将LBP经DEAE结合超滤、凝胶色谱层析分离纯化,得到5种均一多糖。
4 展望
当前市场上,枸杞多糖缺乏具有较强市场竞争力的高附加值产品,迄今尚无成熟的产品面世,在市场规模化、产业集约化、标准化的进程上远逊于如香菇多糖与黄芪多糖等植物多糖。其主要原因有以下两点:质量控制标准的缺失、提取纯化技术的不足。这使得枸杞相关产品开发科技含量低、研究科技成果转化率低、难以形成产业链,这与当前庞大的枸杞产量与市场需求量不相匹配[86-88]。
作为药食同源的特殊商品,枸杞营养价值高,药理活性多样且安全可靠,呈现出广阔的应用和开发前景。应抓住时代发展的机遇,充分利用我国枸杞得天独厚的区域生态和资源优势,加快枸杞多糖基础研究,提升我国枸杞资源综合利用率。建立一个科学规范的研究与生产大环境,才能进一步加深枸杞多糖的开发与应用[89]。
参考文献
[1]董静洲,杨俊军,王瑛.我国枸杞属物种资源及国内外研究进展[J].中国中药杂志,2008,33(18):2020-2027.
[2]王晓宇,陈鸿平,银玲,等.中国枸杞属植物资源概述[J].中药与临床,2011,2(5):1-3.
[3]李俊杰,雷婷.枸杞多糖提取分离技术的研究进展[J].广州化工,2023,51(14):19-21.
[4]吴中华,李文丽,赵丽娟,等.枸杞分段式变温热风干燥特性及干燥品质[J].农业工程学报,2015,31(11):287-293.
[5]赵丽娟,王丹丹,李建国,等.枸杞真空远红外干燥特性及品质[J].天津科技大学学报,2017,32(5):17-22.
[6]张琪,赵宗阁,叶晨,等.枸杞子粉碎前几种预处理方法的比较研究[J].中草藥,2018,49(24):5812-5816.
[7]邹东恢,郭建华,魏小娟.枸杞多糖的双酶法提取与纯化工艺研究[J].农业机械,2011(22):166-169.
[8]王启为,晋晓勇,全晓塞,等.微波-纤维素酶法提取枸杞多糖的工艺研究[J].生物学杂志,2013,30(6):95-98.
[9]YANG R F,ZHAO C,CHEN X,et al.Chemical properties and bioactivities of Goji (Lycium barbarum) polysaccharides extracted by different methods[J].Journal of Functional Foods,2015,17:903.
[10]ZHANG M,WANG F,LIU R,et al.Effects of superfine grinding on physicochemical and antioxidant properties of Lycium barbarum polysaccharides[J].LWT-Food Sci Technol,2014,58(2):594-601.
[11]LIU W,XU J,ZHU R,et al.Fingerprinting profile of polysaccharides from Lycium barbarum using multiplex approaches and chemometrics[J].International Journal of Biological Macromolecules,2015,78:230-237.
[12]阿依姑丽·艾合麦提,王颖,杨晓君,等.枸杞多糖提取方法及两种不同产地枸杞中多糖含量的比较研究[J].新疆农业科学,2007,44(5):724-728.
[13]LUO Q,LI J,CUI X,et al.The effect of Lycium barbarum polysaccharides on the male rats reproductive system and spermatogenic cell apoptosis exposed to low-dose ionizing irradiation[J].J Ethnopharmacol,2014,154(1):249-258.
[14]胡仲秋,刘建党,王保玲.枸杞多糖的碱液提取工艺研究[J].西北农林科技大学学报(自然科学版),2008,36(10):173-178.
[15]高春燕.枸杞多糖的提取分离技术及其特性研究[D].西安:陕西师范大学,2006.
[16]KE M,ZHANG X J,HAN Z H,et al.Extraction, purification of Lycium barbarum polysaccharides and bioactivity of purified fraction[J].Carbohydr Polym,2011,86(1):136-141.
[17]徐鹏.枸杞水溶性成分的研究[D].无锡:江南大学,2009.
[18]YANG R,ZHAO C,CHEN X,et al.Chemical properties and bioactivities of (Lycium barbarum) polysaccharides extracted by different methods[J].J Funct Food,2015,17:903-907.
[19]YIN G,DANG Y.Optimization of extraction technology of the Lycium barbarum polysaccharides by Box-Behnken statistical design[J].Carbohydr Polym,2008,74(3):603-610.
[20]李丹丹,吳茂玉,宋烨,等.响应面分析法优化枸杞多糖的提取工艺[J].中国果菜,2014,34(6):19-23.
[21]刘琳,鄢瑞明,曾凡骏.响应面法优化枸杞多糖提取的研究[J].食品与发酵科技,2011,47(6):32-35.
[22]王月囡,辛广,翁霞.两种不同方法提取枸杞多糖的比较研究[J].鞍山师范学院学报,2010,12(4):39-43.
[23]植飞,郑卫平,陈平,等.枸杞多糖水提工艺的优选[J].中药材,2004,27(12):948-950.
[24]陈吉生,吕剑豪.枸杞多糖提取工艺研究[J].医药导报,2011,29(5):649-652.
[25]王玉霞,尹旭敏,张超.枸杞多糖热浸提工艺研究[J].酿酒科技,2017(4):36-41.
[26]张君,段丽爽,常南.枸杞多糖水提法提取条件的研究[J].新农业,2018(23):11-15.
[27]胡仲秋,王利,王保玲,等.枸杞多糖碱性乙醇提取及消除羟基自由基活性研究[J].食品科学,2009,30(24):93-98.
[28]汪琢,赵佳莹,廖林,等.枸杞多糖提取条件优化及体外抗氧化活性研究[J].湖北农业科学,2015,54(6):1440-1444.
[29]蔡宇.超声法提取枸杞多糖工艺条件优选[J].中成药,2010,32(10):1820-1822.
[30]刘腾子,赵春玲,张成军,等.超声法提取枸杞多糖的工艺研究[J].广东化工,2014,41(18):18-19.
[31]张自萍,黄文波.枸杞总黄酮和多糖的超声提取及含量测定[J].农业科学研究,2004,27(12):22-24.
[32]邱志敏,芮汉明.微波辅助提取枸杞多糖的工艺优化及其抗氧化性研究[J].食品工业科技,2012,33(7):220-223.
[33]史高峰,李娜,陈学福,等.微波辅助提取枸杞中总多糖的工艺研究[J].中成药,2011,33(3):521-524.
[34]郑玲利,李燕,黄玲,等.枸杞多糖的微波提取及抗氧化性分析[J].解放军药学学报,2016,32(1):1-4.
[35]严成,严夏.枸杞多糖提取工艺比较及体外抗氧化性研究[J].食品科学,2008(7):183-187.
[36]范会平,符锋,GIUSEPPE M,等.微波提取法对樱桃、猕猴桃和枸杞多糖特性的影响[J].农业工程学报,2009,25(10):355-360.
[37]陈金娥,李成义,张海容.微波法与传统工艺提取枸杞多糖的比较研究[J].中成药,2006,28(4):573-576.
[38]吴素萍,徐建宁.酶法提取枸杞多糖的研究[J].食品科技,2007,32(8):114-117.
[39]李阳,赵春玲,王晓晓,等.酶法提取枸杞多糖的工艺研究[J].广州化工,2014,42(20):59-60.
[40]缪凤.枸杞多糖酶提、分离纯化及抗氧化和免疫活性研究[D].扬州:扬州大学,2021.
[41]师婷婷.生物酶与超滤纯化在枸杞多糖和总黄酮提取中的应用研究[D].兰州:甘肃中医药大学,2016.
[42]陈建双,苗惠,杨雪,等.微波辅助复合酶法提取枸杞多糖及其抗氧化活性研究[J].粮食与油脂,2024,37(2):132-136.
[43]王杉杉,马韵升,姚刚,等.超声波辅助复合酶法提取枸杞多糖工艺研究[J].中国酿造,2015,34(7):134-137.
[44]陈吉生,吕剑豪.超声法提取枸杞多糖工艺研究[J].今日药学,2009,19(12):46-48.
[45]LIU Y,GONG G,ZHANG J,et al.Response surface optimization of ultrasound-assisted enzymatic extraction polysaccharides from Lycium barbarum[J].Carbohydrate Polymers,2014,110:278-284.
[46]ZHAO C,YANG R F,TAI-QIU Q.Ultrasound -enhanced subcritical water extraction of polysaccharides from Lycium barbarum L[J].Separation and Purification Technology,2013,120:141-147.
[47]张倩,李书启.不同提取方法对枸杞多糖提取率及抗氧化活性的影响[J].江苏农业科学,2019,47(3):169-173.
[48]DONG J Z,WANG Z C,WANG Y.Rapid extraction of polysaccharides from fruits of Lycium barbarum L.[J].Journal of Food Biochemistry,2011,35(4):1047-1057.
[49]吴建勇,杨日福,陈舜宏,等.一种超声强化亚临界水高效提取枸杞多糖类活性成分的方法:201410059329.5[P].2014-02-21.
[50]蔡光华,王晓玲.高压脉冲电场提取枸杞多糖工艺[J].食品科学,2012,33(8):43-48.
[51]杜津昊,刘建飞,劉晓风,等.高速剪切技术辅助提取枸杞多糖工艺[J].食品工业,2017,38(3):128-132.
[52]温梓辰,荣雪,郭乃菲,等.反复冻融法对枸杞多糖溶出率的研究[J].安徽农业科学,2016,44(19):111-113.
[53]WU D T,CHEONG K L,DENG Y,et al.Characterization and comparison of polysaccharides from Lycium barbarum in China using saccharide mapping based on PACE and HPTLC[J].Carbohydrate Polymers,2015,134:12-19.
[54]彭强,吕晓鹏,白雪芳,等.黑果枸杞多糖的纯化工艺研究[J].西北农业学报,2012,21(2):121-126.
[55]胡晓玮.新型分离技术在天然邻羟基化合物分离纯化中的应用[D].镇江:江苏大学,2016.
[56]胡钰涛.聚合物—盐双水相体系液液相平衡及其在枸杞多糖分离纯化中的应用[D].镇江:江苏大学,2014.
[57]王赟,胡晓玮,韩娟,等.一种枸杞多糖的分离纯化方法:201410845008.8[P].2014-12-31.
[58]鲁晓丽,刘继婷,张自萍,等.大孔吸附树脂脱除枸杞多糖色素技术研究[J].食品工业科技,2014,35(18):293-297.
[59]许程剑,郭文波,赵玉华,等.新疆枸杞多糖提取与脱色工艺的研究[J].安徽农业科学,2012,40(5):2887-2889.
[60]潘泰安,毛忠英,张建成,等.枸杞多糖生产工艺及产品的开发研究[J].中国食品添加剂,2002(4):21-24.
[61]杨鑫.一种黑枸杞多糖的提取方法:201811028507.2[P].2018-09-05.
[62]LIN F Y,LAI Y K,YU H C,et al.Effects of Lycium barbarum extract on production and immunomodulatory activity of the extracellular polysaccharopeptides from submerged fermentation culture of coriolus versicolor[J].Food Chem,2008,110(2):446-453.
[63]曹丽春,董亮,王伟,等.酵母发酵法纯化枸杞多糖[J].食品工业科技,2007,28(3):114-116.
[64]ZHANG M,TANG X,WANG F,et al.Characterization of Lycium barbarum polysaccharide and its effect on human hepatoma cells[J].Int J Biol Macromol,2013,61:270-275.
[65]姚瑞祺,刘海英,牛鹏飞,等.不同分子量枸杞多糖的超滤法分离及抗氧化活性研究[J].食品工业科技,2008(5):89-91.
[66]张桂.膜分离技术提取枸杞多糖的工艺[J].食品工程,2008(4):23-25.
[67]唐仕荣,巫永华,刘恩岐,等.枸杞多糖的提取分级及其氧自由基清除能力分析[J].食品科技,2018,43(10):251-256.
[68]李越鲲,周旋,刘兰英,等.不同分子量枸杞多糖体外抗氧化活性研究[J].安徽农业科学,2012,40(29):14174-14175.
[69]王岸娜,王璋,许时婴.离子交换层析色谱法分离壳聚糖[J].无锡轻工大学学报,2003,22(6):75-80.
[70]陈永,卢戌,谭晓晶,等.红毛五加多糖的分离纯化和表观分子质量测定[J].四川大学学报(自然科学版),2005,42(2):373-376.
[71]何进,张声华.枸杞及枸杞多糖研究(Ⅰ)[J].食品科学,1995,16(2):14-21.
[72]张倩,张民,王超,等.枸杞多糖的分离纯化及结构研究[J].食品与发酵工业,2014,40(12):41-47.
[73]王娅.枸杞多糖分离纯化技术研究[D].银川:北方民族大学,2016.
[74]周迅.一种枸杞多糖提取液中重金属的去除方法[J].化学分析计量,2018,27(1):46.
[75]田庚元.枸杞子糖缀合物的结构与生物活性研究[J].世界科学技术,2003,5(4):22-30.
[76]齐春会,黄琳娟,张永详,等.枸杞糖缀合物及糖链的化学结构与免疫活性[J].中国药理学与毒理学杂志,2001,15(3):185-189.
[77]黄琳娟,林颖,田庚元,等.枸杞子中免疫活性成分的分离纯化及物理化学性质的研究[J].药学学报,1998,33(7):512-516.
[78]张晶,韩喜江,李艳波.枸杞多糖分离纯化及性质研究[J].黑龙江大学自然科学学报,2008,25(3):377-380.
[79]苟春林,苟金萍,张艳,等.枸杞多糖的提取分离及其组成研究[J].宁夏农林科技,2012,53(5):89-90.
[80]牛忻,闫娜,李笃信,等.枸杞多糖的分离鉴定与体外肠道代谢初步分析[J].天然产物研究与开发,2019,31(10):1682-1687.
[81]周立爽.枸杞多糖的结构鉴定及其生物活性研究[D].遵义:遵義医学院,2018.
[82]孙汉文,刘占锋.枸杞多糖的超声波辅助水提取与分级纯化[J].食品工业科技,2009,30(3):230-233.
[83]张民.一种枸杞多糖提取方法及枸杞多糖减肥制品:200510013216.2[P].2005-09-21.
[84]TANG H L,CHEN C,WANG S K,et al.Biochemical analysis and hypoglycemic activity of a polysaccharide isolated from the fruit of Lycium barbarum L.[J].International Journal of Biological Macromolecules,2015,77:235-242.
[85]张晶.东北枸杞中多糖的提取分离与活性研究[D].哈尔滨:哈尔滨工业大学,2008.
[86]曹林,张爱玲.我国枸杞产业发展的现状阶段与趋势分析[J].林业资源管理,2015(2):4-8.
[87]张芳,郭盛,钱大玮,等.枸杞多糖的提取纯化与分子结构研究进展及产业化开发现状与前景分析[J].中草药,2017,48(3):424-432.
[88]马运运,丹阳,孙志一,等.从发明专利视角分析枸杞子开发现状[J].中国现代中药,2016,18(5):541-546.
[89]张雪燕,戴瑜婷,王艺璇,等.枸杞化学成分和药理作用研究进展及质量标志物的预测分析[J].中华中医药学刊,2024,42(1):174-183.

