EB 病毒复燃导致弥漫性肺泡出血1例及文献复习
徐庆杰,薛晓艳
弥漫性肺泡出血(diffuse alveolar hemorrhage,DAH)是指以肺毛细血管、小动脉及小静脉损伤,终末细支气管以远的肺腺泡内广泛出血,充满含铁血黄素的巨噬细胞在间质内堆积为特征的临床综合征。DAH 临床常表现为咯血、贫血及进行性的低氧血症,胸部X线检查显示呈片状或弥漫性的肺部浸润,浸润可呈对称性或单侧浸润[1]。DAH 的病因很多,Collard 等[2]将其分为肺小血管炎、免疫性疾病、凝血障碍、特发性肺含铁血黄素沉着症及其他原因共五大类。由感染引起的DAH 在临床上并不多见,特别是EB 病毒(Epstein-Barr virus,EBV)复燃引起的DAH更为少见,相关报道也很少。本文就某院重症医学科曾经收治的1 例EBV 复燃导致DAH 的病例进行分析探讨,以期为临床诊断和治疗提供参考。
1 病例资料
患者男性,63 岁,主因“咳嗽、咳痰、喘憋伴发热1 周,加重3 天,腹痛1 天”于2022 年9 月12 日入院。患者于入院前1 周(9 月5 日)无明显诱因出现咳嗽、咳痰,为白色黏痰,量不多,伴喘憋,活动后加剧,夜间不能平卧,端坐呼吸。自觉发热,体温最高达37.5℃,无明显畏寒、寒战。无胸闷、胸痛等其他不适。入院前3 天(9 月9 日)喘憋症状加重,咳粉红色泡沫样痰,就诊于外院,诊断:心功能不全,肺部感染,呼吸衰竭,心房颤动。收住心内科监护病房,予以扩张冠状动脉、利尿、增强心功能、抗感染以及无创呼吸机支持等对症治疗,患者病情好转。入院前1 天(9 月11 日)患者出现上腹痛,腹部超声检查结果提示胆囊壁增厚合并胆囊积液、胰腺体积增厚,肝肾间强回声;心脏超声检查结果提示:左心大,主动脉瓣钙化伴反流(重度),二尖瓣前瓣脱垂伴反流(重度)。为进一步治疗转入某院重症医学科。患者自发病以来,神志清楚,无头晕、头痛、胸闷、胸痛、恶心、呕吐,小便较前有所减少,体重变化不详。既往高血压病史3 年余,平素口服硝苯地平治疗。否认其他病史。入院查体:神志清楚,鼻导管吸氧,心电监护示:心率112 次/min,血压96/59mmHg,呼吸20 次/min,外周血氧饱和度99%。双侧瞳孔等大等圆,直径约2.0mm,对光反射存在;双肺呼吸音粗,双下肺可闻及湿啰音;心律不齐,房颤心律,各瓣膜听诊区未闻及杂音;腹部平软,右上腹轻压痛,无明显反跳痛及肌紧张;双下肢水肿。
入院前辅助检查结果显示,血常规检查显示:白细胞计数13.55×109/L,中性粒细胞百分比85.9%,血红蛋白141g/L,血小板计数201×109/L。血气分析:酸碱度7.46,二氧化碳分压21.9mmHg,氧分压72mmHg。生化检查显示:肌酐143.8μmol/L,血钾4.8mmol/L。EBV-DNA阴性。
入院诊断:心功能不全、肺部感染、呼吸衰竭、急性胆囊炎、急性胰腺炎、心房颤动、肾功能不全、肝功能异常、低蛋白血症、贫血、高血压。
2 诊疗过程
入院后完善相关检查,胸部X 线片提示双肺感染性病变(图1)。化验结果显示,血常规:白细胞计数7.08×109/L,中性粒细胞百分比83.9%,血红蛋白123g/L,血小板计数123×109/L。生化:血钾4.70mmol/L,血钠145.3mmol/L,肌酐219.8μmol/L,谷丙转氨酶921.5IU/L,谷草转氨酶523.1IU/L,白蛋白31.10g/L。B 型钠尿肽3058.89pg/ml。降钙素原1.15ng/ml。EBV 衣壳抗原IgM 1.98U/ml,EBV衣壳抗原IgG>750U/ml,EBV 核抗原IgG 166U/ml。EBV-DNA 阳性。免疫相关指标均阴性。凝血功能:凝血酶原时间17.8s,D-二聚体3235μg/L,纤维蛋白原15.0mg/L。红细胞沉降率5mm/h。淋巴细胞亚群:总T 淋巴细胞493/μl,辅助T 淋巴细胞316/μl。

图1 患者入院时胸部正位X 线片检查结果
相关检查结果提示,患者心功能不全、肺部感染、呼吸衰竭诊断明确,伴有多脏器功能不全,予以强化抗感染治疗,同时扩张冠状动脉、稳定心功能以及脏器支持治疗,患者炎症指标水平下降,心功能趋于稳定,肝肾功能明显好转。EBV-DNA阴性。但是患者在入院5 天后(9 月17 日)出现发热,体温最高为37.5℃,伴咳嗽、呼吸困难及咯血,复查胸部X 线片及胸部CT 提示双肺弥漫性斑片影(图2)。复查化验结果显示,EBV 抗体6项中,EBV 衣壳抗原IgM 61.5U/ml,EBV 衣壳抗原IgG>750U/ml,EBV 核抗原IgG 130U/ml,EBV-DNA 阳性。血常规:白细胞计数13.93×109/L,血红蛋白110g/L,血小板计数128×109/L。生化:血钾3.87mmol/L,血钠145.8mmol/L,谷草转氨酶112.0IU/L,谷丙转氨酶50.0IU/L,白蛋白33.60g/L,肌酐103.1μmol/L,降钙素原0.37ng/ml。凝血功能:凝血酶原时间13.5s,D-二聚体3618μg/L,纤维蛋白原17.0mg/L。B 型钠尿肽2023pg/ml。
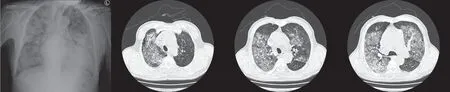
图2 患者2022 年9 月18 日复查胸部正位X 线片及胸部CT 检查结果
针对患者病情变化,考虑:①感染加重可能。结合患者血常规提示白细胞计数较前有所升高,但降钙素原呈下降趋势,痰培养未见阳性结果,考虑细菌感染可能性较小,而病毒或真菌感染可能较大,将抗菌药物调整为亚胺培南(1g,q8h)+莫西沙星(0.4g,qd)+伏立康唑(0.2g,q12h)抗感染治疗,经治疗后复查血常规,结果显示:白细胞计数9.48×109/L,血红蛋白106g/L,血小板计数119×109/L。且降钙素原0.25ng/ml。虽然感染相关指标水平下降,但患者仍有咯血。②心功能不全。患者入院时B 型钠尿肽升高、心功能不全,入院后予以强心治疗后,B 型钠尿肽较前下降,但仍偏高,且尿量不多(在1000ml/24h 左右波动),遂予以床旁血液净化治疗,强化脱水、改善心功能不全后,患者咯血情况仍没有明显好转。进一步行纤维支气管镜检查后,可吸出较多血性、偏稀薄痰液,并排除肺部感染性疾病及气道局部病变引起的出血。③凝血功能恶化。患者咯血是否与凝血功能相关,对比病情变化前后凝血功能结果,未见明显凝血功能恶化。于是重新梳理整个病情变化,回顾病史,患者有发热、咯血、呼吸困难,血红蛋白呈持续下降趋势,胸部X 线及胸部CT 均提示弥漫性肺部浸润,调整抗菌药物、加强心功能等治疗后效果欠佳,支气管镜可吸出血性液体。在病情变化后5 天(9月22 日)综合以上情况考虑患者DAH。
患者病情前后变化过程中,强化抗细菌及联合抗真菌治疗后效果欠佳,在病因筛查过程中,排除了血管炎、免疫性疾病、药物相关性、凝血功能异常等常见病因。而EBV 衣壳抗原IgM 较前明显升高( 从1.98U/ml 升至61.5U/ml),EBV-DNA 再次转阳,说明患者存在EBV 复燃。结合胸部CT 等影像学表现,考虑病毒感染导致的肺泡出血。联合应用抗病毒(更昔洛韦,0.3g,q12h)、糖皮质激素(甲泼尼龙,160mg)治疗,但患者病情改善不明显,伴氧合指数下降、血压降低,予以气管插管机械通气后,仍吸出大量血性痰液。考虑:抗病毒治疗未充分覆盖,激素用量不足,可联合免疫抑制剂治疗。遂予以联合奥司他韦(75mg,bid)、甲泼尼龙(500mg)冲击治疗,并应用环磷酰胺(0.2g),同时去甲肾上腺素0.5μg/(min·kg)维持血压。调整治疗2 天后(9 月25 日),患者氧合情况有所好转,咯血量及次数有所减少,升压药可减量,复查胸部X 线片提示双肺浸润明显好转(图3)。患者病情虽有好转,但仍然凶险,随时面临生命危险,患者家属要求转外院进一步治疗。后随诊,患者转院后2 天死亡。
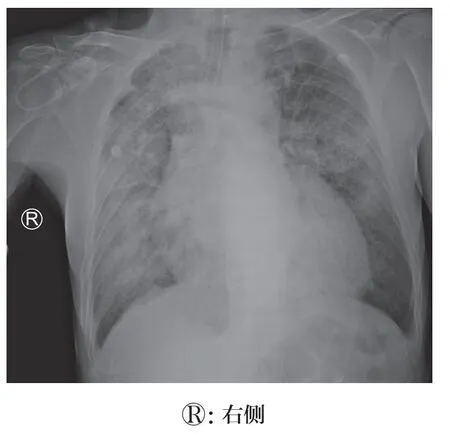
图3 患者2022 年9 月25 日复查胸部X 线结果
3 讨论
3.1 EBV 及EBV 复燃的定义与诊断
EBV 是疱疹病毒科嗜淋巴细胞病毒属成员之一,其基因组为双链线性DNA 分子[3]。病毒携带者和患者是该病的传染源,主要传播途径为唾液传播。EBV 侵入机体后主要感染口咽部的上皮细胞和B 淋巴细胞[3-4]。被EBV 感染的细胞可获得EBV的基因组,从而产生各种抗原,例如EBV 核抗原、早期抗原、膜抗原、衣壳抗原以及淋巴细胞识别膜抗原等。EBV 可以很容易地将原代人类B 细胞在培养中转化为永生化类淋巴母细胞样细胞系,因此又被称为人类最强大的肿瘤病毒。EBV 感染机制包括潜伏感染和裂解性感染2 种。EBV 原发感染人体后一般呈潜伏感染状态,当人体免疫力低下时,EBV 被激活并增殖进入裂解性感染阶段[5-6],即大量病毒释放、持续存在且不能被清除[7]。非肿瘤疾病多为裂解性感染,伴随EBV-DNA 转录,衣壳抗原、早期抗原充分表达,成熟病毒颗粒产生且伴有宿主细胞溶解死亡,因此裂解性感染又称为溶细胞感染[6]。EBV 感染的B 淋巴细胞大量进入血液循环会造成全身性感染,并且EBV 可长期潜伏在人体淋巴组织,当机体免疫功能低下时,潜伏的EBV 活化形成复燃[8]。目前EBV 复燃尚无公认的定义标准,根据已发表的其他国际临床研究中心的评价标准[9-10]并结合重症医学科的临床诊治经验,将EBV 复燃定义为EBV-DNA 连续2 次拷贝数>5×102/ml,并且此前血浆EBV-DNA 连续2 次拷贝数<5×102/ml;若未行EBV-DNA 检测或EBV-DNA 阴性,此前存在抗原IgG 阳性、IgM 阴性,后IgM 转阳也可定义为复燃。不同年龄EBV 感染患者体内病毒的复制及抗病毒免疫反应存在差异。在EBV 急性感染期,患者病毒特异性CD4+T 淋巴细胞数绝对值一般会急剧增加,但老年患者的急性感染症状不明显,且T 淋巴细胞总数及CD4+T 淋巴细胞数甚至低于正常人群。本例患者在先前的治疗中,EBV-DNA曾转阴,但是在病情恶化后,复查EBV 抗原,可见EBV 衣壳抗原IgM 显著升高,EBV-DNA 转阳,考虑EBV 被重新激活导致EBV 复燃。
3.2 DAH 的诊断及发生机制
临床上的DAH 患者多数因发热、咯血或呼吸困难而就诊,容易误诊为肺炎、支气管扩张、肺结核及肺栓塞等疾病,延误治疗时机。DAH 多发生在一系列严重疾病过程中,是一种危及生命的严重并发症。在各种因素(诱因)作用下,患者体内细胞因子被激发并爆发释放,致使弥漫性肺泡微循环损伤、肺微血管内的血液进入肺泡,导致呼吸衰竭[11]。DAH 病情进展迅速、病死率高,其主要表现为发热、咯血、咳嗽、气促等,症状不具有特征性。大部分DAH 患者具有不同程度的咯血,可从咳血丝痰到大量咯血;约1/3 的DAH 患者没有咯血症状,这类患者容易漏诊。如果诊断困难,建议及早进行支气管肺泡灌洗,多段肺泡灌洗回收液呈血性或肺泡巨噬细胞含有含铁血黄素可以确诊DAH[12]。
DAH 患者常有发热,典型的影像学改变是局部或弥漫性的肺部浸润、磨玻璃影或实变影[13]。对于存在发热、咯血、贫血及肺部浸润的患者,若使用抗菌药物治疗后疗效不佳,需怀疑DAH,并尽快行支气管镜检查,排除肺部感染性疾病及气道局部病变引起的出血。若多个肺段连续吸出血性液体或连续肺泡灌洗液都为血性,可证实存在肺泡出血[14]。DAH 的根本原因在于肺泡血管受损导致红细胞进入肺泡间隔和肺泡腔,其可以由多种原因引起。王维等[7]对138 例儿童DAH 的病因进行统计,结果显示感染占10.1%。引起DAH 的感染性疾病中,免疫功能正常者感染的病原体主要为甲型流感病毒、钩端螺旋体、疟原虫及金黄色葡萄球菌等;免疫功能低下者感染的病原体主要为巨细胞病毒、腺病毒、肺炎支原体,以及曲霉等真菌[15]。EBV 导致肺泡出血较为少见,关于感染导致DAH的具体发生机制目前尚未明确,特别是病毒感染尚无相关研究报道。不同病因导致感染患者的病程、病情及预后存在一定差别,病毒感染致DAH 与细菌感染机制可能也不完全相同,但可以作为参考。王晓陶等[16]认为,细菌感染导致DAH 可能与以下几方面有关:①细菌直接侵入肺泡生长,引起毛细血管的扩张充血,红细胞外渗。②细菌产生内毒素,损伤血管内皮细胞。③细菌感染引起坏死性肺炎,侵袭肺血管,引起弥漫性出血。④某些细菌(如铜绿假单胞菌)可产生蛋白水解酶,可广泛降解肺血管基底膜。
3.3 甲泼尼龙联合环磷酰胺治疗EBV 复燃致DAH 的疗效
在DAH 的诊治过程中,寻找病因、针对病因选择合适的治疗方案尤为关键。大剂量激素和免疫抑制治疗是大多数DAH 患者的首选。本例患者虽然没有自身免疫性疾病的基础,但入院时已有感染情况且伴心功能不全症状,淋巴细胞亚群水平也提示患者免疫功能下降。此外,EBV 衣壳抗原IgG>750U/ml,EBV 核抗原IgG 166U/ml,EBV-DNA 阳性,考虑患者感染EBV,经过治疗后EBV-DNA 转阴,随着病情进展,患者免疫状态恶化,EBV 开始呈裂解式增殖,并大量释放,复查EBV 衣壳抗原IgM 61.5U/ml,EBV 衣壳抗原IgG>750U/ml;EBV 核 抗 原IgG 130U/ml,EBVDNA 阳性。EBV 感染过程中会产生多种抗体,也是人类多种自身免疫性疾病的相关因素,因此予以大剂量激素冲击联合免疫抑制剂进行治疗,同时强化抗病毒等综合治疗,治疗后患者氧合指数、影像学检查均有所好转,考虑治疗有效。此后因患者家属要求转外院治疗,转外院后2 天死亡。由此可见,EBV导致的DAH 一旦发生,进展迅速,常危及生命。
4 小结
近年来,随着DAH 患者的增多及对相关疾病认识的加深,除常见可引发DAH 的因素以外,临床还需关注感染因素导致的DAH。目前成人EBV 感染的发病率逐渐增高,提示临床中需进一步关注病毒感染,提高对病毒感染的认识,这有利于疾病的早期诊断及治疗。EBV 复燃病情进展极快,需要尽早识别,及时予以大剂量激素冲击,必要时联合免疫抑制剂进行治疗,为挽救患者生命争取一线生机。

