影像学在肾血管性高血压评估中的进展
林志勇 邱建星
【摘要】肾血管性高血压是继发性高血压最常见的原因之一,是指由肾动脉狭窄引起的高血压。绝大多数肾动脉狭窄是由动脉粥样硬化或纤维肌肉发育不良引起。随着影像学检查技术的快速发展,该疾病的早期检出率不断升高。尤其是各种无创性影像学检查技术在肾动脉狭窄的诊疗过程中起到了至关重要的作用,可早期识别肾动脉、肾脏结构及功能的异常,帮助患者实现早期诊断及获得早期充分治疗。现就影像学在肾动脉狭窄评估中的应用进展进行综述。
【关键词】肾血管性高血压;肾动脉狭窄;影像学;CT血管成像;磁共振成像
【DOI】10.16806/j.cnki.issn.1004-3934.2024.03.003
Imaging Assessment of Renovascular Hypertension
LIN Zhiyong,QIU Jianxing
(Department of Radiology,Peking University First Hospital,Beijing 100034,China)
【Abstract】Renovascular hypertension is one of the most common causes of secondary hypertension,which is caused by renal artery stenosis(RAS).Most RAS is caused by atherosclerosis or fibromuscular dysplasia.With the rapid development of imaging technology,the early detection rate of this disease has been increasing.In particular,various non-invasive imaging techniques play a crucial role in the diagnosis and treatment of RAS,which can early identify abnormalities of renal artery,renal structure and function,and help patients achieve early diagnosis and obtain early adequate treatment.This article reviews the application progress of imaging in the evaluation of RAS.
【Keywords】Renovascular hypertension;Renal artery stenosis;Imaging;Computed tomography angiography;Magnetic resonance imaging
肾血管性高血压(renovascular hypertension,RVH)是由于肾动脉狭窄(renal artery stenosis,RAS)引起肾脏血流灌注减少,激活肾素-血管紧张素-醛固酮系统而引发的动脉压升高,临床表现为血压进行性升高,常导致难治性高血压,伴或不伴慢性肾脏病的临床表现[1]。RVH是继发性高血压最常见的原因之一,占继发性高血压病例的20%~40%,占一般人群所有高血压病例的1%~5%,占青年人群继发性高血压病例的5.4%[1]。RVH主要由动脉粥样硬化性RAS引起(约90%),其次是纤维肌肉发育不良(约9%),还有其他少见原因,如肾动脉夹层或栓塞性疾病等[1]。
RAS不仅可导致难治性高血压,还可造成进行性肾功能下降和心脏紊乱综合征,包括肺水肿、急性主动脉综合征、卒中、复发性充血性心力衰竭和急性冠脉综合征[1]。因此,早期发现RAS是非常必要的,以便对其进行充分的治疗,有望延缓RVH患者慢性肾脏病的进展,逆转肾功能损害,從而减少终末期肾病的发生,对于减轻家庭及社会经济负担具有重大意义。对于RVH患者,进行早期的RAS诊断及肾功能评估是治疗RVH的基础。RVH评估的常见影像学检查包括:超声检查、CT血管成像(computed tomography angiography,CTA)、磁共振血管成像(magnetic resonance angiography,MRA)、核素肾动态显像和数字减影血管造影(digital subtraction angiography,DSA)等。随着磁共振成像(magnetic resonance imaging,MRI)技术的快速发展,功能磁共振成像(functional magnetic resonance imaging,fMRI)作为一种能反映肾功能和肾脏结构变化的无创影像学检查,已逐渐在RVH的临床评估中进行研究探索。现对影像学用于评估RVH的临床应用进行综述,旨在明确其对临床诊治的指导意义。
1 超声技术在RVH评估中的临床应用
1.1 多普勒超声
多普勒超声(Doppler ultrasound,DUS)是利用多普勒效应对运动目标所产生的频移信号进行显示与分析的成像技术,可用来显示肾动脉图像、测量肾动脉血流速度和血流频谱。DUS以其无创、费用低、无辐射、方便、重复性好等优势,已成为RAS的首选影像学检查[2-3]。DUS在对于管腔狭窄≥60%的RAS评估中具有较高的诊断性能,灵敏度为60%~97%,特异度为85%~99%[4]。Zhang等[5]研究发现将DUS最常用的参数肾动脉收缩期峰值流速(peak systolic velocity,PSV)和PSV的比值(肾动脉与主动脉的PSV比值、主肾动脉与肾段动脉的PSV比值以及主肾动脉与肾叶间动脉的PSV比值)联合使用,可提高重度RAS(狭窄≥70%)的诊断准确率。但诸如肾动脉深度、肥胖、复杂解剖结构、肠道气体和操作者技术水平等因素可能会造成DUS无法准确地判断RAS程度,出现假阴性和假阳性结果[6-7]。
1.2 超声造影
超声造影(contrast-enhanced ultrasound,CEUS)是利用超声造影剂使背向散射回声增强,能明显提高超声图像的分辨力、灵敏度和特异度。CEUS作为DUS的补充检查,适用于DUS疑诊RAS、RAS治疗前诊断及治疗后随访。与CTA相比,CEUS具有无创、无辐射、经济、操作简便等优点,同时超声造影剂无肾毒性,过敏反应发生率极低[6,8]。CEUS较DUS能更好地显示肾动脉主干,能提供更清晰的超声图像,在诊断重度RAS时与DSA具有显著的一致性[9]。Cui等[6]研究显示CEUS诊断RAS的准确率明显高于DUS。另外,CEUS可作为一种评估肾血流灌注的辅助手段,对于预测肾动脉支架植入术后肾功能的改善具有一定价值[8,10]。Ran等[8]和Wang等[10]的研究发现重度RAS患者在肾动脉支架植入术后,CEUS显示病变肾动脉的对比剂时间-强度曲线的相关参数与估算肾小球滤过率差值呈正相关。同DUS一样,CEUS也容易受肥胖、胃肠道气体和操作者技术水平等因素影响。
2 CTA在RVH评估中的临床应用
对于肾功能正常患者,CTA被推荐作为低、中危RAS患者的诊断工具,也可作为高危患者的筛查工具和制定肾动脉支架植入术治疗计划的术前参考检查[3]。与其他无创肾动脉检查技术相比,CTA具有扫描时间短以及可提供更高空间分辨率等优点;此外,CTA能进行多平面和三维血管图像重建,可很好地显示肾动脉的解剖结构,在诊断RAS方面具有很高的诊断性能[11]。CTA能很好地显示和评估纤细的副肾动脉,明显优于超声[12]。CTA也可同时对肾及肾外的组织结构进行评估,如发现隐匿性的肾肿瘤或肾上腺肿瘤[11]。CTA对儿童RAS的诊断同样具有较高的敏感度和特异度[11],可作为儿童RVH的筛查工具,同时具有不需镇静或全身麻醉的优势。但CTA存在一定的局限性,對于肾功能不全患者,检查中静脉注射的含碘对比剂会加重肾脏负担,患者肾功能可能会进一步恶化[2];存在发生对比剂不良反应或过敏反应的可能;另外,CTA检查还存在X射线电离辐射的暴露风险。
3 MRI在RVH评估中的临床应用
3.1 MRA
MRA分为对比剂增强MRA(contrast-enhanced MRA,CE-MRA)和非对比剂增强MRA(non-contrast-enhanced MRA,NCE-MRA)两大类技术。CE-MRA类似CTA,是通过静脉注射含钆的MRI对比剂进行肾动脉成像,因其创伤小、诊断准确性高而被广泛用于检测RAS。Wang等[13]荟萃分析发现CE-MRA和CTA对RAS均有较高的诊断价值,二者差异无统计学意义。与CTA相比,CE-MRA具有无电离辐射和对比剂无肾毒性等优点。CE-MRA也存在一定的局限性:扫描时间长;肾动脉小分支显示较差;患者呼吸配合不佳影响成像质量;对于肾小球滤过率(glomerular filtration rate,GFR)<30 mL/min且伴有肾功能不全的RVH患者,使用含钆的MRI对比剂存在肾源性系统性纤维化的风险[14]。
近年来MRA技术发展迅速,CE-MRA、NCE-MRA和CTA在诊断RAS方面图像质量相差无几,在诊断准确性方面均无显著差异[14-16]。在评估RAS方面,基于三维快速平衡稳态采集序列的NCE-MRA不仅具有较高的诊断效能,同时也能对肾动脉血管边界和管壁斑块进行一定的评估[17]。但NCE-MRA存在高估RAS程度和副肾动脉显影欠佳的问题。另外,NCE-MRA也存在扫描时间长、肾动脉小分支显示较差以及患者呼吸配合不佳影响成像质量的局限性。总之,NCE-MRA技术具有无辐射、无对比剂的优点,可为肾功能不全的RVH患者提供了一种更安全、有效的血管成像选择。
3.2 fMRI
fMRI在肾脏的应用研究快速发展,使得无创性观察RVH患者的肾脏病生理变化成为可能。目前应用于肾脏的fMRI技术主要包括血氧水平依赖MRI(blood oxygenation level-dependent MRI,BOLD-MRI)、扩散MRI、动脉自旋标记MRI(arterial spin labeling MRI,ASL-MRI)和T1 mapping成像。这些fMRI成像技术可显示肾脏氧合、间质扩散、微血管灌注和肾脏纤维化程度等特征[18]。
3.2.1 BOLD-MRI
RVH患者的肾血流会随着RAS程度的加重而减少,且随着氧源的减少,BOLD-MRI信号强度和R2*值会增加[19]。然而,既往多项研究[18]的结果存在争议。Lal等[20]研究发现BOLD-MRI的R2*值在有RAS和无RAS的肾脏之间存在显著差异。Li等[21]研究显示移植肾RAS中肾皮质灌注量明显降低,但BOLD-MRI显示肾脏的皮质和髓质氧合未见明显减低,与其他研究不相符。因此,BOLD-MRI的临床应用还需继续研究探索。
3.2.2 扩散MRI
扩散MRI是通过检测水分子运动扩散情况来反映肾脏纤维化和肾脏微循环灌注变化的影像学检查方法,常用成像技术包括弥散加权成像、弥散张量成像、体素内不相干运动成像和弥散峰度成像。弥散加权成像的主要检测指标是表观扩散系数,反映肾组织内的水运动情况,同时也能反映肾实质微循环灌注[18]。弥散张量成像的主要指标各向异性分数能反映水分子运动的方向性,可检测肾脏组织纤维化的情况。在弥散张量成像评估RAS患者的肾功能损伤中,肾脏皮质表观扩散系数值和髓质各向异性分数值的减低能反映肾功能损伤程度[22]。体素内不相干运动成像可评估肾脏毛细血管灌注[23],在慢性肾脏病的前瞻性研究[24]中显示,真扩散系数D值、伪扩散系数D*值及灌注分数f值均与慢性肾脏病分期呈负相关,D、f值与估算肾小球滤过率呈正相关。弥散峰度成像主要是检测水分子自由扩散的非自由运动,反映肾脏纤维化所造成的细胞外基质变化,其参数表观扩散峰度系数K值越高、扩散系数D值越低,说明肾实质内水分子运动受影响越大,反映肾实质损伤越大。近年来关于慢性肾脏病患者的弥散峰度成像研究显示,肾实质平均D值与肾组织病理学纤维化评分呈负相关,而肾实质平均K值则与之呈正相关[25]。
3.2.3 ASL-MRI
ASL-MRI的原理是将流入动脉血液中的水分子作为天然的内源性示踪剂来估计组织灌注。ASL-MRI技术根据标记方法的不同分为4种类型:连续型ASL、脉冲型ASL、伪连续型ASL和速度选择型ASL[26]。ASL-MRI技术具有无创、可重复的优点,可反映肾脏的血流灌注,能实现肾血流量的定量或半定量分析,已被应用于RVH患者肾功能的评估[27-28]。
3.2.4 T1 mapping
T1 mapping是以T1弛豫时间做信号加权的成像,可测定肾脏组织的纵向弛豫时间T1值,可反映组织纤维化的程度[29]。T1 mapping已广泛应用于弥漫性心肌纤维化的定量评估以及评估肝纤维化的程度。目前已有一些研究发现肾移植后肾损伤纤维化、慢性肾小球肾炎等患者的肾皮质T1值明显升高,且与慢性肾脏病分期、肾脏纤维化和肾功能指标具有良好的相关性,在评估肾功能和无创性检测肾脏纤维化方面显示出良好的诊断性能[30]。T1 mapping在监测RVH患者肾脏纤维化方面具有广阔的应用前景。
4 核素肾动态显像在RVH评估中的临床应用
目前,常用的肾动态显像剂锝-99m-二乙撑三胺五乙酸(99mTc-diethylene triamine pentaacetic acid,99mTc-DTPA)属于肾小球滤过型显像剂,它几乎完全经肾小球滤过而清除,通过获得99mTc-DTPA的最大清除率可准确地计算出GFR[31]。肾脏代偿能力较强,RVH患者RAS侧肾功能轻度下降,可由对侧正常肾代偿,病程早期血肌酐不会升高,容易造成漏诊、放弃血管重建治疗、错过肾动脉介入治疗最佳时机而影响预后。Ul Hassan等[32]的研究发现对于单侧肾体积缩小、同时肾功能正常或接近正常的患者,99mTc-DTPA血管紧张素转化酶抑制剂肾动态显像可作为一种安全、无创、敏感、特异且经济有效的检查方法,可用于排除RVH。核素肾动态显像还可用于肾动脉支架植入术的预后评估[33]。但核素肾动态显像具有电离辐射、测量误差大以及不能显示肾血管等缺点。总之,核素肾动态显像可分别测量每个肾脏的GFR,可准确地识别RVH患者单侧RAS后肾功能的变化,精准地指导RAS的介入治疗及评估预后[33-34]。
5 DSA在RVH评估中的临床应用
DSA是诊断RVH的金标准[3],当临床高度怀疑重度RAS而无创检查结果不能确定时,建议采用DSA来确认重度RAS的诊断[2]。在肾动脉DSA检查的同时,对于符合介入治疗适应证的患者可进行治疗。但DSA是一种有创的影像检查,电离辐射较大,并且需麻醉,不适用于只进行RAS筛查、不需介入治疗的RVH患者。而对于伴有慢性肾脏病的RVH患者,在DSA检查过程中大量使用碘对比剂会增加发生对比剂肾病的风险[35]。因此,为预防对比剂肾病,应尽量减少对比剂的用量。二氧化碳DSA作为一种无肾毒性的影像学检查,可适用于对比剂肾病高危或碘对比剂过敏的患者[36]。但二氧化碳DSA存在图像质量较差以及容易发生血管气体栓塞等严重并发症的缺点[35]。稀释对比剂的DSA可在不使用大量對比剂的情况下解决上述二氧化碳DSA的相关问题,有研究[35,37]报道了使用少量稀释的对比剂可成功行DSA及肾动脉支架植入术,具有较高的临床可行性。另外,一些图像后处理新技术在DSA中开始应用,有文献[38]报道使用彩色编码图像后处理算法的DSA可在肾动脉介入治疗过程中获得即时的肾脏血流动力学信息,有助于评估介入手术的疗效。
6 总结与展望
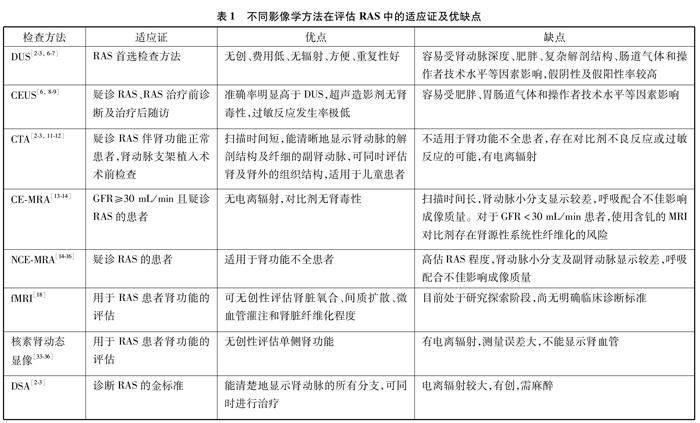
综上所述,影像学检查在RVH评估中起到了至关重要的作用,其临床应用包括对RAS的筛查、RAS的分级诊断、肾脏血流灌注等肾功能评估、指导治疗和预后随访等,表1对不同影像学方法在评估RAS中的适应证及优缺点进行了总结。DUS以其费用低、无辐射、方便、重复性好等优势成为RVH的首选影像学检查。CEUS对比DUS,不仅在诊断RAS中具有更高诊断效能,还能评估肾实质的血流灌注,可用于肾动脉支架植入术后的随访监测。肾动脉CTA检查具有较高的空间分辨率,能很好地显示肾动脉的解剖结构,在临床中常作为RVH患者的诊断工具和制定肾动脉支架植入术治疗计划的术前参考检查;但CTA存在一定的局限性,不适合中重度肾功能不全患者,存在发生对比剂不良反应或过敏反应的可能,且有辐射。MRA在诊断RAS中具有较高的诊断准确性,其中NCE-MRA具有无辐射、无对比剂使用等优点,尤其适用于肾功能不全的RVH患者。fMRI可无创性评估肾脏氧合、间质扩散、微血管灌注和肾脏纤维化,但目前处于研究探索阶段,尚无明确临床诊断标准。核素肾动态显像作为测量肾脏GFR的最佳手段,能准确地识别RVH患者单侧RAS后肾功能的变化。DSA作为诊断RAS的金标准,可同时进行肾动脉介入治疗。近年来,CEUS、NCE-MRA、fMRI、稀释对比剂的DSA及彩色编码DSA等新技术快速发展,在RVH的诊断、肾功能评估及预后预测等方面具有较高的临床应用前景,有待进一步研究探索和发展。
参考文献
[1]Mannemuddhu SS,Ojeda JC,Yadav A.Renovascular hypertension[J].Prim Care,2020,47(4):631-644.
[2]Aboyans V,Ricco JB,Bartelink MEL,et al.2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases,in collaboration with the European Society for Vascular Surgery(ESVS):document covering atherosclerotic disease of extracranial carotid and vertebral,mesenteric,renal,upper and lower extremity arteriesEndorsed by:the European Stroke Organization(ESO)The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology(ESC) and of the European Society for Vascular Surgery (ESVS)[J].Eur Heart J,2018,39(9):763-816.
[3]Anderson JL,Halperin JL,Albert N,et al.Management of patients with peripheral artery disease (compilation of 2005 and 2011 ACCF/AHA guideline recommendations)[J].J Am Coll Cardiol,2013,61(14):1555-1570.
[4]Vipparla N,Kichloo A,Albosta MS,et al.Resistant hypertension secondary to severe renal artery stenosis with negative duplex ultrasound:a brief review of different diagnostic modalities[J].J Investig Med High Impact Case Rep,2020,8:2324709620914793.
[5]Zhang Y,Wang Y,Ma N,et al.Application of simple ultrasound Doppler hemodynamic parameters in the diagnosis of severe renal artery stenosis in routine clinical practice[J].Quant Imaging Med Surg,2023,13(12):8042-8052.
[6]Cui Y,Zhang Q,Yan J,et al.The value of contrast-enhanced ultrasound versus Doppler ultrasound in grading renal artery stenosis[J].Biomed Res Int,2020,2020:7145728.
[7]Villegas L,Cahill AM,Meyers K.Pediatric renovascular hypertension:manifestations and management[J].Indian Pediatr,2020,57(5):443-451.
[8]Ran X,Lin L,Yang M,et al.Contrast-enhanced ultrasound evaluation of renal blood perfusion changes after percutaneous transluminal renal angioplasty and stenting for severe atherosclerotic renal artery stenosis[J].Ultrasound Med Biol,2020,46(8):1872-1879.
[9]Wang Y,Li Y,Wang S,et al.Role of contrast-enhanced ultrasound in the evaluation of patients with suspected renal arterial stenosis[J].Front Cardiovasc Med,2022,9:721201.
[10]Wang X,Wang S,Pang Y,et al.Contrast-enhanced ultrasound assessment of renal parenchymal perfusion in patients with atherosclerotic renal artery stenosis to predict renal function improvement after revascularization[J].Int J Gen Med,2020,13:1713-1721.
[11]Fleury AS,Durand RE,Cahill AM,et al.Validation of computed tomography angiography as a complementary test in the assessment of renal artery stenosis:a comparison with digital subtraction angiography[J].Pediatr Radiol,2021,51(13):2507-2520.
[12]Orman G,Masand PM,Kukreja KU,et al.Diagnostic sensitivity and specificity of CT angiography for renal artery stenosis in children[J].Pediatr Radiol,2021,51(3):419-426.
[13]Wang L,Zhu L,Li G,et al.Gadolinium-enhanced magnetic resonance versus computed tomography angiography for renal artery stenosis:a systematic review and meta-analysis[J].J Formos Med Assoc,2021,120(5):1171-1178.
[14]Lal H,Singh RKR,Yadav P,et al.Non-contrast MR angiography versus contrast enhanced MR angiography for detection of renal artery stenosis:a comparative analysis in 400 renal arteries[J].Abdom Radiol(NY),2021,46(5):2064-2071.
[15]Albert TE,Akahane M,Parienty I,et al.An international multicenter comparison of time-SLIP unenhanced MR angiography and contrast-enhanced CT angiography for assessing renal artery stenosis:the renal artery contrast-free trial[J].Am J Roentgenol,2015,204(1):182-188.
[16]Park SY,Kim CK,Kim E,et al.Noncontrast-enhanced magnetic resonance renal angiography using a repetitive artery and venous labelling technique at 3T:comparison with contrast-enhanced magnetic resonance angiography in subjects with normal renal function[J].Eur Radiol,2015,25(2):533-540.
[17]Gaudiano C,Busato F,Ferramosca E,et al.3D FIESTA pulse sequence for assessing renal artery stenosis:is it a reliable application in unenhanced magnetic resonance angiography?[J].Eur Radiol,2014,24(12):3042-3050.
[18]Jiang B,Liu F,Fu H,et al.Advances in imaging techniques to assess kidney fibrosis[J].Ren Fail,2023,45(1):2171887.
[19]Zhao L,Li G,Meng F,et al.Cortical and medullary oxygenation evaluation of kidneys with renal artery stenosis by BOLD-MRI[J].PLoS One,2022,17(3):e0264630.
[20]Lal H,Singh P,Ponmalai K,et al.Role of blood oxygen level-dependent magnetic resonance imaging in studying renal oxygenation changes in renal artery stenosis[J].Abdom Radiol(NY),2022,47(3):1112-1123.
[21]Li X,Wang W,Cheng D,et al.Perfusion and oxygenation in allografts with transplant renal artery stenosis:evaluation with functional magnetic resonance imaging[J].Clin Transplant,2022,36(11):e14806.
[22]Gaudiano C,Clementi V,Corcioni B,et al.Diffusion tensor imaging in renal artery stenosis:a preliminary report[J].Br J Radiol,2020,93(1115):20200101.
[23]Zhang H,Wang P,Shi D,et al.Capability of intravoxel incoherent motion and diffusion tensor imaging to detect early kidney injury in type 2 diabetes[J].Eur Radiol,2022,32(5):2988-2997.
[24]Mao W,Zhou J,Zeng M,et al.Chronic kidney disease:pathological and functional evaluation with intravoxel incoherent motion diffusion-weighted imaging[J].J Magn Reson Imaging,2018,47(5):1251-1259.
[25]Mao W,Ding Y,Ding X,et al.Diffusion kurtosis imaging for the assessment of renal fibrosis of chronic kidney disease:a preliminary study[J].Magn Reson Imaging,2021,80:113-120.
[26]Golay X,Hendrikse J,Lim TC.Perfusion imaging using arterial spin labeling[J].Top Magn Reson Imaging,2004,15(1):10-27.
[27]Mannelli L,Maki JH,Osman SF,et al.Noncontrast functional MRI of the kidneys[J].Curr Urol Rep,2012,13(1):99-107.
[28]Wu W,Su M,Chang C,et al.Renal perfusion 3-T MR imaging:a comparative study of arterial spin labeling and dynamic contrast-enhanced techniques[J].Radiology,2011,261(3):845-853.
[29]Cox EF,Buchanan CE,Bradley CR,et al.Multiparametric renal magnetic resonance imaging:validation,interventions,and alterations in chronic kidney disease[J].Front Physiol,2017,8:696.
[30]Wu J,Shi Z,Zhang Y,et al.Native T1 mapping in assessing kidney fibrosis for patients with chronic glomerulonephritis[J].Front Med,2021,8:772326.
[31]Assadi M,Eftekhari M,Hozhabrosadati M,et al.Comparison of methods for determination of glomerular filtration rate:low and high-dose Tc-99m-DTPA renography,predicted creatinine clearance method,and plasma sample method[J].Int Urol Nephrol,2008,40(4):1059-1065.
[32]Ul Hassan M,Khan SH,Ashraf M,et al.99mTc diethylenetriaminepentacetic acid angiotension-coverting enzyme inhibitor renography as screening test for renovascular hypertension in unilateral small kidney:a prospective study[J].World J Nucl Med,2022,13(3):159-162.
[33]Ma N,Li Y,Wang S,et al.Dynamic changes of renal cortical blood perfusion before and after percutaneous transluminal renal artery stenting in patients with severe atherosclerotic renal artery stenosis[J].Chin Med J(Engl),2022,135(13):1570-1577.
[34]段磊,顧俊鹏,任伟新,等.99mTc-DAPA肾动态显像对动脉粥样硬化性肾动脉狭窄支架植入术疗效的预测价值[J].中华介入放射学电子杂志,2020,8(2):175-179.
[35]Oyama Y,Koiwa S,Maruyama T,et al.Percutaneous transluminal renal artery stenting using digital subtraction angiography with diluted contrast medium in a patient with severe chronic kidney disease[J].J Cardiol Cases,2022,26(5):317-320.
[36]Hasjim BJ,Fujitani RM,Chen SL,et al.Utilization of carbon dioxide angiography and percutaneous balloon angioplasty for treatment of transplant renal artery stenosis[J].Ann Vasc Surg,2020,65:10-16.
[37]Kawano M,Suzuki K,Fujimura N,et al.Ultra-low-dose contrast using transluminal renal angioplasty:the ULTRA study[J].Vasc Endovasc Surg,2023,57(4):324-330.
[38]Augustin AM,Welsch S,Bley TA,et al.Color-coded summation images in the evaluation of renal artery stenosis before and after percutaneous transluminal angioplasty[J].BMC Med Imaging,2021,21(1):21.
收稿日期:2024-01-14
通信作者:邱建星,E-mail:qjx761225@126.com

