基于蛋白组学分析不同解冻方式下牛肉的品质变化机制
林颖 邝金艳 王丽 闫子康 李宗军

摘 要:低频电场解冻(low-frequency electric field thawing,LFEFT)與常温解冻(room temperature thawing,RTT)会导致牛肉pH值、颜色、总挥发性盐基氮(total volatile base nitrogen,TVB-N)含量、质构特性和持水力等方面显著不同,从分子水平解析LFEFT对牛肉品质影响的可能机制,采用蛋白质组学技术对2 种解冻方式牛肉进行分析。结果表明:LFEFT组与RTT组之间有551 个差异丰度蛋白(differentially abundant proteins,DAPs),其中14 种DAPs与牛肉品质特性(pH值、色泽、TVB-N含量、质构和持水力)呈显著相关;生物信息学分析表明,DAPs主要参与蛋白结合、代谢酶和蛋白质周转等生物功能。LFEFT既可以提高生产效率,又保证了牛肉品质。
关键词:低频电场解冻;常温解冻;牛肉;肉品质;蛋白组学
Proteomics-Based Analysis of the Quality Change Mechanism of Frozen Beef under Different Thawing Methods
LIN Ying, KUANG Jinyan, WANG Li, YAN Zikang, LI Zongjun*
(College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China)
Abstract: Low-frequency electric field thawing (LFEFT) and room temperature thawing (RTT) lead to significant differences in the pH, color, volatile base nitrogen (TVB-N) content, textural properties and water-holding capacity of beef. In order to elucidate a possible mechanism for the effect of LFEFT on the quality of beef at the molecular level, the current study conducted a proteomic analysis of frozen beef thawed by LFEFT or RTT. The results showed that there were 551 differentially abundant proteins (DAPs) between the LFEFT and RTT groups. Among these, 14 were significantly correlated with quality traits (pH, color, TVB-N content, texture and water-holding capacity). Bioinformatics analysis showed that DAPs were mainly involved in biological functions such as protein binding, metabolic enzymes and protein turnover. In summary, LFEFT can improve production efficiency while ensuring beef quality.
Keywords: low-frequency electric field thawing; room temperature thawing; beef; meat quality; proteomics
DOI:10.7506/rlyj1001-8123-20240220-040
中图分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2024)02-0009-08
引文格式:
林颖, 邝金艳, 王丽, 等. 基于蛋白组学分析不同解冻方式下牛肉的品质变化机制[J]. 肉类研究, 2024, 38(2): 9-16. DOI:10.7506/rlyj1001-8123-20240220-040. http://www.rlyj.net.cn
LIN Ying, KUANG Jinyan, WANG Li, et al. Proteomics-based analysis of the quality change mechanism of frozen beef under different thawing methods[J]. Meat Research, 2024, 38(2): 9-16. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20240220-040. http://www.rlyj.net.cn
牛肉是人类饮食结构中蛋白质的重要来源[1]。过去10 年中,我国牛肉消费量增长55%,占全球消费量的11%,使我国成为世界上牛肉进口增长最快的国家[2]。冷冻是保存肉类和肉制品的重要且方便的方法,在肉类工业中起至关重要的作用[3]。解冻是冷冻食品的最后一道工序[4]。解冻技术使用不当会引起肉的物理、化学和质构特性变化,损害肉的品质[5]。传统的解冻技术,如常温解冻(room temperature thawing,RTT),解冻时间长,肉的持水力下降,总挥发性盐基氮(total volatile base nitrogen,TVB-N)含量高,蛋白质降解严重,影响其品质。针对传统解冻的不足,目前国内外学者对多种新型解冻技术进行了研究,如微波解冻[6]、射频解冻[7]等。微波解冻加热效率快、解冻时间短,但在解冻较大的样品时,存在局部过热、样品渗透性差和解冻不完全等问题。射频解冻具有能量利用率高、解冻快等优点,但是食品的介电特性、物料状态等因素会影响该解冻方式的解冻效果,进而影响食品感官品质。因此,亟待探寻一种可改善牛肉解冻品质、降低其脂质和蛋白氧化程度的解冻技术,提高牛肉产业的经济效益。低频电场解冻(low-frequency electric field thawing,LFEFT)作为一种新型解冻技术,解冻效率高,肉类新鲜度保持较好,汁液损失率低,具有改善肉类解冻品质的效果,在肉制品解冻领域具有较高的研究热度。
蛋白质组学作为生命科学的研究热點,是在分子水平上探索肌肉蛋白质与品质特性间关系以及在蛋白质水平揭示影响品质性状的生化过程和机制的有影响力的工具[8]。
蛋白质作为肌肉的重要组成部分,其变化能够引起肉品质的改变。目前蛋白组学在国内外肉类宰前应激、宰后老化过程及品种鉴定中已有一定的应用。赵娟红[9]采用同位素标记相对和绝对定量技术定量分析猪肉贮藏过程中的蛋白变化规律,将不同贮藏温度条件下的猪肉差异蛋白与品质指标进行相关性分析,发现肌球结合蛋白C、肌钙蛋白I、原肌球蛋白α1链等与pH值、TVB-N含量和色泽呈显著相关。Malheiros等[10]利用双向电泳结合喷雾串联质谱技术测定内洛尔公牛的蛋白质组,确定热休克蛋白、抗氧化蛋白及骨骼肌的代谢和结构蛋白与牛的嫩度相关。Morzel等[11]提出,肌肉主要由大量的水分和蛋白质组成,肉品科学与功能蛋白质结构研究密不可分。Fuente-Garcia等[12]评估牛屠宰前应激相关的蛋白质组生物标志物,发现有5 条蛋白条带在正常肉和干硬肉之间具有显著差异(P<0.05),肌动蛋白、磷酸葡萄糖变位酶1、α-晶状体蛋白B、热休克蛋白β6和热休克蛋白β1作为应激病症的生物标志物。蛋白质组学技术同样已经被应用于检测与牛肉颜色稳定性相关的分子机制,胴体宰后温度和pH值的下降均会导致颜色稳定性的变化[13]。Zhang Yimin等[14]分析牛胸长肌宰后早期与能量代谢相关酶的变化,24 种代谢相关酶和热休克蛋白在宰后不同时间采集的样品中发生了变化。
蛋白组学在肉类领域具有一定的研究和应用,但是关于新型解冻技术对比传统解冻技术所引起肉类品质差异的研究较少。本研究对LFEFT和RTT牛肉进行差异蛋白组学研究,筛选差异蛋白,探究其功能和解冻机制,为提高冷冻肉品质提供理论依据和新的思路。
1 材料与方法
1.1 材料与试剂
澳洲新鲜谷饲牛肉块(后腿肉)购自沃尔玛(湖南)商业零售有限公司。
浓硫酸、浓盐酸、氯化钠、甲基红、亚甲基蓝、乙醇、氧化镁、硼酸、三氯乙酸、戊二醛、丙酮(均为分析纯) 上海国药集团化学试剂有限公司;NH4HCO3 美国Sigma公司;TMT标记试剂盒、PierceTM肽段分级试剂盒 美国Thermo Scientific公司。
1.2 仪器与设备
低频电场装置 呼和浩特绿碧电子科技有限公司;3-18R型冷冻离心机 湖南恒诺仪器设备有限公司;NR200型色差仪 深圳三恩时科技有限公司;PHS-3E型pH计 上海仪电科学仪器股份有限公司;TVT-6700型食品物性测试仪 英国Stable Micro Systems公司;Q-Exacitve HF-X型质谱仪、Easy-nLC 1200型色谱系统、Trap column C18反相色谱柱(100 μm×20 mm,5 μm) 美国Thermo Scientific公司。
1.3 方法
1.3.1 样品制备
购买牛肉后1 h内将其放入装有冰袋的保温袋中运往实验室,去除外部可见脂肪和结缔组织后切成质量500 g、10 cm×8 cm×3 cm的块状,随后放置于-20 ℃冰箱中冻结备用。
1.3.2 解冻方法
RTT:将密封袋包装的肉样放置在25 ℃恒温培养箱中进行解冻,以肉块中心温度达到4 ℃为解冻终点。
LFEFT:将肉样放置于低频解冻设备,将温度设置为4 ℃后开始解冻,以肉块中心温度达到4 ℃为解冻终点。
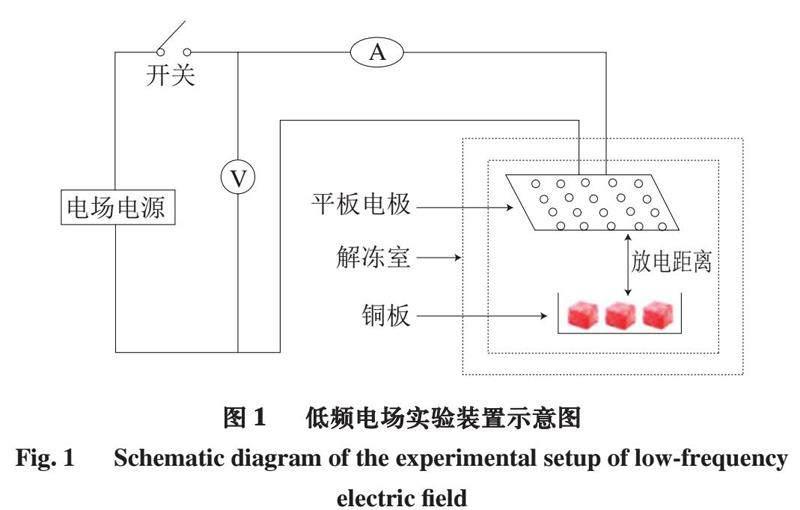
本实验使用的低频电场装置由电压发电机(交流电220 V、50 Hz)和平板电极(580 mm×280 mm)组成。由于板电极垂直放置,牛肉没有直接接触板电极,与板电极平行。低频电场装置和肉样放置如图1所示,电压发电机输出电压为4 000 V,电流为0.2 mA,放电距离为290 mm。在LFEFT组,低频电场装置应用于解冻的整个过程。
采用不同方式解冻后,收集肉块中心部分(约5 g),每组样品分别含3 个生物学重复样本,立即在液氮中冷冻,保存于-80 ℃,用于蛋白组学分析,其余部分用于肉质指标测定。
1.3.3 肉质指标测定
1.3.3.1 pH值
参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》。
1.3.3.2 色度
参照张莉等[15]的方法,将肉样取出后用吸水纸擦干其表面的水分并置于实验台表面,同时对色差仪进行校准,校准完毕测定样品的亮度值(L*)、红度值(a*)及黄度值(b*),每个样品随机选取6 个点进行测定,结果取平均值。
1.3.3.3 质构特性
取解冻后的牛肉,切为2.0 cm×2.0 cm×1.0 cm,使用P36R平底柱形探头,设置参数为:回程距离25 mm,形变量50%,测前速率2 mm/s,测试速率1 mm/s,2 次测量间隔5 s,探针自动触发。每组样品平行测定3 次。测定样品的硬度、弹性和咀嚼性。
1.3.3.4 TVB-N含量
参照GB 5009.228—2016《食品中挥发性盐基氮的测定》。
1.3.3.5 汁液损失率
离心损失率:参照马翼飞等[16]的方法,称取解冻后的牛肉2 g,用滤纸包好后,4 ℃、5 000 r/min条件下离心25 min,去掉滤纸后,测定离心后牛肉的质量,离心损失率按式(1)计算:
式中:m1为实验前肉样质量/g;m2为离心后肉样质量/g。
滴水损失率:参照雷露等[17]的方法,将解冻后的肉样修剪成20 mm×30 mm×50 mm的肉块,用细铁丝挂住,套上保鲜袋(肉样与保鲜袋不接触),悬挂于4 ℃冰箱中,24 h后测定肉块质量,滴水损失率按式(2)
计算:
式中:m3为实验前肉样质量/g;m4为24 h后肉样质量/g。
总损失率按式(3)计算:
1.3.4 蛋白样品制备
将样品置于4 ℃复融,每个样品中分别加入200 ?L蛋白裂解液(含4 g/100 mL十二烷基磺酸钠、100 mmol/L
二硫苏糖醇、150 mmol/L三羟甲基氨基甲烷-盐酸缓冲液),冰浴超声2 min。4 ℃、16 000×g离心20 min,取上清,采用二喹啉甲酸试剂盒进行蛋白定量。每个样品各取300 μg蛋白进行溶液内酶解,步骤如下:每个样品中分别加入适量1 mol/L二硫苏糖醇至终浓度10 mmol/L,沸水浴5 min,冷却至室温;加入适量800 mmol/L吲哚乙酸至终浓度50 mmol/L,600 r/min振荡1 min,避光室温放置30 min;加入6 倍体积冷丙酮试剂,置于-20 ℃孵育过夜,沉淀蛋白;16 000×g离心30 min,去除上清液,保留蛋白沉淀;加入适量丙酮试剂清洗蛋白沉淀,重复2 次;将蛋白沉淀样品置于通风橱风干,去除有机试剂;加入150 ?L 0.04 μg/μL胰酶缓冲液,600 r/min振荡1 min,37 ℃孵育酶解16~18 h;加入100 μL 0.1 g/100 mL三氯乙酸溶液,酶解后的肽段使用C18色谱柱脱盐,真空冻干后用0.1 g/100 mL三氯乙酸溶液复溶,脱盐处理,进行肽段定量。
1.3.5 TMT肽段标记与肽段分级
每个样品分别取100 μg肽段进行标记。将每组标记后的肽段等量混合,干燥后的肽段使用High-pH反相色谱柱进行分级分离,最终将样品收集合并为10 个组分,每个组分的肽段干燥后用0.1%甲酸复溶,待液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)分析。
1.3.6 LC-MS/MS分析
每个样品取适量肽段使用纳升流速色谱系统进行色谱分离。缓冲液:A液为0.1%甲酸溶液,B液为体积分数95%乙腈溶液(含0.1%甲酸)。色谱柱以100%的A液平衡。样品进样到Trap column C18色谱柱(100 ?m×20 mm,5 ?m)后经过C18色谱分析柱(75 ?m×150 mm,3 ?m)进行梯度分离,流速为300 nL/min。液相分离梯度如下:0~2 min,2%~8% B;2~42 min,8%~30% B;42~49 min,30%~45% B;49~50 min,45%~100% B;50~60 min,100% B。肽段分离后进行数据依赖采集(data-dependent acquisition,DDA)质谱分析。
1.3.7 数据库搜索和分析
采用Proteome Discoverer 2.4软件分析数据,根据DDA数据库进行数据解析和蛋白质鉴定,从而获得蛋白质的鉴定结果、功能注释和相对定量等数据。肽和蛋白质鉴定的错误发现率设为1%。采用TMT报告离子强度进行定量。
1.3.8 生物信息学分析
使用Perseus软件、Microsoft Excel和R统计计算软件对生物信息学数据进行分析。以蛋白表达差异倍数(fold change,FC)>1.2或<0.83且P<0.05为临界值,筛选出差异丰度蛋白(differentially abundant proteins,DAPs)。根据表达水平对DAPs进行分层聚类。序列注释信息来自UniProtKB/Swiss-Prot、京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)和基因本体论(gene ontology,GO)。此外,利用STRING数据库和Cytoscape软件构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络。
1.4 数据統计分析
肌肉质量数据通过SPSS Statistics 26.0软件和Duncan多重范围进行统计分析,显著性定义为P<0.05。使用R语言工具包(RVersion 4.1.2)对图像进行分析,并对肌肉品质特征与蛋白质表达结果进行Pearson相关性分析、火山图绘制和层次聚类。
2 结果与分析
2.1 不同解冻方式下牛肉的品质特性
由表1可知,RTT组牛肉pH值显著低于LFEFT组牛肉(P<0.05),其原因是解冻方式诱导的蛋白质变性导致氢离子的释放[18]和肉中水分的损失。低频电场通过减少牛肉的收缩而潜在地减少能量代谢,从而延缓pH值的降低。在色泽方面,RTT组L*和a*均显著低于LFEFT组,是由于冷冻-解冻处理后会损耗肉中的水分,导致L*降低,a*的降低是由于在解冻过程中肌红蛋白氧化生成高铁肌红蛋白。RTT组牛肉b*显著高于LFEFT组,原因是肌肉中的蛋白质发生氧化,导致黄色色素积累。牛肉在电场环境下解冻b*较低,说明肌肉中的蛋白质氧化程度较低。这进一步表明LFEFT可以改善肉品色泽。与RTT组牛肉相比,LFEFT处理后的牛肉硬度、弹性和咀嚼性均有所提高,这与李翰卿等[19]的研究一致,电场解冻时间短,样品内外同时解冻,温差小使肉样的肌肉纤维结构紧密,肌肉质构特性保持较好。而TVB-N产生是由于肉品在腐败过程中,微生物的分解会使蛋白质产生氮及胺类等挥发性碱性含氮物质[20]。LFEFT处理后的牛肉TVB-N含量显著低于RTT组,新鲜度较高,这与王丽等[21]研究结果一致。这表明LFEFT能够减少牛肉蛋白质分解,有效延长其货架期。LFEFT处理后的牛肉离心损失率和滴水损失率均显著低于RTT组,这与Zhang Yaming等[22]的研究结果一致。由于LFEFT速率快,对牛肉的蛋白质变性程度影响较小,冰晶生长速率较均匀,从而导致解冻过程中对细胞的刺穿更少,肌肉的组织结构保持更好,汁液损失减少[23],牛肉持水力较高。且在解冻过程中,随着冰晶的融化,出现细胞内亲水胶质体吸收水分,使水分逐渐向细胞内渗透和扩散的现象,电场解冻速率大,因此冰晶解冻的汁液全部向细胞内渗透而不至外溢流失。
2.2 蛋白质鉴定和定量
经数据筛选,共检出15 507 条多肽和11 338 条独特多肽,与2 333 个蛋白匹配,如图2所示,大多数蛋白的肽段数量≤3,占55.29%。如图3所示,筛选的蛋白序列覆盖率较高,46.4%的蛋白序列覆盖率超过10%,22.9%的蛋白序列覆盖率超过20%。
2.3 DAPs的比较
如图4所示,在LFEFT与RTT组的比较中,共有551 个DAPs。火山图直观显示了DAPs的变化,其中蓝色为上调蛋白,红色为下调蛋白。采用分层聚类热图可视化区分蛋白质子集和DAPs,观察2 个处理组样本的差异,有助于蛋白质的量化。如图5所示,实验具有可重复性,且不同处理组间存在显著差异。
2.4 DAPs的GO和KEGG富集分析
GO富集包含3 个重要的生物功能本体:生物过程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(molecular function,MF)。如图6所示,通过对551 个DAPs进行序列比对,GO条目匹配到526 个DAPs,共分为40 类,23 个注释到BP,2 个注释到MF,15 个注释到CC。BP以细胞过程和代谢过程最为显著,CC主要富集在细胞解剖结构和含蛋白质的复合物等组分中,MF主要富集在结合力和催化活性2 个方面。就GO结果而言,这些DAPs最有可能被识别出是因为它们受到冷冻过程中产生冰晶的影响,破坏肌肉的完整性,导致解冻损失,进而导致蛋白质损失,并改变肉中蛋白质的功能特性。
利用KEGG数据库对LFEFT和RTT处理后的牛肉进行差异蛋白代谢通路分析,共富集到263 条代谢通路,其中显著富集(P<0.05)的有58 条,排名前20的通路如图7所示。LFEFT与RTT组牛肉的DAPs主要参与代谢途径、氧化磷酸化、氨基酸生物合成、三羧酸(tricarboxylic acid,TCA)循环、碳代谢、糖酵解和产热。肉类在冷冻和解冻过程中会导致蛋白质降解,影响肉质。蛋白质降解过程中,当肽键断裂时产生氨基酸,这些氨基酸进一步脱氨基形成碳骨架,参与碳代谢。氨基酸碳骨架氧化的主要途径是TCA循环,其中丙酮酸被代谢。此外,在解冻过程中,能量主要通过糖酵解代谢产生,从而参与产热。
2.5 PPI网络分析
PPI网络中,节点代表蛋白质,连接线代表蛋白质-蛋白质关联。如图8所示,还原型辅酶I(nicotinamide adenine dinucleotide,NADH)脱氢酶[泛醌]1α亚复合物亚基8(P42029)、线粒体(NDUFB8)、ATP合酶亚基δ(ATP5F1D)、细胞色素b-c1(P00129)、羟酰辅酶A脱氢酶(Q2KJC5)、肌球蛋白重链(F1MM07)、苹果酸脱氢酶(Q32LG3)等与其他蛋白质的相互作用评分高于0.99,表明这些蛋白质的相互作用对解冻牛肉的质量至关重要。
2.6 DAPs与牛肉品质特性的相关性
如图9所示,各DAPs与多个肌肉品质指标均呈显著相关,表明这些DAPs可作为评价LFEFT对牛肉品质影响的潜在生化指标。
NADH脱氢酶(P42029)位于线粒体内膜,催化NADH向辅酶Q的电子传递,是线粒体氧化磷酸化的开始,是厌氧代谢中电子由NADH或还原型黄素二核苷酸传递合成ATP的主要途径。NADH脱氢酶(P42029)与pH值呈高度显著负相关(P<0.001)。LEFET组NADH脱氢酶(P42029)表达下调,导致电子转移活性降低,终止速率加快,后期生化反应ATP产生减少。而RTT组ATP消耗更快,因此进行更多的无氧呼吸,产生更多乳酸,pH值下降[24]。L-乳酸脱氢酶(B0JYN3)将(S)-乳酸和氧化型辅酶I转化为丙酮酸和NADH,可能对糖酵解过程有抑制作用[25]。由相关性分析结果可知,L-乳酸脱氢酶(B0JYN3)与pH值呈高度显著正相关(P<0.001),说明与RTT组相比,LFEFT组牛肉的糖酵解速率减慢,从而延缓了pH值的降低。
PDZ结构域是一种由80~100 个氨基酸残基组成的保守序列,是一种介于二级结构和三级结构之间的结构[26]。LIM蛋白在机体的生长发育过程中发挥重要作用[27]。PDZ和LIM结构域蛋白1(A6H7E3)与TVB-N含量呈高度显著负相关(P<0.001),说明PDZ和LIM结构域蛋白1的丰度越高,TVB-N含量越少,牛肉的新鲜度越高。LFEFT组的PDZ和LIM结构域蛋白1(A6H7E3)的丰度高于RTT组,说明LFEFT牛肉品质较好。
在与色泽的相关性分析中,细胞色素C(P62894)与L*呈显著正相关(P<0.05),与b*呈显著负相关(P<0.05)。细胞色素C(P62894)是生物氧化过程中一个非常重要的电子传递体,在线粒体嵴上与其他氧化酶排列成呼吸链,参与细胞呼吸过程[28]。LFEFT组中细胞色素C(P62894)的丰度高于RTT组,说明采用LFEFT更有利于維持牛肉色泽的稳定性。超氧化物歧化酶也是和肉色相关的一种抗氧化蛋白,它可以破坏在细胞内产生且对生物系统有毒的自由基,维持牛肉品质的稳定,与RTT组相比,LFEFT组超氧化物歧化酶(E1BHL1)上调,与L*呈高度显著正相关(P<0.001),与a*呈极显著正相关(P<0.01),与b*呈高度显著负相关(P<0.001)。说明低频电场有助于防止解冻引起的牛肉变色。
在与质构特性的相关性分析中,肌球蛋白重链(F1MM07)、肌钙蛋白(P63315)与质构特性(硬度、弹性和咀嚼性)呈高度显著正相关(P<0.001)。肌球蛋白重链是肌球蛋白的基本组成单位,在保证肌细胞发挥正常作用中具有重要作用。Lan Weiqing等[29]指出,不适当的解冻可能会造成肌球蛋白重链降解。本研究结果表明:LFEFT组牛肉中肌球蛋白重链(F1MM07)上调,说明相比于RTT,LFEFT对牛肉的硬度、弹性和咀嚼性具有更小的影响。肌钙蛋白是横纹肌特定的蛋白质,在肌肉收缩和舒张过程中起重要调节作用[9]。RTT组牛肉中肌钙蛋白(P63315)下调,说明LFEFT对牛肉的弹性和咀嚼性影响更小。
核糖体可以将遗传密码翻译成氨基酸序列,并从氨基酸单体构建蛋白质聚合物。核糖体相关蛋白在LFEFT组中全部上调,进一步证明低频电场能有效维持肌肉组织细胞的完整性。此外,核糖体参与许多生物过程,包括mRNA转录和抑制[30]。当肌肉受到低频电场的作用时,核糖体试图通过促进mRNA衰变进一步维持细胞稳定性,因此相关蛋白上调[31]。如图9所示,核糖体蛋白(G5E6D6)与pH值、硬度和弹性呈显著正相关(P<0.05)。在先前的报道中,核糖体途径相关蛋白在冷应激下发生改变[32],并且核糖体蛋白质的平衡水平抑制细胞生长和增殖[33],可以推断,在低频电场的帮助下,解冻期间肌肉的冷收缩程度降低。
张淼[34]发现,在汁液损失高的样品中结蛋白含量较高,肌原纤维的横向交联加强,增加了肉的汁液损失,而结蛋白的降解消除了肌原纤维间的交联,迫使水分迁移至细胞间的力消失,而且已经迁移至细胞间的水分可能回吸至细胞内,增加肉的持水性。LFEFT组的结蛋白(O62654)下调,汁液损失率低,因而,结蛋白与总损失率呈高度显著正相关(P<0.001)。
整合素是细胞外基质和肌动蛋白之间的连接点。局灶性黏连是含有多蛋白整合素的复合物[35]。Talin-1(A0A3Q1MLQ7)作为黏着斑的中心蛋白,参与整合素的激活并将其连接到肌动蛋白细胞因子[36]。蛋白质整合素的降解可能不利于保水能力,也被证明与牛肉中滴漏通道的形成有关[37]。在LFEFT与RTT组牛肉比较中,Talin-1(A0A3Q1MLQ7)与滴水损失率呈高度显著负相关(P<0.001),滴水通道的形成有助于提高水分从肌肉细胞“逃逸”的能力,说明LFEFT组的保水能力高于RTT组。
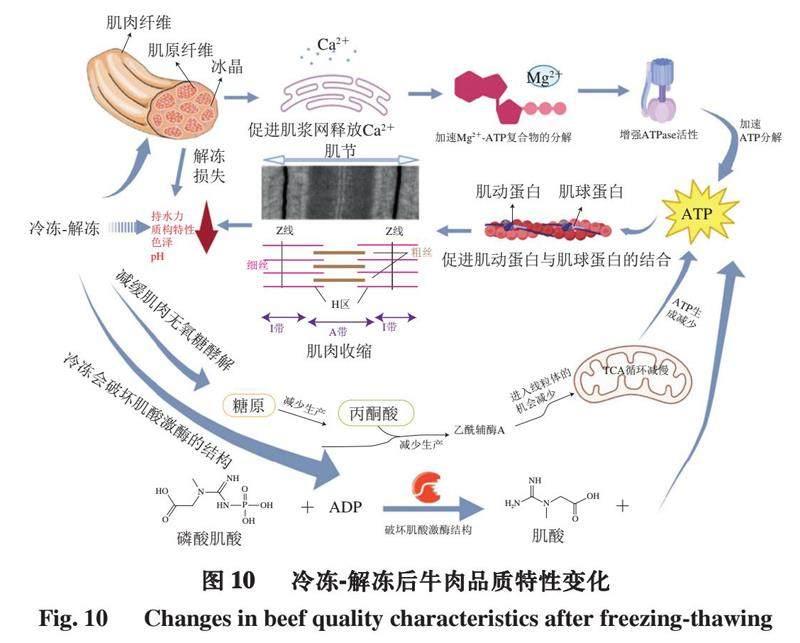
综上,在冷冻和贮藏过程中,肌肉组织中形成的冰晶不仅在解冻过程中造成水分损失,而且还通过破坏肌浆网,导致肌浆网释放钙离子,激活ATPase并加速ATP分解,还可以暴露肌动蛋白和肌球蛋白的结合位点,使肌动蛋白和肌球蛋白结合,从而引起肌肉收缩,进一步影响肌肉质量;并且ATP的产量也有所下降,同时冷冻形成的冰晶破坏肌酸激酶活性,从而减少磷酸肌酸转化产生ATP的量(图10)。在低频电场的帮助下,水分子之间的氢键被破坏,水分子旋转形成小而密集的冰晶,减少对肌肉纤维的损伤,进一步有效改善肉质。
3 结 论
低频电场通过破坏水分子之间的氢键,形成小而密集的冰晶,减少肌肉纤维损伤,从而有效改善解冻后的肉质。从DAPs与品质性状的相关性结果可知,有43 个DAPs与品质指标显著相关,其中高度相关的14 种DAPs有望作为牛肉pH值、色泽、质构特性、TVB-N含量和持水力的潜在标志物。这些新發现有助于了解解冻后肉类中发生的蛋白质组变化,以及低频电场作用影响肉质的潜在机制。在工业生产中,LFEFT既提高了生产效率,又保证了牛肉品质,对于牛肉在贮藏和加工过程中的质量控制具有重要意义。
参考文献:
[1] 吴怡. 西门塔尔牛及其杂交牛肉品质、转录组及肠道菌群的对比研究[D]. 呼和浩特: 内蒙古农业大学, 2023.
DOI:10.27229/d.cnki.gnmnu.2023.001029.
[2] ZHU W B, CHEN Y F, ZHAO J, et al. Impacts of household income on beef at-home consumption: evidence from urban China[J]. Journal of Integrative Agriculture, 2021, 20(6): 1701-1715. DOI:10.1016/S2095-3119(20)63582-1.
[3] 张馨月, 邓绍林, 胡洋健, 等. 几种新型解冻技术对肉品质影响的研究进展[J]. 食品与发酵工业, 2020, 46(12): 293-298. DOI:10.13995/j.cnki.11-1802/ts.023813.
[4] HU R, ZHANG M, JIANG Q Y, et al. A novel infrared and microwave alternate thawing method for frozen pork: effect on thawing rate and products quality[J]. Meat Science, 2023, 198: 109084. DOI:10.1016/j.meatsci.2022.109084.
[5] ZHANG Y L, LIU G S, XIE Q W, et al. A comprehensive review of the principles, key factors, application, and assessment of thawing technologies for muscle foods[J]. Comprehensive Reviews in Food Science and Food Safety, 2023, 22(1): 107-134. DOI:10.1111/1541-4337.13064.
[6] CAI L Y, ZHANG W D, CAO A L, et al. Effects of ultrasonics combined with far infrared or microwave thawing on protein denaturation and moisture migration of Sciaenops ocellatus (red drum)[J]. Ultrasonics Sonochemistry, 2019, 55: 96-104. DOI:10.1016/j.ultsonch.2019.03.017.
[7] LLAVE Y, TERADA Y, FUKUOKA M, et al. Dielectric properties of frozen tuna and analysis of defrosting using a radio-frequency system at low frequencies[J]. Journal of Food Engineering, 2014, 139(10): 1-9. DOI:10.1016/j.jfoodeng.2014.04.012.
[8] CAO C W, XIAO Z C, GE C R, et al. Application and research progress of proteomics in chicken meat quality and identification: a review[J]. Food Reviews International, 2022, 38(3): 313-334. DOI:10.1080/87559129.2020.1733594.
[9] 赵娟红. 基于蛋白质组学分析不同贮藏温度下猪肉的品质变化机制[D]. 长沙: 中南林业科技大学, 2019.
[10] MALHEIROS J M, ENRIQUEZ C E, BRAGA C P, et al. Application of proteomic to investigate the different degrees of meat tenderness in Nellore breed[J]. Journal of Proteomics, 2021, 248: 104331. DOI:10.1016/j.jprot.2021.104331.
[11] MORZEL M, CHAMBON C, HAMELIN M, et al. Proteome changes during pork meat ageing following use of two different pre-slaughter handling procedures[J]. Meat Science, 2004, 67(4): 689-696. DOI:10.1016/j.meatsci.2004.01.008.
[12] FUENTE-GARCIA C, ALDAI N, SENTANDREU E, et al. Search for proteomic biomarkers related to bovine pre-slaughter stress using liquid isoelectric focusing (OFFGEL) and mass spectrometry[J]. Journal of Proteomics, 2019, 198: 59-65. DOI:10.1016/j.jprot.2018.10.013.
[13] SUMAN S P, WANG Y, GAGAOUA M, et al. Proteomic approaches to characterize biochemistry of fresh beef color[J]. Journal of Proteomics, 2023, 281: 104893. DOI:10.1016/j.jprot.2023.104893.
[14] ZHANG Y M, ZHANG X Z, WANG T T, et al. Implications of step-chilling on meat color investigated using proteome analysis of the sarcoplasmic protein fraction of beef longissimus lumborum muscle[J]. Journal of Integrative Agriculture, 2018, 17(9): 2118-2125. DOI:10.1016/S2095-3119(18)62028-3.
[15] 張莉, 孙佳宁, 朱明睿, 等. 解冻方式对羊肉品质及微观结构的影响[J]. 核农学报, 2022, 36(8): 1607-1617. DOI:10.11869/j.issn.100-8551.2022.08.1607.
[16] 马翼飞, 刘欢, 单钱艺, 等. 不同解冻方式对小黄鱼品质的影响[J]. 食品与发酵工业, 2021, 47(1): 222-228. DOI:10.13995/j.cnki.11-1802/ts.025025.
[17] 雷露, 许浩翔, 周景瑞, 等. 贵州关岭黄牛不同部位肌肉中营养成分含量及品质分析[J]. 黑龙江畜牧兽医, 2023(20): 52-56. DOI:10.13881/j.cnki.hljxmsy.2022.10.0222.
[18] ZHANG Y, PUOLANNE E, ERTBJERG P. Mimicking myofibrillar protein denaturation in frozen-thawed meat: effect of pH at high ionic strength[J]. Food Chemistry, 2021, 338: 128017. DOI:10.1016/j. foodchem.2020.128017.
[19] 李翰卿, 马俪珍, 陈胜军, 等. 不同解冻方式对鸢乌贼胴体肌肉品质的影响[J]. 食品与生物技术学报, 2023, 42(5): 20-28. DOI:10.3969/j.issn.1673-1689.2023.05.003.
[20] 王芊彤, 段鑫鑫, 梁榮蓉, 等. 真空贴体包装对长期冰温贮藏牛肉货架展示期间肉色和货架期的影响[J]. 食品研究与开发, 2024, 45(1): 43-50. DOI:10.12161/j.issn.1005-6521.2024.01.006.
[21] 王丽, 陈伟, 王远亮, 等. 解冻方式对猪肉品质、理化性质与微观结构的影响[J]. 食品与机械, 2023, 39(10): 35-41. DOI:10.13652/j.spjx.1003.5788.2023.80371.
[22] ZHANG Y M, DING C J, NI J B, et al. Effects of high-voltage electric field process parameters on the water-holding capacity of frozen beef during thawing process[J]. Journal of Food Quality, 2019, 2019: 1-11. DOI:10.1155/2019/9140179.
[23] CHEN B, ZHANG M, WANG Y C, et al. Comparative study of conventional and novel combined modes of microwave-and infrared-assisted thawing on quality of frozen green pepper, carrot and cantaloupe[J]. LWT-Food Science and Technology, 2022, 154: 112842. DOI:10.1016/j.lwt.2021.112842.
[24] MATARNEH S K, SCHEFFLER T L, GERRARD D E. The conversion of muscle to meat[M]//TOLDR? F. Lawries meat science. Woodhead Publishing, 2023: 159-194. DOI:10.1533/9781845691615.128.
[25] MISHRA M, DIXIT P K. Cellular lactate and pyruvate are key intermediates for intracellular energy metabolism regulated by lactate dehydrogenase (LDH) in age-related phenomenon[J]. International Journal of Clinical Biochemistry and Research, 2020, 7(2): 285-290. DOI:10.18231/j.ijcbr.2020.062.
[26] GUCLUT F, ATILGAN A R, ATILGAN C. Dynamic community composition unravels allosteric communication in PDZ3[J]. The Journal of Physical Chemistry B, 2021, 125(9): 2266-2276. DOI:10.1021/acs.jpcb.0c11604.
[27] ABBARIKI T N, GONDA Z, KEMLER D, et al. The LIM domain protein nTRIP6 modulates the dynamics of myogenic differentiation[J]. Scientific Reports, 2021, 11: 12904. DOI:10.1038/s41598-021-92331-8.
[28] CAO M J, CAO A L, LI Y C, et al. Effects of magnetic nanoparticles plus microwave on the thawing of largemouth bass (Micropterus salmoides) fillets based on iTRAQ quantitative proteomics[J]. Food Chemistry, 2019, 286: 506-514. DOI:10.1016/j.foodchem.2019.02.051.
[29] LAN W Q, ZHAO Y N, GONG T S, et al. Effects of different thawing methods on the physicochemical changes, water migration and protein characteristic of frozen pompano (Trachinotus ovatus)[J]. Journal of Food Biochemistry, 2021, 45(8): e13826. DOI:10.1111/jfbc.13826.
[30] WEN Y, ALIMOV A P, MCCARTHY J J. Ribosome biogenesis is necessary for skeletal muscle hypertrophy[J]. Exercise and Sport Sciences Reviews, 2016, 44(3): 110. DOI:10.1249/jes.0000000000000082.
[31] VALVERDE R, EDWARDS L, REGAN L. Structure and function of KH domains[J]. The FEBS Journal, 2008, 275(11): 2712-2726. DOI:10.1111/j.1742-4658.2008.06411.x.
[32] QIAN S Y, LI X, LIU C J, et al. Proteomic changes involved in water holding capacity of frozen bovine Longissimus dorsi muscles based on DIA strategy[J]. Journal of Food Biochemistry, 2022, 46(10): e14330. DOI:10.1111/jfbc.14330.
[33] ZHANG S H, KANG Z H, CAI H F, et al. Identification of novel alternative splicing of bovine lncRNA lncFAM200B and its effects on preadipocyte proliferation[J]. Journal of Cellular Physiology, 2021, 236(1): 601-611. DOI:10.1002/jcp.29887.
[34] 張淼. 应激过程中组织和细胞内HSPs表达与应激性损伤机理研究[D]. 南京: 南京农业大学, 2011.
[35] GU L H, CHEN J L, HU C J, et al. Integrated transcriptomics and metabolomics study of embryonic breast muscle of Jiaji ducks[J]. 2023, 452: 131214. DOI:10.21203/rs.3.rs-3444280/v1.
[36] ZHAO Y, LYKOV N, TZENG C M. Talin?1 interaction network in cellular mechanotransduction[J]. International Journal of Molecular Medicine, 2022, 49(5): 1-12. DOI:10.3892/ijmm.2022.5116.
[37] DU L L, CHANG T P, AN B X, et al. Transcriptome profiling analysis of muscle tissue reveals potential candidate genes affecting water holding capacity in Chinese Simmental beef cattle[J]. Scientific Reports, 2021, 11(1): 11897. DOI:10.1038/s41598-021-91373-2.
基金项目:2022湖南省农业产业技术体系项目(湘农发2022-67);湖南省重点研发计划项目(2022NK2035)
第一作者简介:林颖(1998—)(ORCID: 0009-0002-1084-4517),女,硕士研究生,研究方向为食品生物技术。E-mail: linying2310@163.com
*通信作者简介:李宗军(1967—)(ORCID: 0000-0001-7495-3822),男,教授,博士,研究方向为食品生物技术。E-mail: hnlizongjun@163.com

