叔丁醇暴露对HSPA1L敲除型雄性小鼠甲状腺的影响
董思林 赵振军 石慧
DOI:10.16783/j.cnki.nwnuz.2024.03.006
收稿日期:2023-12-20;修改稿收到日期:2024-02-20
基金项目:国家重点研发计划项目(2018YFC1003600)
作者简介:董思林(1997—),女,黑龙江鸡西人,硕士研究生.主要研究方向为毒理学.
E-mail:2501231248@qq.com
*通信联系人,男,副教授,博士.主要研究方向为毒理学.
E-mail:zf@ytu.edu.cn
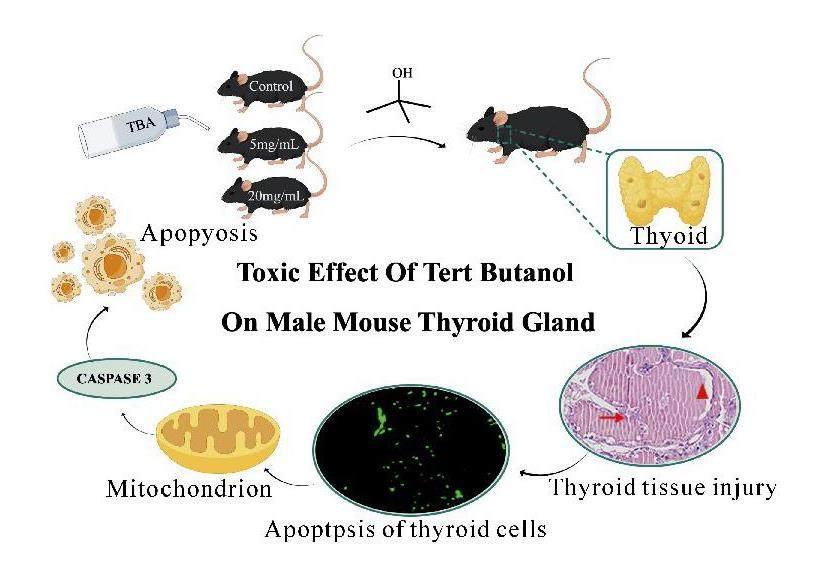
摘要:以HSPA1L基因敲除(HSPA1L-/-)雄性小鼠为研究对象,观察甲状腺组织形态和细胞凋亡情况,分析Caspase-3蛋白表达,探讨叔丁醇(TBA)的毒性以及HSPA1L在此过程中的作用机制.结果表明,HSPA1L-/-小鼠甲状腺的重量随TBA剂量增加而显著降低(P<0.05);甲状腺上皮滤泡细胞随TBA剂量增加而增大,高剂量组甲状腺滤泡甚至发生融合现象;甲状腺细胞凋亡增强,甲状腺组织Caspase-3表达量极显著增加(P<0.01).HSPA1L-/-小鼠对TBA暴露更为敏感,TBA造成的伤害显著增强,提示HSPA1L可能通过负调控Caspase-3表达,抑制细胞凋亡,维持细胞稳态.
关键词:HSPA1L;敲除小鼠;叔丁醇;甲状腺;凋亡
中图分类号:Q 256 文献标志码:A 文章编号:1001-988Ⅹ(2024)03-0048-07
Effects of tert-butanol exposure on thyroid in HSPA1L
knockout male mice
DONG Si-lin,ZHAO Zhen-jun,SHI Hui
(College of Life Sciences,Yantai University,Yantai 264005,Shandong,China)
Abstract:
In this study,male mice with HSPA1L gene deletion were studied to observe the thyroid tissue morphology and cell apoptosis,analyze the expression of Caspase-3 protein,and explore the toxicity of TBA and the potential mechanism of HSPA1L.The results showed that the thyroid weight of HSPA1L-/- mice decrease
significantly with the increase of TBA dose(P<0.05).Thyroid epithelial follicular cells enlarged with the increase of
TBA dose,and follicular fusion even occured in the high dose group.Cell apoptos
of thyroid tissue were significantly enhanced.The expression of Caspase-3 in thyroid tissue was very significantly increased(P<0.01).This study showed that HSPA1L-/-mice were more sensitive to TBA exposure,and the damage caused by TBA was significantly enhanced,suggesting that HSPA1L had strong protective effects on inhibiting apoptosis and maintaining cell homeostasis.
Key words:HSPA1L;knockout mice;tert-butanol;thyroid;apoptosis
叔丁醇(TBA, C4H10O)由于其高結晶温度(24 ℃)、高蒸汽压、易升华等特点被视为一种理想的冻干溶媒,可解决水难溶性药物冻干制剂的制备难题[1-2],是一种广泛应用于医药化工领域的有机溶剂,但是TBA的毒性不容忽视.目前,关于TBA的应用标准,国内外药典均未收载[3].探讨TBA的毒性及作用机制,对规范TBA安全使用具有重要意义.HSPA1L属于HSP70家族, HSPA1L作为一种应激蛋白,在保护细胞免于凋亡、氧化损伤和基因损伤等方面起关键作用[4].涉及HSPA1L的应激包括缺氧、暴露于紫外线和化学物质、病毒制剂、营养缺乏、手术、情绪和机械应激等[5-8].
研究表明,HSPA1L蛋白在睾丸、肺等组织中发挥重要作用,与生殖和肿瘤等有关[9-11],但HSPA1L蛋白在甲状腺中的作用鲜有报道.甲状腺由甲状腺滤泡上皮细胞组成,促进新陈代谢和生长发育.甲状腺对环境因素的影响非常敏感.研究表明,双酚A[12-15]、多氯联苯[16-19]、高氯酸盐[20]、重金属[21]、壬基酚[22]、辐射[23-24]等都会影响甲状腺结构和功能.
叔丁醇作为一种广泛使用的有机溶剂,需关注其安全性,但其对甲状腺的影响报道较少.美国国家毒理学计划(NTP,1995)研究发现,在5,10和20 mg·mL-1TBA暴露浓度下,雄性小鼠甲状腺滤泡细胞增生显著.叔丁醇对雄性大鼠和雌性小鼠有致癌活性,在雄性大鼠中观察到肾小管腺瘤或癌变事件增加,在雌性小鼠中可观察到甲状腺滤泡细胞腺癌事件有所增加[25].
文中以HSPA1L-/-雄性小鼠作为研究对象,分析TBA对该小鼠甲状腺的毒性以及HSPA1L在此过程中的可能作用机制,探讨TBA的安全用量,为确定TBA的安全使用标准提供一定的理论依据.
1 材料与方法
1.1 材料
1.1.1 实验动物
C57BL/6野生(WT)型小鼠由济南朋悦动物有限公司提供,HSPA1L-/-(KO)型小鼠由山东大学实验动物中心提供,体重18~25 g,饲养于烟台大学生命科学学院动物房内.实验鼠及实验方法均符合烟台大学生命科学学院动物实验福利伦理审查要求(B202104-8).
1.1.2 主要试剂
动物基因组DNA快速抽提试剂盒,Gel-Red(10000x)、DNA Ladder(0.2-12kb)、PCR Kit with Taq、苏木素伊红(hematoxylin-eosn staining,HE)染色试剂盒,一步法TUNEL细胞凋亡检测试剂盒(绿色荧光),WesternBlot凝胶试剂盒均购自碧云天生物科技有限公司.Caspase-3一抗抗体购自Abcam,二抗购自中山金桥.
1.2 方法
1.2.1 小鼠基因型鉴定
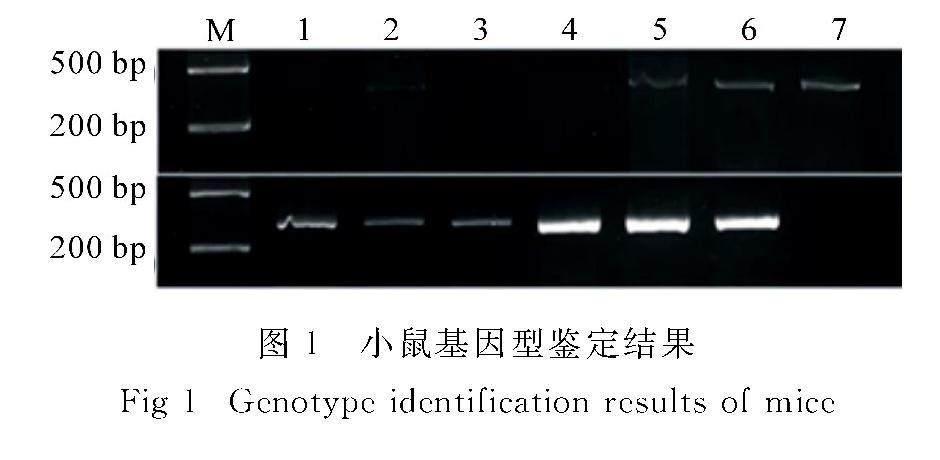
剪取2周龄幼鼠的尾部组织0.5 cm提取gDNA,进行PCR扩增.小鼠HSPA1L基因引物序列如下:F1:5′-GAACAAAG ATAGGAAGCCCG-3′,F2:5′-AATGAGGTCCTT TCCTGGCTG-3′,R:5′-GATGACAGAAGTTG TTTCCTTTGGG-3′.扩增条件为:94 ℃预变性3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,共34个循环;72 ℃延伸10 min.待检测核酸分子量为200~500 bp之间,使用1.5% 琼脂糖凝胶进行电泳,在凝胶成像仪下观察条带.
1.2.2 叔丁醇暴露实验
根据国家毒理学计划(NTP)的报告,在一项为期2年的实验中,饮用水中含2%的TBA对雄性大鼠和雌性小鼠致癌(NTP,1995),本研究选择0.5%(5 mg·mL-1)TBA作為低剂量组,2%(20 mg·mL-1)TBA作为高剂量组.将野生(WT)型和HSPA1L-/-(KO)型小鼠各分为3组,每组分别暴露于不同浓度的TBA(0,5,20 mg·mL-1).将TBA直接溶解于饮用水中,动物在此条件下暴露6周后,处死小鼠并收集甲状腺器官.暴露过程中,每日测量所有组小鼠的体重(BW)和饮水量.
1.2.3 甲状腺组织采集及组织病理学观察
HSPA1L-/-、WT雄性小鼠颈椎脱臼处死后迅速分离出甲状腺,用PBS冲洗干净后吸干水分称重,器官指数计算公式为:器官指数=器官重量/体重.另将甲状腺组织用4%多聚甲醛固定24 h后进行石蜡包埋、组织切片,HE染色后于显微镜下观察.
1.2.4 细胞凋亡检测
甲状腺组织的石蜡切片脱蜡后滴加不含DNase的蛋白酶K(20 μg·mL-1),37 ℃孵育15 min;PBS清洗3次,加50 μL TUNEL检测液,37 ℃避光孵育1 h;PBS清洗3次,用抗荧光淬灭封片液封片后在荧光显微镜下观察.
1.2.5 凋亡相关蛋白表达量检测
甲状腺组织的石蜡切片脱蜡后微波炉高火热激修复30 min;PBS清洗3次,BSA封闭1 h后,加一抗4 ℃过夜,PBS洗涤后加入荧光标记的二抗避光孵育1 h;PBS清洗3次,DAPI孵育5 min,用抗荧光淬灭封片液封片后在荧光显微镜下观察.
1.3 统计学处理
利用SPSS22.0统计学软件、Prism9.0对实验数据进行双向方差分析,并用Orign软件绘图,结果用均值±标准偏差表示.P<0.05认为差异有统计学意义.
2 结果与分析
2.1 叔丁醇暴露实验
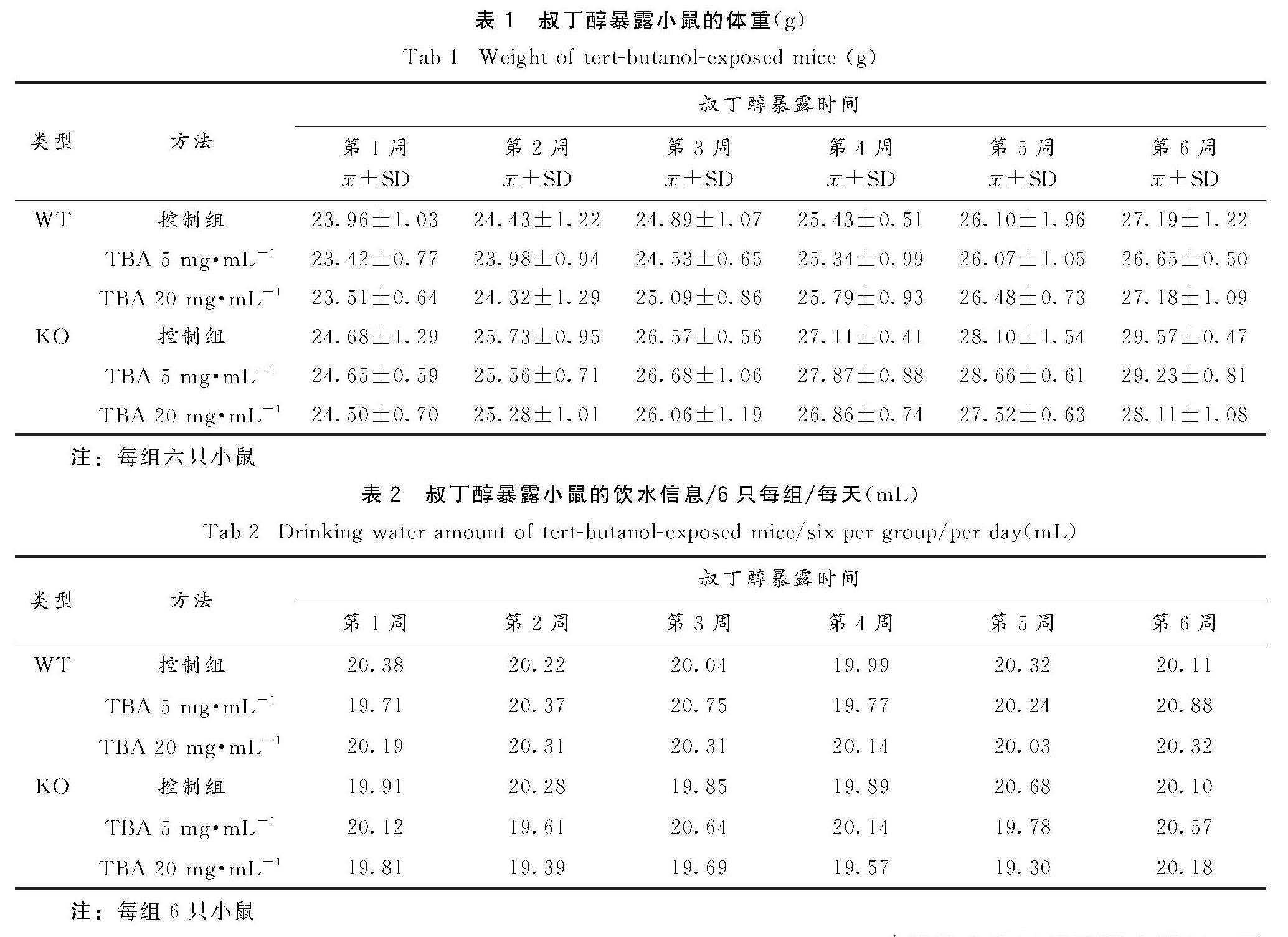
由表1可知,小鼠体重随周龄增加而增加,但是各组之间差异无统计学意义.由表2可知,高剂量TBA暴露组小鼠饮水量稍少于低剂量组及对照组,但各组每日饮水量的差异均无统计学意义.
2.2 基因型鉴定结果
如图1所示,WT小鼠扩增出530bp的单条带,HSPA1L-/-小鼠扩增出343bp的单条带,杂合基因型小鼠扩增出343bp和530bp的两条带.图1中,1,3,4为HSPA1L-/-小鼠;2,5,6为杂合小鼠;7为WT小鼠.
2.3 WT,HSPA1L-/-雄性小鼠甲状腺器官重量、脏器系数分析
HSPA1L-/-小鼠甲状腺重量随TBA剂量增加而降低,低剂量组与对照组差异显著(P<0.05);高剂量组与对照组差异极显著(P<0.01)(图2(a)).
甲状腺脏器指数均显著降低,低剂量组与高剂量组差异显著(P<0.05);高剂量组与对照组差异极显著(P<0.01).20 mg·mL-1TBA暴露组野生型小鼠与HSPA1L-/-小鼠差异显著(P<0.05)(图2(b)).
2.4 WT,HSPA1L-/-小鼠甲状腺组织病理学切片分析
病理结果显示(图3),对照组甲状腺滤泡大小中等,上皮细胞为单立方或短柱状,细胞排列整齐;HSPA1L-/-小鼠甲状腺滤泡腔随TBA剂量增加而增大.高剂量组甲状腺滤泡腔明显扩大,充满红色胶体,少量滤泡腔融合形成巨大滤泡(见红色箭头),上皮细胞萎缩变性(红色三角形)且部分区域被炎性细胞浸润(蓝色三角形).
2.5 WT,HSPA1L-/-小鼠甲状腺细胞凋亡情况
凋亡结果显示,对照组HSPA1L-/-小鼠及对照组野生型小鼠几乎无凋亡信号,随着TBA剂量增加,5 mg·mL-1组和20 mg·mL-1组HSPA1L-/-小鼠可见大量凋亡信号(图4(a)).低剂量组、高剂量组与对照组HSPA1L-/-小鼠甲状腺细胞凋亡率差异显著(P<0.01).野生型小鼠甲状腺细胞凋亡信号不明显,各剂量组间差异无统计学意义.低、高剂量组野生型小鼠与HSPA1L-/-小鼠间凋亡率存在极显著差异(P<0.001)(图4(b)).
2.6 WT,HSPA1L-/-小鼠甲状腺凋亡蛋白表达
野生型各剂量组及对照组HSPA1L-/-小鼠Caspase-3处于低表达状态,但Caspase-3蛋白在 HSPA1L-/-小鼠低剂量组及高剂量组甲状腺滤泡上皮细胞及部分红细胞中处于高水平表达(图5(a)).用ImageJ分析免疫荧光强度,结果显示野生型小鼠各实验组间荧光信号无较大差异;与对照组相比,TBA低剂量和高剂量组HSPA1L-/-小鼠Caspase-3蛋白表达量均显著增强(P<0.05).低剂量及高剂量TBA组HSPA1L-/-小鼠与野生型小鼠间存在显著差异(P<0.01)(图5(b)).
3 讨论
甲状腺是人体最大的内分泌器官之一,主要功能是调节机体各种代谢和生长发育.甲状腺由大量的滤泡和滤泡旁细胞组成.滤泡内充满均质的嗜酸性胶质,胶质就是滤泡上皮细胞分泌的甲状腺激素.
HSPA1L属于应激或热休克蛋白家族,在多种组织细胞中发挥作用.HSPA1L在生殖系中组成型高表达,保护男性生殖细胞免受热和氧化等外部压力,具有在多重应激后提高睾丸细胞存活的能力[26].HSPA1L与精子活动性和精子发生关系密切,低活动性精子中HSPA1L表达显著降低;与年轻动物相比,老龄动物睾丸中HSPA1L表达显著降低,影响精子发生[27].HSPA1L也与炎性肠病和肺癌等疾病发生关系密切[28].
本研究结果显示,叔丁醇暴露时,HSPA1L-/-小鼠甲状腺质量减轻;TBA高剂量组HSPA1L-/-小鼠甲状腺滤泡细胞变形,囊内胶状物质扩张,部分滤泡细胞甚至发生融合,甲状腺组织损伤严重.TBA高剂量组HSPA1L-/-小鼠甲状腺滤泡可见大量凋亡信号,而野生型小鼠甲状腺细胞凋亡不明显,表明HSPA1L可能具有抑制细胞凋亡的作用,HSPA1L缺失导致抑制作用减弱,细胞凋亡增强.
细胞凋亡通常包括内源性途径、外源性途径和内质网途径三种.Caspase-3是三条凋亡信号通路的交汇点,是凋亡信号转导通路中的重要执行分子,是凋亡级联反应的最终效应蛋白,其激活后可导致细胞的不可逆性凋亡[29-30].HSPA1L是Hsp70家族成员之一,研究表明HSP70在Caspase凋亡途径中发挥关键作用,HSP70在肿瘤细胞中通过下调凋亡相关蛋白表达和蛋白酶活性起到拮抗凋亡的作用[31-32].本研究中, TBA低剂量组和高剂量组HSPA1L-/-小鼠Caspase-3蛋白表达均显著增加,甲状腺组织细胞凋亡程度显著增强.HSPA1L-/-小鼠叔丁醇暴露较野生型小鼠甲状腺细胞凋亡更为严重,提示HSPA1L可能通过负调控Caspase-3表达,从而抑制细胞凋亡,维持细胞稳态.
尽管叔丁醇用途广泛,但其毒性不容忽视,TBA应用标准国内外药典尚未收载.研究表明,B6C3F1小鼠在饮用水中接触TBA,TBA浓度为20 mg·mL-1时会降低小鼠存活率并增加滤泡细胞腺瘤或癌的发病率[25]. 小鼠海马神经元细胞暴露于TBA(20 mg·mL-1) 6 h,细胞存活率低于对照组80%[33].TBA(20 mg·mL-1)可导致肝脏小叶中心肥大和肉芽肿,显著诱导生殖毒性,野生型组小鼠附睾重量减少.TBA对ALDH2-/-小鼠的毒性作用更为显著,即使暴露于较低浓度的TBA中,ALDH2-/-小鼠的肝损伤和生殖毒性也增加了.基因缺失也许是TBA诱导毒性的一个风险因素[34].本研究中,随TBA剂量增加,野生型小鼠甲状腺变化不显著,但HSPA1L-/-小鼠甲状腺变化显著,脏器指数显著降低,细胞凋亡显著增强,HSPA1L缺失使甲状腺对TBA作用更敏感,与已有报道相似[34].
综合上述研究,推测叔丁醇使用浓度低于20 mg·mL-1较为安全.但研究也发现,叔丁醇对实验动物作用效果不一致.对雄性大鼠和雌性小鼠有致癌活性,在雄性大鼠中肾小管腺瘤或癌变增加,雌性小鼠中甲状腺滤泡细胞腺癌增加.但雌性大鼠中未發现致癌证据,雄性小鼠中的证据难以解释[35].因此,叔丁醇的应用标准还需要进一步研究来规范.
参考文献:
[1] TEAGARDEN D L,BAKER D S.Practical aspects of lyophilization using non-aqueous co-solvent systems[J].Eur J Pharm Sci,2002,15(2):115.
[2] LI C,DENG Y.A novel method for the preparation of liposomes:Freeze drying of monophase solutions[J].J Pharm Sci,2004,93(6):1403.
[3] 王洪亮,董武军,陈蕾,等.叔丁醇在生物医药领域的主应用及研究进展[J].药学学报,2021,56(9):2513.
[4] ZHENG J P,YU Y L,LI R F,et al.Interaction of heat shock protein 70(HSP70) polymorphisms and occupational hazards increases the risk of hypertension in coke oven workers[J].Occup Environ Med,2018,75(11):807.
[5] ARRIGO A P,GIBERT B.HspB1,HspB5 and HspB4 in human cancers:Potent oncogenic role of some of their client proteins[J].Cancers(Basel),2014,6(1):333.
[6] 丁艷平,田雨馨,张晋平.黄芪甲苷对辐射诱导损伤小鼠肺脏组织结构及Caspase-3、TNF-α表达的影响[J].西北师范大学学报(自然科学版),2020,56(6):83.
[7] KHALIL A A,KABAPY N F,DERAZ S F.Heat shock proteins in oncology:Diagnostic biomarkers or therapeutic targets[J].Biochim Biophys Acta,2011,1816(2):89.
[8] WANG X X,CHEN M J,ZHOU J,et al.HSP27,70 and 90,anti-apoptotic proteins,in clinical cancer therapy[J].Int J Oncol,2014,45(1):18.
[9] 丁艳平,张培怡,董晓庆,等.NLRP3炎性小体在辐射诱导肝损伤中的作用[J].西北师范大学学报(自然科学版),2022,58(3):85.
[10] WILLIAMS P A,KOBILNYK H E,MCMILLAN E A,et al.MAPKAP kinase 2-mediated phosphorylation of HspA1L protects male germ cells from heat stress induced apoptosis[J].Cell Stress Chaperon,2019,24(6):1127.
[11] CHOI S I,LEE J H,KIM R K,et al.HSPA1L enhances cancer stem cell-like properties by activating IGF1Rβ and regulating β-catenin transcription[J].Int J Mol Sci,2020,21(18):6957.
[12] MAGLIONE A,ROLLA S,DE MERCANTI S F,et al.The adaptive immune system in multiple sclerosis:An estrogen-mediated point of view[J].Cells,2019,8(10):1280.
[13] CUNNINGHAM M,GILKESON G.Estrogen receptors in immunity and autoimmunity[J].Clin Rev Allerg Immu,2011,40(1):66.
[14] PANCHANATHAN R,CHOUBEY D.Murine BAFF ex-pression is up-regulated by estrogen and interferons:im-plications for sex bias in the development of autoimmunity[J].Mol Immu,2013,53(1/2):15.
[15] KIM M J,PARK Y J.Bisphenols and thyroid hormone[J].Endocrinol Metab(Seoul),2019,34(4):340.
[16] LINA B,JUSTIN J,ELISABETH J,et al.Thyroid furction and immune status in perch(Perca fluviatilis)from lakes contaminated with PFASs of PCBs[J].Ecotoxicol Environ Sat,2021,222:112495.
[17] WANG C,PETRIELLO M C,ZHU B,et al.PCB 126 in-duces monocyte/macrophage polarization and inflamma-tion through AhR and NF-kappaB pathways[J].Toxicol Appl Pharm,2019,367:71.
[18] SOKAL A,JARMAKIEWICZ-CZAJA S,TABARKIE-WICZ J,et al.Dietary intake of endocrine disrupting sub-stances presents in environment and their impact on thy-roid function[J].Nutrients,2021,13(3):867.
[19] LERRO C C,JONES R R,LANGSETH H,et al.A nested case-control study of polychlorinated biphenyls,organo-chlorine pesticides,and thyroid cancer in the Janus Se-rum bank cohort[J].Environ Res,2018,165:125.
[20] SONNE C,WOLKERS H,LEIFSSON P S,et al.Chronic dietary exposure to environmental organochlorine contaminants induces thyroid gland lesions in Arctic foxes[J].Environ Res,2009,109(6):702.
[21] VIGNERI R,MALANDRINO P,GIANI F,et al.Heavy metals in the volcanic environment and thyroid cancer[J].Mol Cell Endocrinol,2017,457:73.
[22] WANG L,GUO M,FENG G L,et al.Effects of chronic exposure to nonylphenol at environmental concentration on thyroid function and thyroid hyperplasia disease in male rats[J].Toxicol,2021,461:152918.
[23] ALBI E,CATALDI S,LAZZARINI A,et al.Radiation and thyroid cancer[J].Int J Mol Sci,2017,18(5):911.
[24] RUBINO C,CAILLEUX A F,DE VATHAIRE F,et al.Thyroid cancer after radiation exposure[J].Eur J Cancer,2002,38(5):645.
[25] NTP.NTP toxicology and carcinogenesis studies of t-butyl alcohol(cas no.75-65-0) in F344/n rats and B6C3F1 mice(drinking water studies)[R].National Toxicology Program Technical Report Series,1995,436:1.
[26] WILLIAMS P A,KOBILNYK H E,MCMILLAN E A,et al.MAPKAP kinase 2-mediated phosphorylation of HspA1L protects male germ cells from heat stress-induced apoptosis[J].Cell Stress Chaperon,2019,24(6):1127.
[27] LIU X X,TENG Z,WANG Z X,et al.Expressions of HSPA1L and HSPA9 are associated with poor sperm quality of low-motility spermatozoa in fertile men[J].Andrologia,2022,54(2):e14321.
[28] TAKAHASHI S,ANDREOLETTI G,CHEN R,et al.De novo and rare mutations in the HSPA1L heat shock gene associated with inflammatory bowel disease[J].Genome Med,2017,26(1):8.
[29] PORTER A G,JNICKE R U.Emerging roles of caspase-3 in apoptosis[J].Cell Death Differ,1999,6(2):99.
[30] 于豐铭,徐扬.Caspase-的研究进展[J].中国细胞生物学学报,2020,42(11):2072.
[31] 张杰,田波,葛名欢,等.不同热休克蛋白在肾细胞癌组织中的表达及其意义[J].中国组织化学与细胞化学杂志,2003,12(3):272.
[32] 宋邕.HSP70和Caspase-3蛋白在胆管癌组织中表达及临床意义的研究[D].沈阳:中国医科大学,2008:26.
[33] MA J X,SONG D M,ZHANG Y Y,et al.SIRT1 exhibits antioxidative effects in HT22 cells induced by tert-butyl alcohol[J].Environ Toxicol,2018,33(2):142.
[34] LIN L P,SUDA M,XU C L,et al.Aldehyde dehydrogenase 2 deficiency significantly exacerbates tert-butyl alcohol-induced toxicity in mice[J].J Appl Toxicol,2020,40(7):979.
[35] World Health Organization.Maintenance of the Guideline for Residual Solvents[EB/OL].World Health Organization,2021.https://database.ich.org/sites/default/files/ICH_Q3C-R8_Guideline_Step4_2021_0422_1.pdf.
(责任编辑 陆泉芳)

