浅谈化学平衡常数在解题中的应用
新疆乌鲁木齐市第一中学 张 芳
高考新课标明析:掌握化学平衡的特征,了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算。而化学平衡常数成为新课标地区的高考命题热点,每年不管模考还是高考,都会涉及到相关内容。如2016年各省高考题中,都对化学平衡常数进行了考查,并且试题的综合性很强,知识的网络程度大,能力要求高。化学平衡是必考选修4模考中的重要的理论内容。也是学生最难掌握的。对于初学者来说,在学习这部分内容的时候,总感觉不同意义的平衡常数K太多,容易混淆出错,公式也很多,好不容易把公式记下来,真正在具体应用时又无从下手。究其根源还是对化学平衡常数的概念和意义理解不透彻。本文重在帮助学生理解并掌握化学平衡常数的概念和意义。
一、深刻理解化学平衡常数的概念
化学平衡常数是在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也无论反应物起始浓度是大还是小,最后都能达到平衡,这时各生成物浓度幂的乘积除以各反应物浓度幂的乘积所得的比值是个常数,用K表示。例如:(式中个浓度均为平衡浓度)。化学平衡常数是一个常数,只要温度不变,对于一个具体的可逆反应就对应一个具体的常数值。
二、应用平衡常数应注意的问题
(1)化学平衡常数只与温度有关,与反应物或生成物的浓度无关。
(2)反应物或生成物中有固体和纯液体存在时,其浓度可看做“1”,因而不用代入公式(类似化学反应速率中固体和纯液体的处理)。
(3)化学平衡常数是指某一具体反应的平衡常数。若反应方向改变,则平衡常数改变。若化学方程式中各物质的化学计量系数等倍扩大或缩小,尽管是同一反应,化学平衡常数也会改变。
三、考查化学平衡常数的意义
1. 化学平衡常数值的大小是可逆反应进行程度的标志。它能够表示出可逆反应进行的完全程度。一个可逆反应的K值越大,说明平衡时生成物的浓度越大,反应物转化率也越大。也就是正反应的趋势越强,反之亦然。可以说,化学平衡常数是一定温度下一个可逆反应本身固有的内在性质的定量体现。是化学反应在该条件下进行的最大限度。
2. 一般认为K>105反应较完全,K<105反应很难进行。平衡常数的数值大小可以判断反应进行的程度,估计反应的可能性。因为平衡状态是反应进行的最大限度。
3. 平衡常数数值的大小,只能大致告诉我们一个 可逆反应的正向反应所进行的最大程度,并不能预示反应达到平衡所需要的时间。
4. 平衡常数数值极小的反应,说明正反应在该条件下不可能进行,如:K =10-30(298K)所以常温下用此反应固定氮气是不可能的。
四、考查化学平衡常数的简单计算
1. 化学反应进行方向的判断
对于可逆反应:
任意给出浓度代入下式:
若Qc>K,反应向逆向进行;若Qc=K,反应处于平衡状态;若Qc<K,反应向正向进行。
(1)若温度升高到950℃,达到平衡时K_____1(填写“>”“<”或“=”)。
(2)在850℃时,固定容积的密闭容器中,放入混合物,起始浓度c(CO)=0.01mol/L,c[H2O(g)]=0.03mol/L,c(CO2)=0.02mol/L,c(H2)=0.05mol/L,则反应开始时,H2O(g)的消耗速率比生成速率_____(填写“大”“小”或“不能确定”)。
(3)保持温度、容器的体积不变,若往容器中存入适量的H2,则重新达到平衡,CO的反应速率比充H2之前_____(填写“大”“小”或“不能确定”),理由是________。
解析:(1)K<1
(2)即反应逆向进行,v(逆)>v(正)。所以H2O(g)的消耗速率小于生成速率。
(3)增大,理由是增大H2的浓度,平衡向逆向移动,CO的量比充入H2之前多,因此CO的反应速率增大。
做此类习题只要用好三段式,求出末了浓度,然后带入公式即可判断。
2. 利用K值可判断反应的热效应:若温度升高,K值增大,则正反应为吸热反应;若温度升高,K值减小,则正反应为放热反应;
如2 0 1 6年乌鲁木齐市三模27.【例题5】(3) 利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如下图所示。
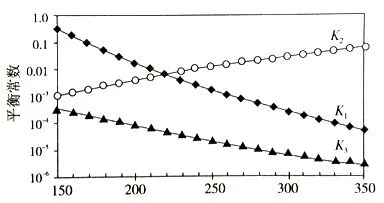
则Δ H1___Δ H3(填“>”、“<”、“=”),理由是_______ 。
此题重在明析平衡常数随温度的变化趋势和规律来判断其焓变大小。本题由图可知随着温度升高,K2曾大,则正反应为吸热反应,所以ΔH2大于0;温度升高,K1和K3值减小,则正反应为放热反应;ΔH1和ΔH3小于0,又由盖斯定律可知ΔH3=ΔH1+ΔH2,所以ΔH1___<ΔH3。要做对本题重在掌握若温度升高,K值增大,则正反应为吸热反应;若温度升高,K值减小,则正反应为放热反应这个原理。
总之, 在近些年的高考试题中,对化学平衡常数相关知识的考查稳中有升,并且试题的综合性很强,知识的网络程度大,能力要求高。足可见化学平衡常数是化学反应原理中非常重要的知识点之一。因此,需要加强化学平衡常数相关知识的教学,提升学生对"化学平衡常数"概念和其意义的理解,进而掌握实际的应用能力.关于平衡常数的应用概括起来,可以分为直接应用和综合应用两个方面。通过平衡常数可以直接判断一个反应进行的程度;或间接的通过平衡常数来判定反应的热效应和反应进行的方向;不管是哪方面的应用,首先理解并掌握化学平衡常数的概念和意义是非常有必要的。

