ERp57通过影响成纤维细胞活化参与特发性肺纤维化疾病发生发展
岳慧慧 张凤芹 贺健晗 张惠兰 王从义
华中科技大学同济医学院附属同济医院呼吸与危重症医学科 生物医学研究中心国家卫生健康委呼吸疾病重点实验室,武汉 430030
特发性肺纤维化 (idiopathic pulmonary fibrosis,IPF)是一种慢性、进行性、纤维化性间质性肺疾病,其临床特征表现为进行性呼吸困难、低氧血症,伴或不伴干咳,最终进展为呼吸衰竭而导致死亡[1]。IPF的病理特征主要表现为普通型间质性肺炎,其组织学特征是病变呈斑片状分布,主要累及胸膜下肺组织,显微镜下可见正常肺泡结构破坏,肺组织呈现纤维化、蜂窝状改变,致密的纤维化瘢痕区伴随着散在分布的成纤维细胞灶[2]。IPF的发病机制尚不明确,目前研究认为IPF是由多基因遗传(如SFTPC、TOLLIP等的基因突变)和环境危险因素(如吸烟和感染)之间复杂的相互作用所致[3]。值得注意的是,近年来人们关注到内质网应激与纤维化疾病发生发展密切相关[4],因此研究内质网应激在IPF中的作用机制具有重要意义。
内质网作为真核细胞中最大的细胞器,参与多种细胞活动,包括负责新合成蛋白的修饰和折叠、糖原的产生和储存、脂质生物合成及维持钙稳态[5]。当细胞受到环境和遗传因素交互作用时,可导致内腔中错误折叠的蛋白质累积,进而诱发内质网应激和激活未折叠蛋白反应。未折叠蛋白反应是一个复杂的信号传导途径,主要通过3种未折叠蛋白反应压力传感器的激活而启动:蛋白激酶RNA样内质网激酶、转录激活因子6 和肌醇需要酶1α[6-7]。研究表明内质网应激和未折叠蛋白反应信号通路可通过诱导肺泡上皮细胞凋亡、成纤维细胞分化、上皮-间充质转分化和巨噬细胞极化等参与肺纤维化形成[4,8]。ERp57,也称为PDIA3、ERp60或GRP58,是蛋白质二硫键异构酶基因家族中的一员,其包含4个硫氧还原蛋白样结构域折叠[9]。研究已揭示ERp57具有氧化还原和蛋白质二硫键异构酶活性,在内质网中通过与分子伴侣钙网蛋白和钙连接蛋白协同作用参与新合成蛋白质的折叠和修饰[10]。ERp57 在器官组织中广泛表达,其表达失调与多种疾病的发生相关,包括神经退行性疾病、肌肉骨骼系统状况、肾纤维化、气道炎症和癌症等[11]。然而,ERp57对成纤维细胞活化的影响以及在IPF 中的作用尚待阐明。因此,本研究将从临床标本和动物模型出发,探究ERp57的表达特征,继而通过人肺原代成纤维细胞探究ERp57对成纤维细胞活化的影响,以期为IPF 的治疗提供新的靶点和理论依据。
1 材料与方法
1.1 实验标本
1.1.1 实验小鼠 实验性研究。所有实验小鼠均采用野生型C57BL/6 背景小鼠,8~10 周龄,雄性,统一从湖北省实验动物中心购买,且动物饲养和实验均在华中科技大学同济医院科研大楼无特定病原体级实验动物中心完成。所有的动物实验相关操作均严格遵循美国国立卫生研究所规定的相关原则,并已通过华中科技大学同济医院动物研究委员会的批准(TJH-201901012)。
1.1.2 人体肺组织 根据ATS/ERS提供的IPF诊断标准,经患者及其家属同意后,收集在华中科技大学同济医学院附属同济医院行肺移植或心肺联合移植的IPF 患者的肺组织以及肺组织手术切除患者(临床诊断为肺部肿块性质待查,影像学上无纤维化,术后病理诊断为良性病变,留取病变部位远端大于5 cm 的正常肺组织)标本作为对照组。本研究经同济医院伦理委员会批准 (TJIRB20210919),并获取患者知情同意。
1.2 动物模型 8~10周龄野生型小鼠经1%戊巴比妥钠 (5 μl/g)麻醉后气管内注射博来霉素(bleomycin,BLM) (2.5 mg/kg,生理盐水溶解),对照组小鼠给予相同剂量的生理盐水,21 d后取肺组织。
1.3 实验细胞 将人体肺组织标本置于无菌EP管,用剪刀、镊子将气管剥离,并剪碎,铺于10 cm皿中,使其贴附于培养皿,采用含10%Gibco血清的高糖DMEM 培养基进行培养。成纤维细胞作为优势细胞,在肺组织块贴壁后的第3~4天,可见成纤维细胞爬出,呈梭形。之后进行传代,取3~6代的细胞进行后续的实验。
1.4 实验材料与仪器 高糖DMEM 培养基、胎牛血清、Opti培养基购自美国Gibco公司;胰酶购自武汉科瑞有限公司;Trizol,逆转录与实时荧光定量PCR 试剂盒购自日本Takara公司;RIPA裂解液购自上海Beyotime公司;PVDF 膜购自美国Millipore公司;ECL发光液购自谷歌生物有限公司;细胞转染试剂盒购自美国ThermoFisher公司;恒温培养箱购自美国ThermoFisher公司;生物显微镜购自日本Olympus公司;实时荧光定量PCR 仪购自美国Bio-Rad公司;Nano Drop微量分光光度计购自美国ThermoFisher公司。BLM 购自辉瑞制药公司;重组人TGF-β1购自美国Pepro Tech公司。
1.5 免疫组织化学分析 用4%多聚甲醛经气管内灌注左肺24 h 后行石蜡包埋,切至5μm切片。脱蜡至水后,使用已经建立的技术对切片进行HE染色和Masson染色[12]。对于免疫荧光染色,脱蜡至水后,使用ERp57 抗体 (1∶100)和FSP1 抗体(1∶100)共孵育切片组织,之后孵育荧光二抗,使用奥林巴斯荧光显微镜进行拍照。
1.6 蛋白质印迹试验 根据标准方案进行蛋白质印迹分析[13]。一抗包括胶原蛋白Ⅰ、纤连蛋白、α-平滑肌肌动蛋白 (alpha smooth muscle actin,α-SMA) (Proteintech,武汉,1∶1 000)、GAPDH(美国Santa Cruz公司,1∶1 000)、ERp57 (美国Abcam 公司,1∶1 000)。使用化学发光底物系统进行检测,灰度值用ImageJ软件分析。
1.7 细胞转染 将人肺成纤维细胞接种在12孔板中 并 分 为4 组:对 照 组、TGF-β1组、ERp57 siRNA 组、ERp57 siRNA+TGF-β1组,待细胞密度为60% 左右开始转染。将ERp57 siRNA 和Lipofectamine 3000 充分混匀后,常温孵育15 min,弃上清,将siRNA 和Lipofectamine 3000混合液加至12孔板内。将细胞置于细胞培养箱内孵育4~6 h,换液至正常含10%胎牛血清的高糖DMEM 完全培养基继续培养。转染48 h后,分别添加重组TGF-β1(10μg/L)刺激细胞24 h 后,收取细胞蛋白。本研究所用的ERp57 siRNA 序列为5′-AGACCCAAATATCGTCATA-3′ (锐 博 生物科技有限公司)。
1.8 统计学分析 本研究中所有的实验均至少重复3次,实验数据以±s表示,采用GraphPad Prism (7.0版)软 件 进 行Student′st检 验,P<0.05为差异有统计学意义。
2 结果
2.1 ERp57在IPF患者中的表达水平 收集IPF患者和对照组的临床特征 (表1),蛋白质印迹结果表明IPF患者中的ERp57蛋白表达水平显著高于对照组(t=6.314,P<0.01);同时IPF组成纤维细胞活化标记α-SMA 蛋白表达水平显著高于对照组(t=4.226,P<0.01)。见图1。
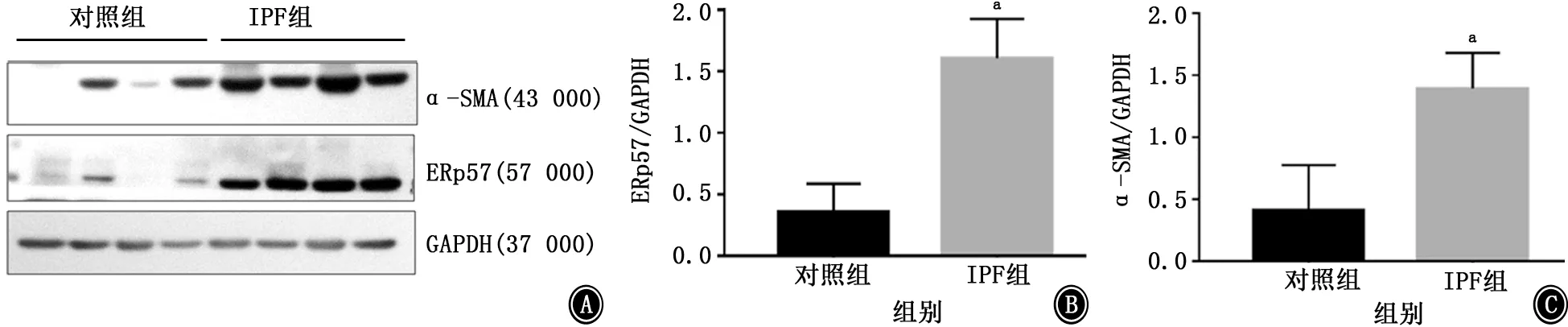
图1 蛋白质印迹检测IPF患者和对照组ERp57、α-SMA 蛋白表达水平 A:电泳图;B:ERp57蛋白相对表达;C:α-SMA 蛋白相对表达

表1 人体标本的临床特征
2.2 小鼠肺纤维化肺组织中ERp57表达特征 为进一步检测ERp57 在小鼠肺组织中的表达情况,利用经气道注射BLM 建立小鼠肺纤维化模型,HE和Masson染色显示经BLM 处理21 d后,小鼠肺组织肺泡结构破坏,肺泡壁增厚,并伴有炎症细胞浸润;Masson染色示大量胶原纤维聚集,以上结果均为纤维化的典型表现 (图2)。蛋白质印迹和免疫荧光染色结果显示,ERp57在BLM 小鼠纤维化肺组织中表达水平较对照组显著上调。同时,免疫荧光结果表明,ERp57 主要在纤维化小鼠的肺成纤维细胞中表达,且与对照组相比,BLM 诱导小鼠的纤维化肺组织中,双染阳性数量显著增加(t=7.443,P<0.01)。见图3~5。

图2 对照组 (A、C)和博来霉素处理21 d后小鼠 (B、D)肺组织病理表现 (每组3只小鼠) HE (A、B) Masson (C、D)×100

图3 蛋白质印迹检测各组小鼠肺组织中ERp57、collagen Ⅰ的表达 (每组3只小鼠) A:电泳图;B:ERp57蛋白相对表达;C:collagen Ⅰ相对表达

图4 ERp57 (绿色)与FSP1 (红色)的免疫荧光共染 ×400

图5 双染阳性数目分析
2.3 成纤维细胞中ERp57的表达 提取正常对照人体肺原代成纤维细胞进行培养,在镜下可观察到呈梭形的细胞,成纤维细胞特异性蛋白FSP1染色阳性,以上表明该细胞为成纤维细胞 (图6)。之后利用TGF-β1 刺激成纤维细胞0、12、24、48 h后收取蛋白,蛋白质印迹 (图7)结果显示经TGF-β1 刺 激 后,纤 连 蛋 白、α-SMA 和ERp57 的表达水平呈时间依赖性增加 (P值均<0.05)。同时,细胞爬片进行免疫荧光共染结果显示经TGF-β1刺激后,人原代成纤维细胞活化后ERp57的表达显著升高(图8)。综上表明,ERp5 7表达水平的升高可能与成纤维细胞的活化密切相关。
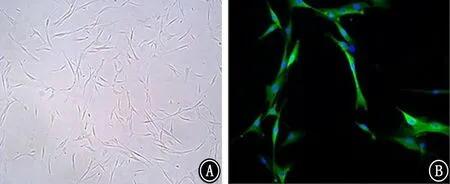
图6 成纤维细胞的鉴定分析 A:普通显微镜下的成纤维细胞 ×50;B:成纤维细胞的FSP1染色 ×200

图7 蛋白质印迹检测经TGF-β1 刺激后人肺原代成纤维细胞中fibronectin、ERp57 和α-SMA 的表达水平 A:电泳图;B:fibronectin蛋白相对表达;C:ERp57蛋白相对表达;D:α-SMA 蛋白相对表达

图8 免疫荧光染色检测成纤维细胞活化后ERp57的表达水平 ×400
2.4 干扰ERp57 的表达对成纤维细胞活化的影响 为进一步探究ERp57表达水平对成纤维细胞功能的影响,应用siRNA敲减ERp5 7的表达,蛋白质印迹结果 (图9)显示,经TGF-β1刺激后,抑制ERp57可显著降低纤连蛋白、胶原蛋白Ⅰ的表达水平 (P值均<0.05)。这些结果提示抑制ERp57的表达能抑制成纤维细胞的活化及细胞外基质的分泌。

图9 蛋白质印迹分析抑制ERP57表达水平后纤维化相关指标表达水平 A:电泳图;B:fibronectin相对表达;C:collagenⅠ相对表达
3 讨论
IPF作为一种发病机制不明,不可逆且致死率较高的难治性间质性肺疾病,常以肺泡结构破坏和肺间质纤维化为特征[1]。随着社会老龄化的快速进展,IPF的发病率呈上升趋势。尽管近年来人们为阐述IPF的发病机制投入大量精力研究,但对于其确切致病机制的了解仍非常不足,这严重阻碍了针对这种难治性疾病的新型有效疗法的发展。肺纤维化形成是由肺泡上皮细胞损伤所驱动,其反复损伤导致上皮细胞死亡和基底膜严重破坏,上皮修复难以完成,继而启动肺泡上皮细胞 “重编程”,呈现多种促纤维化表型,并分泌大量促纤维化因子,形成促纤维化微环境[14]。作为纤维化形成的主要效应细胞,成纤维细胞受到促纤维化微环境刺激后迁移聚集至损伤部位,并分化为肌成纤维细胞,产生大量细胞外基质蛋白进行组织重塑修复,导致肺组织正常结构的破坏和永久性瘢痕形成[15]。由此可见,成纤维细胞的活化、增殖和迁移对纤维化形成起着决定性作用。故研究其生物学特性和相关功能的调控机制是发现治疗IPF 疾病有效靶点的关键所在。本研究旨在进一步揭示成纤维细胞活化的调控机制,为IPF 的治疗提供潜在性药物治疗靶点。
既往研究表明内质网应激可通过影响多种细胞类型来参与肺纤维化发生发展。Borok 等[16]的研究揭示上皮祖细胞中内质网伴侣蛋白GRP78的缺失诱导上皮细胞衰老凋亡而促进纤维化的发生发展。此外,Lee等[17]研究揭示内质网蛋白二硫化物异构酶家族ERp46通过增强TGF-β信号传导促进肺纤维化,而目前对于ERp57在肺纤维化中的作用仍缺乏研究。本研究从临床水平和动物模型出发证实ERp57在IPF患者和BLM 诱导的小鼠肺组织中高表达,这与Kumar等[18]新近发表的结果一致,不同的是本研究关注到ERp57在肺成纤维细胞中处于高表达水平,提示ERp57影响肺纤维化的进展不仅仅依赖于Club细胞,也可能通过影响成纤维细胞的功能进而发挥作用。
鉴于成纤维细胞活化在纤维化的形成中起关键性作用,而TGF-β1已证实是影响成纤维细胞表型转变的关键因素[19],促使我们进一步探究ERp57与成纤维细胞活化的相关性。结果表明,在人肺原代成纤维细胞中,随着TGF-β1刺激时间的延长,ERp57和纤维化指标的表达水平呈逐渐升高。与此同时,经TGF-β1刺激后,敲减ERp57 可显著抑制纤维化相关指标的表达水平。以上结果揭示ERp57功能缺失可抑制成纤维细胞向肌成纤维细胞分化及细胞外基质的分泌,这可能与ERp57作为内质网应激伴侣蛋白,参与新合成蛋白的二硫键修饰有关[9]。
综上所述,本研究证实了IPF患者和BLM 诱导的小鼠纤维化肺组织均存在ERp57 的高表达,且在成纤维细胞中高表达;体外实验证实,敲减ERp57可抑制TGF-β1诱导的成纤维细胞活化。因此,本研究数据揭示ERp57 的表达水平可能与IPF疾病的发生发展密切相关,靶向抑制ERp57基因可能有助于治疗肺纤维化疾病。本研究的不足之处在于尚未进一步揭示ERp57影响成纤维细胞活化的分子机制以及ERp57缺失对BLM 诱导的小鼠肺纤维化的影响。总之,本研究工作为了解IPF的发病机制提供了新的启示与切入点,为开发IPF疾病治疗方案提供了潜在的靶点和坚实的科学理论基础。
利益冲突 所有作者均声明不存在利益冲突
——疾病防治的新靶标

