GHK-Cu螯合物通过减轻上皮细胞损伤对博来霉素诱导肺纤维化的保护性作用
王钰 马文会 周晓明 侯刚 王秋月
1中国医科大学附属第一医院呼吸与危重症医学科,沈阳 110001;2中国医科大学附属第四医院呼吸与危重症医学科,沈阳 110001;3中日友好医院呼吸与危重症医学科,北京 100020
特发性肺纤维化是一种原因不明的慢性进行性纤维化间质性肺疾病,表现为进行性呼吸困难和肺功能损伤,最终导致死亡[1]。迄今为止,特发性肺纤维化尚无治愈方法,因此在肺纤维化预防和治疗中发挥保护和治疗作用的新型药物的研究显得尤为重要。肺纤维化的发病机制包括炎症、上皮细胞损伤、上皮-间充质转化、细胞外基质降解和胶原沉积失衡、氧化应激等[2-4]。其中上皮损伤和功能障碍的肺泡上皮和相邻间充质之间的串扰导致组织修复途径的异常或持续激活。有研究表明肺上皮细胞损伤会导致一部分的自发性肺纤维化,肺上皮在驱动早期纤维化发病机制中起着重要作用[5]。另一方面,转化生长因子β1 (transforming growth factor-β1,TGF-β1)在促进肺纤维化中发挥关键作用。在激活上皮-间充质转化的细胞外细胞因子中,TGF-β1是促进肺泡上皮细胞上皮-间充质转化和成纤维细胞分化的主要诱导因子[6],也是参与肺纤维化发病机制的主要促纤维化细胞因子之一[7]。
甘氨酸-组氨酸-赖氨酸 (glycyl-L-histidyl-Llysine,GHK)是一种人血浆铜结合肽,GHK 在皮肤、毛囊、胃和肠内层、骨组织中有促进伤口愈合和组织再生的作用[8-9]。增加胶原蛋白、核心蛋白聚糖、血管生成和神经生长,具有抗氧化、抗炎、镇痛和抗焦虑的作用,并且能促进间充质干细胞分泌营养因子[10]。GHK 已被推荐为转移性癌症、COPD、炎症、急性肺损伤的治疗方法[11-12]。它对铜有很强的亲和力,很容易形成螯合物GHKCu,从而提高GHK 的生物利用度[13-14]。因此,本研究旨在探讨GHK-Cu 螯合物对博来霉素(bleomycin,BLM)诱导肺纤维化的保护作用,以及对TGF-β1 通路的作用机制,为临床研究提供参考。
1 材料与方法
1.1 主要材料与试剂 实验性研究。主要试剂:BLM 购自大连美伦生物科技有限公司,GHK-Cu(纯度>95%)购自上海强耀生物科技有限公司,E-cadherin 抗 体、α-平 滑 肌 肌 动 蛋 白 (alpha smooth muscle actin,α-SMA)抗体、β-actin购自美国Cell Signaling Technology 公 司,TGF-β1 抗体购自美国Abcam 公司,山羊抗兔IgG、山羊抗大鼠IgG 购自北京中杉金桥生物技术有限公司,TGF-β1酶 联 免 疫 吸 附 试 验 (enzyme linked immunosorbent assay,ELISA)试剂盒购自武汉云克隆科技股份有限公司;BCA 蛋白测定试剂盒、SDS-PAGE凝胶配置试剂盒、ECL 发光液购自上海碧云天生物技术有限公司,免疫组织化学试剂盒(鼠/兔)、DAB 显色试剂盒、Masson染色试剂盒购自福州迈新生物技术开发有限公司,HE 染色试剂盒购自大连美伦生物科技有限公司。
1.2 检测仪器 Leica轮转式自动脱水机,Carl Zeiss Microscopy Gmb H 生物显微镜,Axio-Observer A1生物显微镜,Infinite M200 Pro多功能酶标仪,DNR Bio-imaging system 凝胶成像仪。
1.3 方法
1.3.1 小鼠分组造模给药 选取健康雄性SPF级C57BL/6小鼠32只,体质量18~22 g,购自辽宁长生生物技术有限公司。随机分为4 组 (每组8只):(1)正常对照组;(2)BLM 组;(3)BLM+0.2μg·g-1·d-1GHK-Cu 组 (低剂量GHK-Cu组);(4)BLM+20μg·g-1·d-1GHK-Cu组 (高剂量GHK-Cu组)。将3 mg/kg BLM 注入50μl磷酸缓冲盐溶液中,通过气管灌注到小鼠中,以制备肺纤维化模型。正常对照组小鼠经气管灌注等体积的磷酸缓冲盐溶液。于造模后第4天开始进行腹膜内注射给药,使用磷酸缓冲盐溶液作为溶剂。在BLM+GHK-Cu治疗组中,隔天腹膜内注射给药1次;正常对照组小鼠腹膜内注射等体积的磷酸缓冲盐溶液。GHK-Cu 的选定剂量基于人体血浆中GHK 的浓度含量以及先前的研究。第21 天对小鼠实施安乐死。将部分左肺固定在4%多聚甲醛中,用于HE和Masson染色。收集部分右肺使用冷冻包埋剂固定,用于随后的免疫荧光染色。并将部分右肺保存于-80 ℃,用于随后的蛋白质印迹及ELISA。
1.3.2 HE染色 将肺组织用多聚甲醛固定24~48 h后流水冲洗6 h,脱水、包埋并切成4μm 切片,放入烤箱烘干。将切片先放置于二甲苯中脱蜡,然后依次放入无水乙醇、95%、90%、80%、70%、50%酒精中脱水,经过蒸馏水水化后分别将切片放入苏木素、盐酸酒精,伊红中进行染色,再经蒸馏水冲洗后入50%、70%、80%、90%酒精,无水乙醇,最后经二甲苯透明处理,取出后在载玻片中央滴入一滴中性树胶后用盖玻片封片,晾干后放在显微镜下进行观察。
1.3.3 Masson染色 将肺组织用多聚甲醛固定24~48 h后流水冲洗6 h,脱水、包埋并切成4μm切片,放入烤箱烘干。烤箱中烤6 h后将切片放置于二甲苯中脱蜡,然后依次放入无水乙醇、95%、90%、85%、75%酒精中脱水,经过蒸馏水水化后,分别用Masson 复合染色液、磷钼酸、苯胺蓝、分化液进行染色,再入75%、85%、90%、95%酒精、无水乙醇,最后经二甲苯透明处理,取出后在载玻片中央滴入一滴中性树胶后用盖玻片封片,晾干后放在显微镜下进行观察。
1.3.4 免疫组织化学染色 将肺组织用多聚甲醛固定24~28 h 后流水冲洗6 h,脱水、包埋成蜡块,并切成4μm 切片,放入烤箱烘干。烤箱中烤6 h后放置于二甲苯中脱蜡,然后依次放入无水乙醇、95%、90%、85%、75%酒精中脱水,经过蒸馏水水化后,应用柠檬酸盐缓冲液进行抗原修复,微薄修复30 min后,自然冷却至室温,根据说明书应用免疫组织化学试剂盒进行染色,应用DAB显色试剂盒进行显色,显微镜下实时观察。应用苏木素对细胞核进行染色。应用光学显微镜对切片观察。
1.3.5 蛋白质印迹 将收集的小鼠肺组织于冰上剪碎后加RIPA 裂解液,制成肺组织匀浆,使用BCA 蛋白测定试剂盒测定蛋白浓度。应用SDSPAGE凝胶对蛋白样品进行分离,将分离后的蛋白转移至PVDF膜上,用5%脱脂奶粉室温封闭2 h,分别用抗体4℃过夜。次日,山羊抗兔或抗大鼠的二抗室温孵育1 h。ECL 发光,应用Image J对所获得的条带进行分析。
1.3.6 ELISA 将收集的小鼠肺组织于冰上剪碎后加裂解液,制成肺组织匀浆。应用ELISA 试剂盒,严格按照说明书操作,采用双抗体夹心法。根据样品OD 值,由标准曲线算出所测样品浓度。
1.4 统计学分析 应用Graph Pad Prism 5软件进行统计分析。所有数据以±s表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠体质量的变化 与正常对照组相比,BLM 显著降低了小鼠的体质量。GHK-Cu预处理组可减轻小鼠的体质量的下降。见图1。

图1 GHK-Cu对博来霉素诱导纤维化小鼠体质量的影响
2.2 各组小鼠肺组织病理及肺损伤程度的改变观察各组小鼠肺组织的组织病理学变化 (图2),可见正常对照组肺泡组织结构完整,肺泡壁薄而透明,无明显炎症细胞浸润;BLM 组的肺泡结构被破坏,肺泡空间增大,严重变形增厚,肺泡壁增厚,肺泡骨架受损,呈现出扭曲的肺部结构,肺泡腔内可见炎性细胞和成纤维细胞浸润;在GHKCu预处理组中,随着炎症细胞的减少和肺泡结构的恢复,炎症改变被部分逆转。同时与正常对照组相比,BLM 组小鼠有明显的肺损伤,GHK-Cu预处理减轻了小鼠的肺损伤程度(图3)。依据Smith评分,GHK-Cu预处理组的肺组织纤维化评分较BLM 组明显减低(图4)。高、低2个剂量组相比较肺损伤程度不存在剂量依赖性。

图2 各组小鼠肺组织的组织病理学 A、E、I:正常对照组;B、F、J:博来霉素组;C、G、K:低剂量GHK-Cu组;D、H、L:高剂量GHK-Cu组 ×40 (A~D) ×100 (E~H) ×200 (I~L)

图4 各组小鼠肺组织纤维化评分
2.3 各组小鼠肺组织胶原蛋白沉积的改变 在BLM 组中,扭曲的肺部结构被Masson染色蓝染,而在正常对照组中,完整的肺部结构未呈现蓝色胶原蛋白染色。相比之下,GHK-Cu 预处理组小鼠的肺部Masson 染色切片显示,胶原蛋白沉积减弱,并伴有肺形态的部分恢复。见图5。

图5 各组小鼠肺组织胶原蛋白沉积的改变 A:正常对照组;B:博来霉素组;C:低剂量GHK-Cu组;D 高剂量GHK-Cu组Masson ×100
2.4 各组小鼠肺组织E-cadherin 和α-SMA 表达的比较 免疫组织化学染色结果显示,BLM 组上皮标志物E-cadherin与正常对照组相比明显减少,GHK-Cu预处理一定程度上减弱了上皮标志物Ecadherin的减少(图6)。蛋白质印迹结果 (图7)显示,对照组相比,BLM 组中上皮标志物Ecadherin表达下降,间充质标志物α-SMA 表达增加,GHK-Cu 的预处理可以增加E-cadherin 的表达同时减少α-SMA 的表达,这与E-cadherin免疫组织化学染色结果基本一致。GHK-Cu 的高、低剂量预处理组间不存在剂量依赖性。

图6 各组小鼠肺组织E-cadherin表达 A:正常对照组;B:博来霉素组;C:低剂量GHK-Cu组;D:高剂量GHK-Cu组 免疫组织化学染色 ×200

图7 蛋白质印迹检测各组小鼠肺组织中E-cadherin、α-SMA 的蛋白表达水平 A:电泳图;B:E-cadherin 蛋白相对表达;C:α-SMA蛋白相对表达
2.5 各组小鼠肺组织TGF-β1的比较 结果 (图8)显示BLM 组小鼠肺匀浆中TGF-β1的表达与正常对照组相比明显增高,GHK-Cu 预处理组小鼠TGF-β水平与BLM 组相比减低。同时通过蛋白质印迹方法检测结果 (图9)发现BLM 组小鼠肺组织中TGF-β1的蛋白表达明显增加,经过GHK-Cu预处理后TGF-β1的蛋白表达减少,这与ELISA得到的实验结果基本一致。但GHK-Cu高剂量组和低剂量组间不存在剂量依赖性。
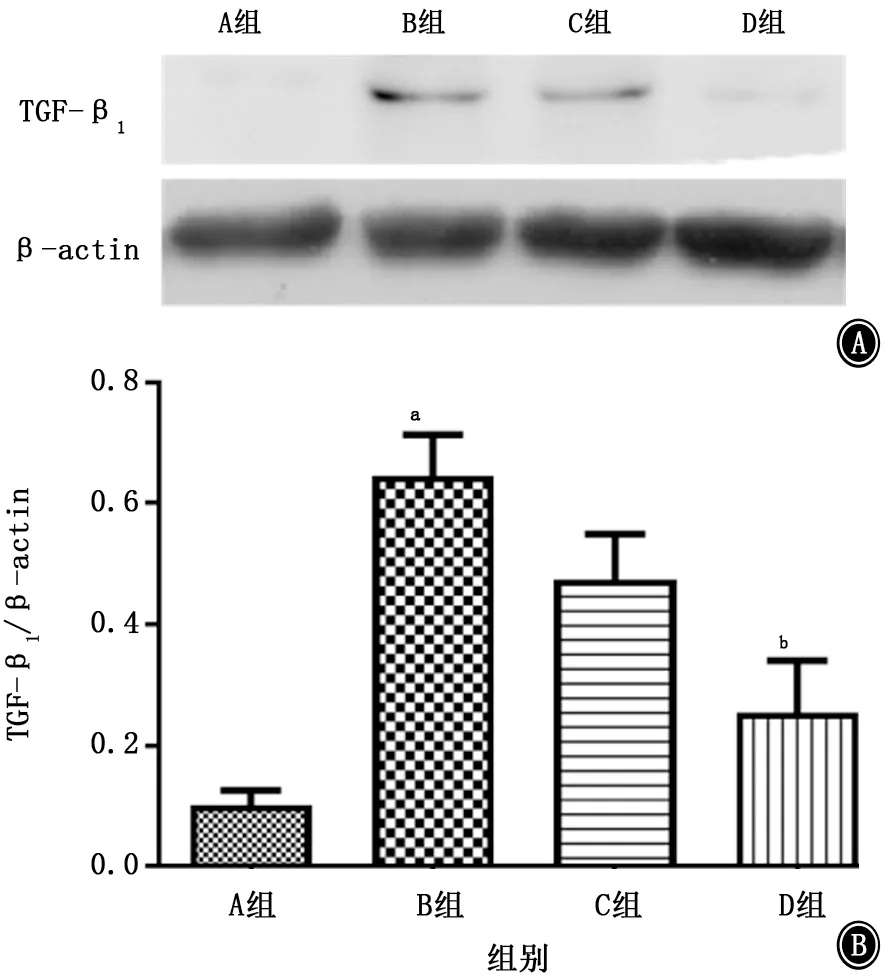
图8 蛋白质印迹检测各组小鼠肺组织中TGF-β1 的蛋白表达水平 A:电泳图;B:柱状图
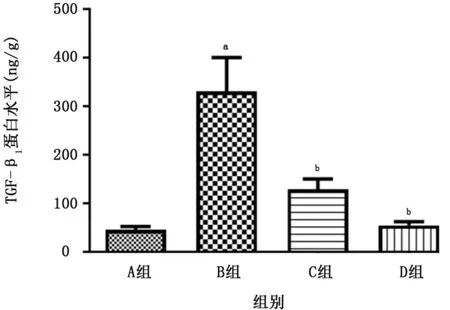
图9 酶联免疫吸附试验检测各组小鼠肺组织匀浆中TGF-β1的水平
3 讨论
特发性肺纤维化是一种肺部异常的纤维增生性肺疾病,导致肺泡变形,肺功能丧失,患者确诊后的病死率依旧居高不下[15],并且特发性肺纤维化的致病机制尚不清楚。用于治疗白血病和睾丸癌等多种癌症的BLM 已被广泛用于诱发动物肺纤维化,是评价候选药物抗纤维化作用最常用的小鼠模型[16-17]。本研究拟探索一种新的治疗方法,通过改善COPD 患者上皮-间充质转化现象来改善纤维化。
近年来,小分子肽在药物发现方面受到了广泛的关注。GHK 是人体血浆中的正常组分,存在于人体血浆、唾液和尿液中[18]。笔者前期研究中发现GHK 通 过TGF-β1和IGF-1 途 径 抑 制BLM 致肺纤维化进程、炎症反应[19]。GHK 螯合物GHKCu可以提高其生物利用度,加速再生过程,促进伤口愈合,增强其抗氧化和抗炎作用[20]。因此,笔者通过实验来研究GHK-Cu对BLM 诱导的肺纤维化的保护作用。研究结果证实通过给予GHKCu干预BLM 致肺纤维化小鼠,发现GHK-Cu可以减少肺泡结构破坏,减轻肺纤维化、肺损伤程度,并且可以减轻炎症程度。
在脂多糖诱导的急性肺损伤小鼠模型中,GHK-Cu 通过抑制急性肺损伤体内和体外NF-κBp65和p38 MAPK 信号传导,降低了活性氧的产生,增加了超氧化物歧化酶的活性,同时降低了TNF-α和IL-6的产生。此外,GHK-Cu减弱了脂多糖诱导的小鼠急性肺损伤的肺组织学改变,抑制了炎症细胞向肺实质的浸润。GHK-Cu 通过抑制过度的炎症反应而在脂多糖诱导的急性肺损伤中具有保护作用[21]。本研究给予GHK-Cu干预BLM致肺纤维化小鼠,观察上皮细胞标志物Ecadherin,实验数据表明GHK-Cu 可以增加Ecadherin的表达同时减少α-SMA 的表达,亦证实了GHK-Cu对肺上皮细胞的保护性作用。在大鼠肾小球肾炎模型中,GHK 已被证实可以改善纤维性组织损伤[22]。笔者前期的研究中也发现GHK可能通过IGF-1和TGF-β1 信号通路增加BLM 致肺纤维化中的E-cadherin 及减少α-SMA 的表达[19]。研究表明,GHK-Cu可能是通过提供铜来提高GHK 抗氧化酶水平和超氧化物歧化酶的活性[23]。另一方面GHK-Cu还可以与铁释放的铁蛋白通道结合,在物理上阻止铁的释放。从而抑制受损组织中的铁蛋白释放,减轻炎症和预防微生物感染,因此GHK-Cu在创伤中显示出更强的抗氧化的功能[24]。与其他的研究结果一致,笔者发现GHK-Cu的治疗能显著抑制BLM 诱导的慢性肺炎症和纤维化,并增加BLM 致肺纤维化中的Ecadherin及减少α-SMA 的表达。并且这些改变程度与GHK-Cu剂量不相关。笔者所在团队首次将GHK-Cu作为抗纤维化治疗药物应用于BLM 致小鼠肺纤维化的研究中,实验证明了GHK-Cu对肺纤维化的保护作用,并为GHK-Cu对纤维化疾病的潜在治疗作用提供了新的证据。
许多研究表明,根据细胞环境的不同,TGF-β1通路在创面愈合和器官纤维化中发挥重要作用[25-26]。TGF-β1信号是特发性肺纤维化中细胞外基质过量产生、沉积、成纤维细胞增殖和向肌成纤维细胞分化的主要诱导因子。有研究发现,用GHK 处理COPD 患者的成纤维细胞可以减少TGF-β1的产生[12]。本研究显示气管灌注BLM 21 d后肺组织中TGF-β1的蛋白水平显著提高,GHK-Cu的治疗可以减少TGF-β1 的表达。与先前的研究结果一致,GHK-Cu对TGF-β1的表达有抑制作用。GHK-Cu对肺组织中TGF-β1 蛋白水平的影响与其对肺组织病理改变的影响是一致的。这些发现表明,GHK-Cu可以通过TGF-β1途径减轻肺上皮细胞损伤,从而减少上皮细胞向产生胶原的肌成纤维细胞转变。本研究首次揭示了GHK-Cu可能通过影响TGF-β1信号通路来预防肺纤维化。
综上所述,GHK-Cu螯合物可以减轻BLM 诱导的小鼠肺组织纤维化,能减轻肺部损伤及炎症浸润、胶原沉积及肺上皮细胞损伤,这一作用可能与抑制TGF-β1信号通路相关。提示GHK-Cu 螯合物对BLM 诱导的小鼠肺纤维化具有保护作用。
利益冲突 所有作者均声明不存在利益冲突

