杀鱼爱德华氏菌双组分调控系统研究进展
金梦如,胡永华,孙冬梅
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.中国热带农业科学院生物技术研究所)
1 杀鱼爱德华氏菌
1.1 杀鱼爱德华氏菌简介
杀鱼爱德华氏菌(Edwardsiella piscicida),之前又称迟缓爱德华氏菌(Edwardsiella tarda),属于革兰氏阴性致病菌,其分类地位归属于变形菌门、γ-变形菌纲、肠杆菌目、肠杆菌科、爱德华菌属。该菌最初从日本鳗鲡中分离到,之后从一些爬行动物和哺乳动物中分离到。1965 年,Ewing 等[1]将这类细菌命名为迟缓爱德华氏菌。2013 年,Abayneh 等[2]通过表型和遗传特征分析发现从病鱼分离的爱德华氏菌不属于迟缓爱德华氏菌或同属的其他种,将其重新命名为杀鱼爱德华氏菌,其模式菌株为ET883T。随后Shao等[3]发现从患病鳗鲡中分离到的爱德华氏菌株并不能归为杀鱼爱德华氏菌,而是一个新种,命名为鳗爱德华氏菌(Edwardsiella anguillarum),模式菌株为ET080813T。至此,爱德华氏菌属分为5 个种,杀鱼爱德华氏菌、鳗爱德华氏菌、迟缓爱德华氏菌、鲶爱德华氏菌(Edwardsiella ictaluri)和保科爱德华氏菌(Edwardsiella hoshinae)[3]。在所有爱德华氏菌属中,杀鱼爱德华氏菌是研究的最多也是最深入的一个致病菌,并已成为研究肠道、细胞内病原菌、系统性感染等方面的模式菌株。
杀鱼爱德华氏菌可以感染大菱鲆、牙鲆、罗非鱼、鳜鱼、中华鳖等多种重要经济水产动物。近年来,研究人员从患病石斑鱼和斑鲈鱼中分离到了该菌[4],表明其侵染对象在不断扩大。杀鱼爱德华氏菌感染后常会引起鱼类的腹水病以及肝、肠、肾坏死等病症,这些病症被统称为爱德华氏菌病(Edwardsiellosis)。爱德华氏菌病在亚洲、欧洲、美洲和非洲等地范围内均有发生,对养殖业造成了巨大损失[3]。
1.2 杀鱼爱德华氏菌的毒力因子
杀鱼爱德华氏菌的致病机制复杂,有多种毒力因子参与。病原菌从外界入侵到宿主期间既要应对外界如铁缺乏、氧化胁迫等逆境又要抵御宿主体内的免疫防御系统等。在入侵宿主时,病原菌首先是利用周生鞭毛和粘附因子等开始附着和黏附;随后在溶血素、侵袭素等辅助蛋白的协助下入侵宿主。特定情况下该菌可以侵染到宿主较深部位,从而被吞噬细胞吞噬,而被吞噬的杀鱼爱德华氏菌可以在吞噬细胞内生存和繁殖,以此躲避免疫系统的杀伤,这是该菌的一个典型特征[5];进入宿主后细菌开始在宿主内定植和繁殖,这一过程T3SS 和T6SS 发挥主要作用,研究的也相对深入[6];在宿主内到达一定数量后,杀鱼爱德华氏菌可扩散到更深的位置,即血液和淋巴[6],杀鱼爱德华氏菌具有显著的抗宿主血清杀菌能力,这是该菌的另一个典型特征。已有多个具有逃逸血清杀伤作用的因子被发现,包括Sip 1、Ivy、MliC 以及HigB 等[7-8]。
近年来,在杀鱼爱德华氏菌致病机制研究中又有诸多新发现,例如揭示了一种由c-di-GMP 介导的新型非典型铁死亡(ferroptosis)途径,并发现该途径具有调节致病性的功能[9];发现硫氧还蛋白与细菌致病性密切相关,并抑制宿主ASK1-MAPKs 信号通路而促进感染[10];发现T6SS 中,除EvpP 效应因子外,又鉴定到一个新的EvpQ 效应因子[11];发现抗酸系统CadBA 贡献于细菌的致病性[12];新鉴定到Ⅱ型毒素-抗毒素系统并发现其参与了细菌耐药性、生物膜形成、抵抗血清杀伤和感染宿主等过程[7];发现氨基酸代谢等多种途径都与杀鱼爱德华氏菌的抗逆性和致病性密不可分[13];以及新鉴定到的多个与毒力相关的调控因子包括FabR、EvrA 等[14-15]。
2 杀鱼爱德华氏菌双组分调控系统
双组分调控系统(two-component regulatory system,TCS)广泛存在于各种原核生物中,能快速响应不同外界环境并转换为输入信号,使细菌能够迅速处理不利或有利的新情况。该系统一般包括两个基本组分:位于细胞内膜上的组氨酸激酶(Histidine kinase,HK)和位于细胞质的应答调节蛋白(Response regulator,RR)。其中,HK 含有信号感应区,并将信号输入至RR。双组分系统在细菌众多信号调控系统中处于非常重要的中心地位,对细菌生命活动发挥着至关重要的调控作用。它们已被证明可以在许多过程中发挥调节作用,例如毒力、群体感应、生物膜形成和抗生素耐药性等[16]。其作用可使病原菌有效地适应各种外界环境并对宿主发挥毒力。大肠杆菌(Escherichia coli)中的双组分调控系统众多,已证明TCS可参与细菌耐药性、磷酸盐调控以及致病性等多种作用[17],其中OmpR 和PhoB 被广泛研究。在杀鱼爱德华氏菌中共发现24 种TCS[2]。目前,仅有5 种TCS被研究,其中研究最深入的是EsrA-EsrB 系统。
2.1 EsrA-EsrB 双组分系统
EsrA-EsrB 系统是由T3SS 基因簇编码的,其中EsrA 是组氨酸激酶,EsrB 是调控因子,受EsrA 激活。EsrA-EsrB 系统与沙门氏菌中(Salmonella)SPI-2编码的SsrA-SsrB 系统同源[18]。在肠道沙门氏菌(Salmonella enterica)中,SsrA-SsrB 系统不仅调节Ⅲ型分泌系统等毒力相关因子的表达[19],还与细菌鞭毛形成、生物膜形成、抗酸性等重要生理性能密切相关,是沙门氏菌重要的毒力调节系统[20]。在鲶爱德华氏菌中也存在与SsrA-SsrB 同源的EsrA-EsrB 毒力调控系统[21]。
研究发现,EsrA-EsrB 系统可促进杀鱼爱德华氏菌在逆境下生存,如低温海水、铁缺乏、氧化压力以及酸性压力等。EsrB 在调控细菌生理反应方面起着重要的作用[22]。并且在杀鱼爱德华氏菌中,EsrB 被认为是全局调控因子,以及大量的研究表明EsrA-EsrB最重要的作用是对杀鱼爱德华氏菌毒力的调控,因为EsrA-EsrB 可以调控杀鱼爱德华氏菌毒力Ⅲ型分泌系统和VI 型分泌系统(T3SS 和T6SS)的表达以及相关蛋白分泌[22]。此外,有研究表明EsrA-EsrB 系统受到了PhoQ-PhoP 双组分系统的调控[23]。
2.2 PhoQ-PhoP 双组分系统
肠杆菌科细菌的PhoQ-PhoP 双组分系统主要感知环境变化并积极作出响应,调节细菌生存所必需的一些功能,其中PhoQ 是组氨酸激酶,PhoP 是反应调节因子[24]。鼠伤寒沙门氏菌(Salmonella typhimurium)中,PhoQ-PhoP 负责响应周质Mg2+浓度变化,同时也是该菌中重要的毒力调控因子[25]。大肠杆菌中,PhoQ-PhoP 可以感知Mg2+浓度、低pH 值、阳离子抗菌肽的存在以及高渗透压等逆境条件[26]。杀鱼爱德华氏菌中,PhoQ-PhoP 同样可以快速感知不同酸碱pH、温度变化、低Mg2+浓度、毒素以及抗菌肽的胁迫环境并进行相应的响应以使细菌适应逆境[27]。例如,phoP 或phoQ 的敲除均减弱了杀鱼爱德华氏菌的抗氧化压力能力、生物膜形成能力以及对斑点叉尾鮰的致病性[24];Lv 等[23]认为PhoQ-PhoP 也是杀鱼爱德华氏菌中重要的毒力调节因子之一。
2.3 其他双组分系统
除了上述2 个双组分系统外,QseC-QseB、PhoR-PhoB 和Cpx 双组分系统在杀鱼爱德华氏菌中也有研究报道。其中QseC-QseB 双组分系统膜传感器激酶QseC 可将QseB 磷酸化而使后者激活并发挥调控作用。在大肠杆菌中QseB-QseC 信号通路调控50多个编码鞭毛蛋白和毒力相关蛋白的基因表达[28]。当杀鱼爱德华氏菌入侵宿主后,QseB-QseC 能响应宿主体内肾上腺素浓度的变化并做出反应,调控相关基因的表达从而影响细菌鞭毛的产生、对宿主的入侵以及在体内的定植等[29]。
PhoR-PhoB 双组分系统参与细菌磷酸盐调控。PhoB 包含接收区和效应区,组氨酸激酶PhoR 可使受体区域磷酸化,引起PhoB 全长蛋白的构象变化,从而促进DNA 的结合和转录。铜绿假单胞菌(Pseudomonas aeruginosa)中,在磷酸盐消耗条件下调控因子PhoB 激活部分相关基因以响应磷酸盐变化[30]。杀鱼爱德华氏菌中的PhoR-PhoB 也具有响应磷酸盐浓度的功能[31]。
CpxRA 双组分系统是细菌重要的包膜应激感应系统,由锚定在内膜上的组氨酸激酶CpxA 和胞内的调控蛋白CpxR 组成。CpxA 是这一系统的关键成分,通常由两个跨膜结构域、一个周质感受域和一个胞质传输域组成。已有的研究表明CpxA 同时具有磷酸激酶和磷酸酶活性[32]。CpxR 被CpxA 磷酸化后,以5'-GTAAA(n5)GTAAA-3'作为其共有识别序列与启动子区域结合调控靶基因的表达。此外,位于CpxRA下游的CpxP,是一种周质辅助蛋白,可以负反馈调节CpxRA,被认为是CpxRA 系统的第三个成分[32]。研究发现CpxRA 系统激活Ysc-Yop Ⅲ型分泌系统及其效应因子YopS,以调控假结核耶尔森菌(Yersinia pseudotuberculosis)对宿主细胞的粘附、入侵和抵抗淋巴细胞的吞噬能力[33]。杀鱼爱德华氏菌中失活CpxRA 对蓝曼龙的毒力显著减弱[34]。
3 双组分系统的调控作用与机制
3.1 响应环境应激的调控
为了能够在外界环境和宿主中存活,细菌必须要克服各种不利的外部环境条件,包括抗生素、渗透压、氧化压力、酸碱胁迫等。在杀鱼爱德华氏菌中,当phoP 敲除后细菌对克林霉素、多粘菌素B 和多粘菌素硫酸盐三种抗生素敏感性显著增加,多粘菌素B和多粘菌素硫酸盐属于阳离子抗菌肽;进一步检测发现phoP 的缺失导致病原菌对多种抗菌肽的敏感性都显著增加[23]。随后,Lv 等[35]发现PhoP 通过激活ugd 的表达发挥抗菌肽的作用。此外还发现,杀鱼爱德华氏菌phoQ 或phoP 的缺失导致细菌在过氧化氢条件下的存活能力显著降低,在酸性条件下细菌的生长略有降低[24]。这些结果表明,PhoQ-PhoP 双组份系统参与了杀鱼爱德华氏菌的抗逆作用。对PhoRPhoB 系统研究发现其可以通过调控phoU 以适应磷酸盐环境,由于phoB 具有自身启动子,能够激活磷酸盐转运系统pstSCAB-phoU,帮助病原菌在黏附和侵染到胞内后适应宿主环境中的低磷酸盐浓度,以便病原菌更好的在宿主体内定植[31]。
3.2 对T3SS/T6SS 的调控
T3SS/T6SS 分泌系统是杀鱼爱德华氏菌最重要的毒力系统,在细菌抗逆性、生物膜形成、入侵细胞、胞内定植、抑制宿主免疫防御等方面发挥重要作用,并且其表达受到双组份系统的调控(如图1)[29,36]。多项研究证实杀鱼爱德华氏菌T3SS/T6SS 受到了EsrA-EsrB 等系统的严格调控[22,37-39]。研究表明,EsrB 激活T3SS 和T6SS 系统,调控两个系统胞外蛋白的分泌[22]。Lv 等[23]发现当esrB 缺失后,杀鱼爱德华氏菌分泌蛋白中几乎检测不到T3SS 中的EseB 蛋白和T6SS中的EvpC 蛋白,以及phoP 缺失也在一定程度上降低了EseB 蛋白和EvpC 蛋白的分泌,但PhoP 对其不是直接调控,而是通过调节EsrB 对T3SS 和T6SS 部分基因的表达进行调控。Chakraborty 等[31]发现PhoB通过与PhoU 相互作用激活EsrC 从而调控T6SS 基因的表达。此外,Wang 等[29]发现当杀鱼爱德华氏菌入侵宿主后,qseC/qseB 以及T3SS 部分基因表达都有所上调,且qseC/qseB 突变后T3SS 部分基因下调明显,表明QseC-QseB 也对T3SS 具有调控作用。T3SS和T6SS 系统或许还受其他双组份系统的调控,这有待于后续研究的继续和深入。
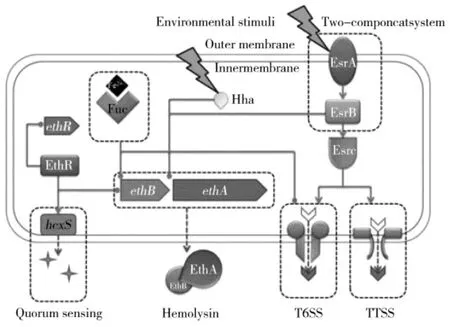
图1 双组分系统参与的对T3SS/T6SS 系统及溶血素等因子的调控作用Fig.1 Regulation of T3SS/T6SS system and factors such as hemolysin by two-component system
3.3 对其他毒力因子的调控
宿主在应对病原菌感染时,会激发自身免疫应答反应,例如血清杀伤、巨噬细胞吞噬并释放活性氧、免疫相关因子等以消灭入侵的病原菌,而病原菌为了应对宿主的免疫反应和体内不利的逆境条件,需要充分发挥其抗逆性和毒力系统,包括黏附能力、运动能力、生物被膜形成能力、抗酸能力、抗氧化能力以及毒力相关因子等,病原菌的这些生理性能和毒力系统等往往受到双组份系统的调控。对杀鱼爱德华氏菌33 个反应调节基因分析发现,相比于野生株,esrB 缺失株和phoP 缺失株生长缓慢且细胞密度较低,esrB 缺失株的生物膜形成能力以及感染能力显著降低;进一步构建esrB-phoP 双敲株发现双敲株比单敲株的毒力明显降低,这表明EsrA-EsrB 和PhoQ-PhoP 既可以独立发挥作用,又可以相互作用[23]。phoQ 缺失或phoP 缺失导致杀鱼爱德华氏菌生物被膜形成能力、抗血清杀伤能力以及对宿主的侵染能力均显著降低[24]。研究发现EsrA-EsrB 系统对EthA具有负调控作用(图1)[29],并且发现在esrB 缺失株中ethA 的表达还受到温度的影响,在37 ℃时ethA 表达量显著高于25 ℃时的表达量[22]。对QseC-QseB 系统研究发现,qseC 或qseB 缺失明显降低了杀鱼爱德华氏菌的运动能力以及鞭毛相关基因的表达,减弱了杀鱼爱德华氏菌对斑马鱼的致死率,表明该系统在调控鞭毛基因和毒力方面发挥着作用[29]。此外,cpxR 以及Cpx 的缺失都会使病原菌的毒力降低[40]。已有的研究结果表明,双组分系统在多个方面参与了对杀鱼爱德华氏菌毒力的调控。
3.4 对其他途径的调控
T3SS/T6SS 蛋白的分泌与温度和Mg2+浓度有关。据报道,Mg2+的浓度对T3SS/T6SS 蛋白的分泌有一定影响。研究表明,PhoQ-PhoP 系统可以感应温度和Mg2+浓度的变化,PhoQ 在Mg2+浓度低的时候将磷酸信号传递到PhoP,调节因子PhoP 将所感知的外界环境条件传递给EsrA-EsrB 双组分系统,进而调节T3SS/T6SS 蛋白的表达,而在Mg2+浓度高时,PhoQ 可以与Mg2+结合,结构随之发生改变从而无法传递磷酸化信号[22]。此外,PhoP 正向调控9 个ATP 合酶基因的转录,并且通过与atpI 的启动子直接结合发挥这一作用[41]。
谷氨酰胺合成酶(Glutamine synthetase,GS)在谷氨酸转化为谷氨酰胺过程中起着至关重要的作用,还参与微生物多种调节机制和伴侣活动。杀鱼爱德华氏菌GS 包括GlnA、GlnR、GlnL 和GlnG,其中GlnA 是GS 的重要组成部分[18]。蛋白质组学分析发现,ΔesrB 与野生株之间有19 个表达点存在显著差异,其中7 个蛋白质在ΔesrB 中表达下调,12 个蛋白质表达上调并且有3 个与氨基酸转运和代谢有关的GS。随后验证发现EsrB 可以与glnA 启动子结合,并且对GlnA 的表达具有负调控作用[38]。此外,EsrB 还调控抗氧化相关蛋白如超氧化物歧化酶和巯基过氧化物酶[42],其他相关研究也证实EsrB 对抵抗ROS 的相关基因具有抑制作用[37]。
4 双组分系统受调控作用
4.1 EsrA-EsrB 受到的正调控
最近研究表明,EsrA-EsrB 发挥毒力调控作用时受多因素影响,一些基因可以正向调控esrB。例如Shao 等[14]的研究发现,FabR 在感应长链不饱和脂肪酸时可以与esrB 的启动子结合激活esrB,从而调控T3SS 的表达,以响应长链不饱和脂肪酸浓度的变化。此外,另一项研究表明,EvrA 作为一种转录激活因子,可以与甘露糖-6-磷酸结合并激活esrB 的表达,从而导致T3SS/T6SS 表达增加(如图2)[15]。
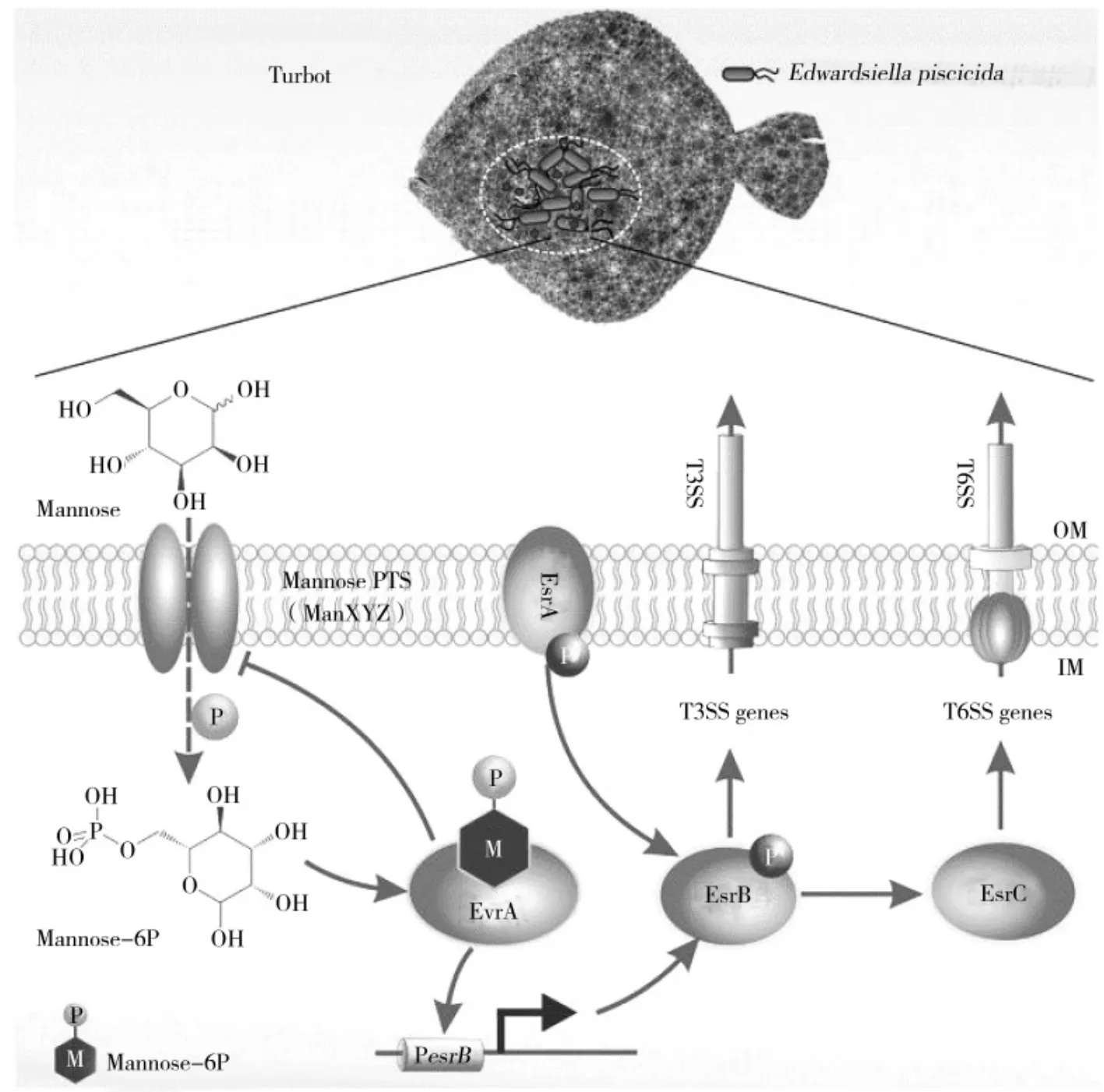
图2 杀鱼爱德华氏菌甘露糖激活esrB 调控毒力基因Fig.2 esrB regulation of virulence genes by mannose activation in E.piscicida
4.2 EsrA-EsrB 受到的负调控
EsrA-EsrB 除受到正调控外,还会受到其他基因的负调控。例如,RpoS 可以拮抗esrB 的表达从而抑制T3SS/T6SS,导致细菌毒力减弱[43];Yin 等[37]发现在细菌早期生长时PepA 对esrB 发挥负调控作用。以及另一项研究表明MviN 对esrB 在细菌生长前期和后期有着不同的调控作用,通过加入蔗糖的培养基进行试验,发现MivN 在病原菌生长前期可以激活EsrB的表达,生长后期又可以抑制EsrB 的表达[44];Ye 等[45]发现在ΔuhpA 中esrB 表达上调,说明UhpA 可以抑制esrB 的表达;Ma 等[46]证实EnrR 可以结合并抑制esrB 的启动子活性。此外,在铁存在的情况下,Fur 能结合esrB 启动子并抑制其表达最终使细菌毒力减弱;相反,在缺铁情况下,EsrB 能够激活T3SS/T6SS和铁吸收系统。表明Fur-EsrB 的相互作用是杀鱼爱德华氏菌适应宿主体内环境和海水环境所必需的[39]。
研究表明,EsrB 在作为全局调控因子的同时也受到了其上游基因的调控。
5 结语
双组分调控系统不但可以帮助病原菌适应外界环境变化,而且在病原菌毒力作用方面发挥着重要的调控功能。近年来,随着分子生物学的不断快速发展,对于杀鱼爱德华氏菌的研究越来越多,更多的双组分系统也随之被发现,逐渐成为了杀鱼爱德华氏菌中的研究热点。但双组分调控系统在杀鱼爱德华氏菌致病机制中的研究还不够全面、透彻,目前有效的病原菌防治方法多为抗生素治疗法,而长期的药物残留会引发许多问题,因此应探寻更安全、有效的防治措施,这需要对病原菌发挥毒力的机制进行更全面的了解、更深入的研究。为此,深入掌握双组分系统的作用机制以及更多发挥作用的双组分系统是目前十分必要的,可以为更好地防治杀鱼爱德华氏菌引起的病害提供理论基础。

