基于Nrf2/HO-1通路探讨健骨颗粒含药血清对氧化应激状态成骨细胞骨形成的调控机制
周 芬,孙 攀,黄云梅,王志强,林燕萍*
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.福建省中西医结合老年性疾病重点实验室,福建 福州 350122;3.上海中医药大学附属市中医医院,上海 200071)
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)属于中医“骨痿”“骨枯”“骨极”等范畴,是绝经后妇女以低骨量和骨组织细微结构退变为特征,并导致骨强度降低、骨脆性增加、易于骨折的全身代谢性疾病。由于PMOP 导致的病理性骨折及其并发症有较高致残率和致死率[1-2],严重威胁着中老年女性的身心健康,且给家庭和社会带来沉重的经济和医疗负担[3]。该病由于具体发病机制不甚明确,临床疗效也不佳,已成为世界性健康难题。
国内外研究发现氧化应激和骨质疏松症密切相关,影响本病的发生与发展[4-6]。氧化应激是指由机体代谢过程中产生的活性氧(ROS),其包含超氧化物阴离子、过氧化物和羟基自由基等过度累积,超过机体抗氧化防御系统的清除能力,从而引起组织和细胞损伤的病理现象[7]。氧化应激状态下,ROS 激活Nrf2 使其磷酸化,进入细胞核内启动血红素氧合酶(HO-1)的转录,而HO-1 能有效阻止机体氧化应激反应,故Nrf2/HO-1 通路是机体抗氧化应激的重要途径,是机体抗氧化系统的重要组成部分[8]。氧化应激可调节成骨特异性转录因子2(RUNX2)的表达,降低成骨细胞活性[9]。由此可知,氧化应激与骨形成存在着密切联系,氧化应激对骨形成的抑制作用是PMOP 发生的一个重要因素。本课题组前期研究结果显示健骨颗粒对成骨细胞骨形成有较好的促进作用,证实健骨颗粒能够有效防治PMOP[10-11]。由于氧化应激是PMOP 的主要原因之一,然而健骨颗粒的治疗作用与抗氧化应激是否相关尚不明确,因此设计本实验探讨健骨颗粒能否通过Nrf2/HO-1 信号通路调节成骨细胞氧化应激状态,促进骨形成。
1 实验材料与仪器
1.1 实验动物 12 周龄SPF 级雄性SD 大鼠40 只,体质量(200±20)g,购自浙江省医学科学院,实验动物生产许可证:SCXK(浙)2019-0002。饲养于福建中医药大学实验动物中心SPF 级实验室,实验动物使用许可证:SYXK(闽)2019-0007。本研究实验方法和实验动物处理方法已通过福建中医药大学动物伦理委员会审核(审批号:〔2018〕福中医伦理审字第(038)号),符合动物实验伦理要求。
1.2 实验细胞 UMR-106 成骨样细胞株购自中国科学院典型培养物保藏委员会细胞库(目录号:TCR11)。
1.3 实验药材 健骨颗粒由煅狗骨、山茱萸、党参、山药等药物组成,均购自福建同春药业股份有限公司,由福建省中医药科学院中试车间依照课题组制剂工艺标准煎煮浓缩,制备成健骨颗粒浸膏,置于-20 ℃冰箱保存。
1.4 实验试剂 胎牛血清(美国Sigma 公司,货号:F8687);青链霉素(货号:SV30010)、高糖DMEM培养基(货号:SH30022.01B)、PBS 缓冲液(货号:SH30256.01B)均购自新西兰Hyclone 公司;Nrf2(货号:16396-1-AP)、HO-1(货号:10701-1-AP)、β-actin 抗体(货号:66009-1-Ig)、兔二抗(货号:SA00001-2)、鼠二抗(货号:SA00001-1)均购自美国Proteintech 公司;Western 封闭液(货号:P0023B)、Western 一抗稀释液(货号:P0023A)、BCA 蛋白浓度测定试剂盒(货号:P0012)、超氧化物阴离子荧光探针(DHE,货号:S0063)、DAPI 染色液(货号:C1006)均购自上海碧云天生物技术有限公司;甘氨酸(货号:1275GR500)、茜素红染色液(货号:RASMX-90021)均购自广州赛业生物科技有限公司;30%过氧化氢(货号:3004003-01-03)、甲醇(货号:1030038-01-01)均购自西陇科学股份有限公司。
1.5 实验器材 CO2培养箱、-80 ℃超低温冰箱均购自美国Thermo Fisher 公司;低温高速离心机、移液器均购自德国Eppendorf公司;恒温水浴锅、DHG-9070A 烘箱均购自上海精宏实验设备有限公司;小型垂直电泳、小型Trans-Blot 转印槽均购自美国Bio-Rad 公司;DFC295 倒置显微镜、DFC425 荧光显微镜均购自德国Leica 公司。
2 实验方法
2.1 健骨颗粒含药血清和生理盐水血清制备 6 周龄SPF 级雄性SD 大鼠40 只,适应性喂养1 周后随机分为健骨颗粒组和生理盐水组,每组20 只。健骨颗粒组给药剂量根据人与动物间体表面积折算的等效剂量系数换算,健骨颗粒组每天灌服含生药量7.8 g/kg 健骨颗粒浸膏稀释液2 mL,生理盐水组每天灌服生理盐水2 mL,2 组每日灌胃1 次,连续灌胃7 d。第7 天在灌胃1 h 后腹主动脉取血,静置4 h后以3 000 r/min 离心15 min,分离上清,56 ℃水浴30 min 灭活补体,过滤除菌后分装,置于-80 ℃冰箱保存。健骨颗粒组提取的血清即为健骨颗粒含药血清,生理盐水组提取的血清即为生理盐水血清。
2.2 UMR-106 细胞复苏与传代 从-80 ℃冰箱中取出冻存的UMR-106 细胞,迅速置于37 ℃恒温水浴锅中,融化后加入1 mL 完全培养液,轻轻吹打,转移至15 mL 离心管中;再加入5 mL 完全培养基,以1 000 r/min 离心3 min,弃上清,加入1 mL 完全培养基,轻轻吹打使细胞悬起,转移至细胞培养瓶中;再加入4 mL 完全培养基,“8”字法摇匀后置于37 ℃、5% CO2细胞培养箱中培养。待细胞密度为80%时进行传代,弃去培养瓶中培养基,加入2 mL PBS,清洗2 次;然后向瓶中加入1 mL 含EDTA 胰蛋白酶,37 ℃消化1 min,向瓶中加入1 mL 完全培养液终止消化,轻轻吹下细胞,转移至15 mL 离心管中,以1 000 r/min 离心3 min,弃上清;加入1 mL 完全培养液,轻轻吹打制成均匀的细胞悬液,向2 个培养瓶中各加入500 μL 细胞悬液,并加入4.5 mL完全培养基,混匀后置入细胞培养箱中。
2.3 实验分组与干预 将课题组前期构建的Nrf2敲减稳定的UMR-106 细胞株和Nrf2 阴性对照细胞[12],分别分为Nrf2-KD+JG 组、Nrf2-KD+NS 组和NC+JG 组、NC+NS 组。种皿后待细胞汇合至皿底80%面积,使用无血清培养基饥饿12 h 后,Nrf2-KD+JG 组和NC+JG 组分别采用10%健骨颗粒含药血清[10]加高糖DMEM 培养12 h,Nrf2-KD+NS 组和NC+NS 组分别采用10%生理盐水血清加高糖DMEM 培养12 h,再用10 μmol/L 过氧化氢干预12 h[12]。
2.4 观察指标
2.4.1 DHE 检测4 组超氧化物阴离子水平 将处于对数生长期的UMR-106 细胞消化重悬,按照1×105个/mL 接种于20 mm2共聚焦培养皿,按照“2.3”项下方法分组并干预4 组细胞。干预后弃上清,PBS洗净皿内残余培养液,每皿加500 μL 4%多聚甲醛固定细胞30 min,用PBS将DHE稀释为2 μmol/L;每皿加入1 mL DHE,37 ℃孵育30 min,孵育完毕弃去皿内液体,PBS 洗皿5 min×3 次;再向皿内加入500 μL DAPI 染色液,37 ℃孵育5 min,PBS 洗皿5 min×3 次;双转盘激光共聚焦显微镜下观察并拍照,561 nm 波长下观察DHE 红色荧光,即细胞内超氧化物阴离子,488 nm 波长观察DAPI 蓝色荧光,即细胞核,ImageJ 软件分析红色荧光面积占蓝色荧光面积的百分比,即相对荧光强度。
2.4.2 茜素红染色观察4 组矿化结节数量 将4 组细胞按照“2.3”项下方法干预后再更换完全培养基,连续培养2 周。期间观察细胞生长情况,隔天换液1 次,2 周后弃去培养基,PBS 洗2 遍后每孔加1 mL 4%多聚甲醛固定细胞30 min;再PBS 洗2 遍后每孔加入1 mL 茜素红染色液,染5 min 后弃去茜素红染色液;再用PBS 冲洗3 次,于显微镜汞灯蓝光下观察矿化结节数量。
2.4.3 Western blot 法检测4 组Nrf2、核Nrf2、HO-1及RUNX2 蛋白相对表达量 4 组细胞按照“2.3”项下方法干预后弃液,PBS 洗净。① 细胞总蛋白提取:每皿加入100 μL 蛋白裂解液(RIPA∶PMSF∶磷酸酶抑制剂=100∶1∶1),冰上裂解30 min,用细胞刮刀将裂解好的细胞轻轻刮下,转移至EP 管中,移至离心机中以12 000 r/min、4 ℃离心20 min,分离上清即为细胞总蛋白;② 细胞核蛋白提取:按照说明书配置Hypotonic Buffer(1 mL 加入5 μL 磷酸酶抑制剂和10 μL PMSF)和Lysis Buffer(1 mL加入5 μL磷酸酶抑制剂和10 μL PMSF)备用。PBS 洗净皿内残余培养液,向皿内加入450 μL 配置好的Hypotonic Buffer,冰上裂解10 min;用细胞刮刀将裂解好的细胞轻轻刮下移至EP 管,震荡管壁使沉淀悬起,冰浴10 min,震荡10 s,混匀,以3 000 r/min,4 ℃离心5 min,弃上清;再加400 μL Hypotonic Buffer,震荡洗涤沉淀30 s,再以5 000 r/min,4 ℃离心5 min,弃上清;沉淀中再加入100 μL 配置好的Lysis Buffer,震荡悬起沉淀,冰浴20 min,以15 000 r/min,4 ℃离心10 min,分离上清即为细胞核蛋白。BCA 法将蛋白定量后95 ℃金属浴5 min 使蛋白变性,置于-80 ℃冰箱保存备用。配置好SDS-PAGE 胶后依序上样,先用20 V 电压电泳10 min,再调整到80 V 电压电泳30 min,最后使用120 V 电压电泳直至目的蛋白清晰分离后停止电泳。电泳结束后用湿转法转模,再用Western 封闭液封闭1 h,按比例加入一抗(Nrf2、HO-1 按1∶1 000 稀释,RUNX2 按1∶2 000 稀释)4 ℃过夜;次日取出并使用TBST 洗3 遍,加入相对应的二抗(稀释比例为1∶10 000)孵育1 h,TBST摇洗后PVDF 膜放置在显影盒内,均匀滴加显影液,运行Image Lab 6.0 分析实验结果。
2.5 统计学方法 实验数据采用SPSS 25.0 软件处理。计量资料符合正态分布以(±s)表示。多组间比较采用单因素方差分析,两两比较采用LSD-t 检验。P<0.05 表示差异具有统计学意义。
3 结 果
3.1 4 组超氧化物阴离子含量比较 与NC+JG 组比较,Nrf2-KD+JG 组超氧化物阴离子含量明显增多(P<0.05);与NC+NS 组比较,NC+JG 组的超氧化物阴离子含量显著降低(P<0.05),Nrf2-KD+NS 组的明显增多(P<0.05)。见图1。
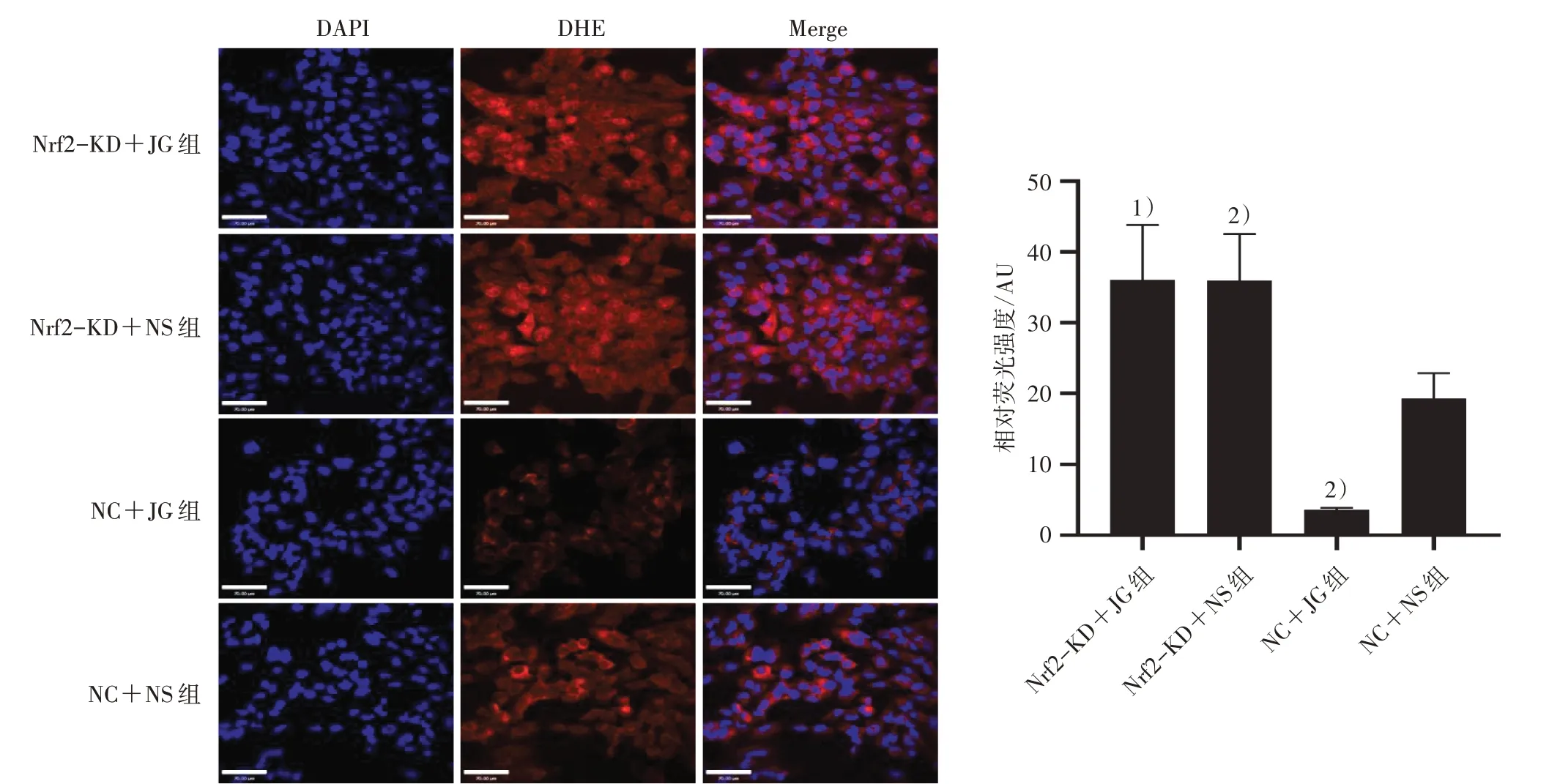
图1 4 组超氧化物阴离子含量比较(×400)
3.2 4 组矿化结节数量比较 茜素红染色后显微镜下可见:Nrf2-KD+JG 组较NC+JG 组矿化结节数量减少;与NC+NS 组比较,Nrf2-KD+NS 组矿化结节数量减少,而NC+JG 组的却明显增多。见图2。
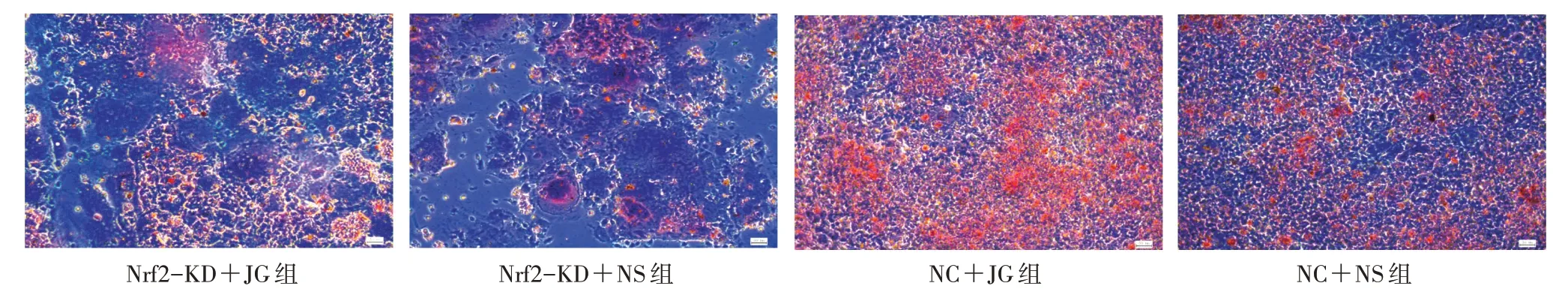
图2 4 组矿化结节数量比较(×100)
3.3 4 组Nrf2、核Nrf2、HO-1、RUNX2 蛋白相对表达量比较 Nrf2-KD+JG 组细胞内Nrf2、核Nrf2、HO-1、RUNX2 蛋白相对表达量较NC+JG 组减少(P<0.05);与NC+NS 组比较,Nrf2-KD+NS 组上述指标蛋白相对表达量减少(P<0.05),而NC+JG组上述指标蛋白相对表达量则明显升高(P<0.05)。见图3。
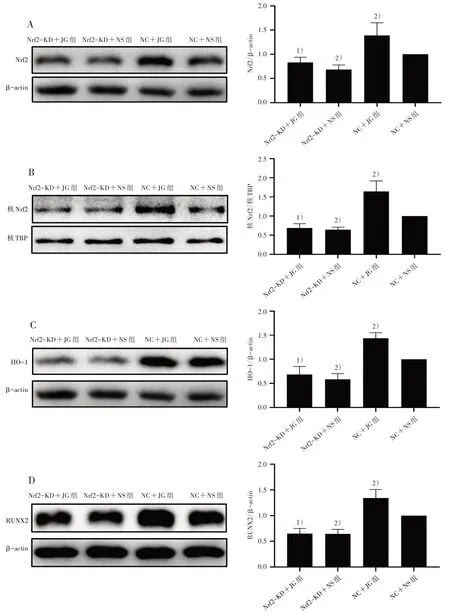
图3 4 组Nrf2、核Nrf2、HO-1、RUNX2 蛋白相对表达量比较
4 讨 论
生理状态下,细胞内Nrf2 与KEAP1 结合,只有少量游离于细胞质内。当细胞内ROS 含量过高,处于氧化应激状态下,ROS 能够激活MAPK、PI3K、PKC 信号通路使Nrf2 磷酸化,进入细胞核内与启动子抗氧化反应元件ARE 结合,启动HO-1 的转录,HO-1 在ROS 升高时大量表达,催化氧化性血红素降解,生成胆绿素、一氧化碳和铁离子,在阻止机体氧化应激过程中发挥重要作用,可见Nrf2/HO-1 信号通路是调节氧化应激的关键桥梁[13-14]。已有研究发现当敲减成骨细胞中的Nrf2 基因后,细胞内ROS 含量明显升高,同时成骨细胞分泌的RANKL 表达也明显升高[15];Nrf2 基因敲除小鼠明显出现骨形成速率下降,骨丢失增加[16];当上调Nrf2 基因表达时,能有效促进成骨细胞分化[17],同时抑制成骨细胞的凋亡[9]:这提示Nrf2 对成骨细胞骨形成的作用至关重要。本研究结果显示:在敲减Nrf2 基因后,健骨颗粒含药血清和生理盐水血清均不能有效激活细胞内Nrf2/HO-1 信号通路,抗氧化酶HO-1 的表达也出现了明显下降,不能调节细胞内超氧化物阴离子含量,细胞氧化应激水平升高,骨形成标志蛋白RUNX2 的表达下降,细胞矿化能力下降,骨形成受到抑制。这提示在氧化应激状态下,调控成骨细胞内Nrf2 含量可调节细胞氧化应激水平,进而影响成骨细胞骨形成的功能。
本实验结果显示:氧化应激状态下NC+JG 组细胞内Nrf2 蛋白表达量较NC+NS 组升高,其下游的HO-1 也随之升高,超氧化物阴离子含量相应减少,矿化结节数量增多且RUNX2 蛋白含量增加。这说明Nrf2/HO-1 信号通路在健骨颗粒含药血清促进成骨细胞骨形成作用中起到关键作用。健骨颗粒含药血清可通过激活Nrf2/HO-1 信号通路,提高成骨细胞抗氧化能力,降低氧化应激水平,升高骨形成标志蛋白RUNX2 的表达,提升骨矿化能力,促进成骨细胞骨形成,使骨稳态恢复平衡,达到防治PMOP 的目的。

