高效液相色谱法测定菜用大豆鲜籽粒VC含量
钟文娟,石盛佳,陈四维,戢沛城,龚一耘,牟方生
(四川省农业科学院经济作物育种栽培研究所,四川 成都 610300)
菜用大豆(Glycine max(L.)Merr.)亦称鲜食大豆、毛豆,鼓粒后期籽粒尚未完全饱满,以幼嫩荚果和鲜籽粒作为蔬菜食用的一类专用大豆[1],富含蛋白质、碳水化合物、膳食纤维、维生素和多种矿物元素,口味独特,深受消费者青睐,是一种具有营养和保健功能的优质食品[2]。
维生素C(VC)又名抗坏血酸,广泛存在于新鲜果蔬中,是维持人体正常生理代谢的一种重要化合物[3],但人体自身不能合成VC,需要从食物中摄取。菜用大豆含有丰富的VC,是其重要的营养品质之一[2]。已知VC 含量测定的主要方法有荧光法[1]、紫外-可见分光光度法[4]、2,6-二氯靛酚钠盐滴定法[5-7]、2,4-二硝基苯肼比较法[8-9]、高效液相色谱法(High performance liquid chromatography,HPLC)4 种[10-11]。陈华涛等[1]采用GB/T 5009.86—2003《蔬菜、水果及其制品中总抗坏血酸的测定(荧光法)》测定出9个菜用大豆品种籽粒中VC平均含量为16.60~27.67 mg/100 mg。徐兆生等[7]采用2,6-二氯靛酚钠盐滴定法测定了55份菜用大豆VC含量,发现鲜籽粒中VC含量为14.70~40.80 mg/100 g,平均值为27.56 mg/100 g,变异系数为21.03%。
目前尚未见用其他方法测定菜用大豆VC 含量的研究报道。同时,菜用大豆鲜籽粒中蛋白质和淀粉含量高[7],采用2,4-二硝基苯肼比较法和荧光法测定时干扰因素较其他果蔬多。高效液相色谱法相对于其他方法具有高效、简单、准确性好、灵敏度高等特点,且不受样品颜色的影响,广泛用于果蔬中VC含量的测定[12-15],但是目前尚未见用高效液相色谱法检测菜用大豆鲜籽粒VC含量的报道。因此,本研究采用HPLC 对菜用大豆鲜籽粒VC 含量进行检测,同时优化VC提取条件和方法,建立了菜用大豆鲜籽粒VC提取的前处理方法。采用HPLC测定菜用大豆鲜籽粒VC 方法具有简便、稳定和高效的特点,为测定菜用大豆鲜籽粒中VC含量提供理论参考,并为高VC菜用大豆品种的选育提供技术支撑。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
菜用大豆样品于2021 年6 月采摘于四川省成都市青白江区试验基地,采摘后于-20 ℃条件下保存,其他信息详见表1。L(+)抗坏血酸标准品(纯度为99.23%),德国Dr.Ehrenstorfer GmbH 公司;甲醇(色谱纯),美国Fisher 公司;偏磷酸(分析纯),天津市科密欧化学试剂有限公司;超纯水,实验室自制。

表1 供试菜用大豆信息Table 1 Test vegetable soybean information
1.1.2 仪器与设备
Agilent-1200 型高效液相色谱仪(带紫外检测器和自动进样器),美国安捷伦公司;AUW220D 型电子分析天平(精确度0.000 01 g),日本岛津公司;T-203型电子分析天平(精确度0.001 g),美国丹佛仪器公司;AvantiJ-E型大容量高速冷冻离心机,贝克曼库尔特有限公司;JYL-C022E 型料理机,九阳股份有限公司;ECO-Q15 型纯水机,上海和泰仪器有限公司;SCIENTZ-IIF型超声萃取仪,宁波新芝生物科技股份有限公司;GM-0.33Ⅱ型真空泵,天津市津腾实验设备有限公司。
1.2 方法
1.2.1 VC标准溶液的配制
准确称取0.025 00 g L(+)抗坏血酸标准品,采用30 g/L偏磷酸溶液将其溶解并定容至25 mL,得到质量浓度为1 000µg/mL的标准储备液。分别吸取标准储备液0.05、0.10、0.20、0.40、0.70、1.00 mL 于棕色容量瓶中,用30 g/L偏磷酸溶液定容至25 mL,得到质量浓度分别为2.0、4.0、8.0、16.0、28.0、40.0µg/mL 的VC标准溶液。
1.2.2 样品前处理与制备
取菜用大豆鲜荚若干,剥壳后将鲜籽粒置于冰上。称取鲜籽粒20.000 g(精确至0.001 g),置于制浆杯中,加入30 g/L 偏磷酸溶液40 mL,用料理机处理90 s 将其制成匀浆,用置于冰上的100 mL 烧杯收集匀浆。称取15.000~20.000 g(精确至0.001 g)匀浆,置于离心管中,再向离心管中加入30 g/L 偏磷酸溶液20 mL。
将装有匀浆的离心管放入超声萃取仪低温(4 ℃)提取20 min,完成后将其置于离心机中以8 000 r/min的转速在4 ℃下离心10 min。随后将上清液转移至50 mL容量瓶中,用30 g/L偏磷酸溶液定容并摇匀,获得样液。用针式注射器吸取部分样液,通过0.45µm滤膜过滤注入样品瓶中,4 ℃保存待上机分析。
1.2.3 色谱条件
色谱柱为Agilent Eclipse XDB-C18柱(4.6 mm×250 mm×5µm),流动相为1 g/L偏磷酸溶液∶甲醇=96∶4(V/V),流速0.8 mL/min,检测波长243 nm,柱温25 ℃,进样量20.0µL。
1.2.4 提取溶剂种类和浓度的选择
VC具有较强的还原性,易受空气、热、光等因素影响,但在酸性溶液中有良好的稳定性。菜用大豆籽粒中蛋白质和淀粉含量多,为防止样品VC的氧化分解,以及将VC与其他物质有效分离,在李国秀等[12]研究的基础上,并参考GB 5009.86—2016[16]中还原性抗坏血酸的浸取剂,选用偏磷酸溶液作为提取剂。分别用10、20、30、40、50 g/L偏磷酸溶液提取同一菜用大豆样品VC,同时溶解标准样品,测定出不同质量浓度溶剂制备的标准样品及样品所对应的保留时间和峰面积,依照外标对照法计算VC含量和相对标准偏差(RSD)。
1.2.5 流动相的选择
流动相需考虑使VC 稳定所需的酸性环境以及色谱柱的pH适用范围,选择1 g/L偏磷酸溶液作为流动相的主体,再配以适当比例的甲醇作为流动相。
1.2.6 标准曲线的绘制
将VC 标准溶液用0.45 µm 滤膜过滤到样品瓶中,按“1.2.3”中的色谱条件进行分析,测定其峰面积,以VC标准溶液质量浓度(µg/mL)为横坐标,峰面积(mAU·s)为纵坐标,绘制标准曲线。
1.2.7 精密度试验设计
将菜用大豆样品‘川鲜豆2 号’按“1.2.2”所述方法制得样品溶液后,按照“1.2.3”中的色谱条件连续进样测定6次,计算样品中VC含量和RSD值。
1.2.8 稳定性试验设计
将菜用大豆样品‘81-5’按照“1.2.2”所述方法制得样品溶液后,于4 ℃条件下静置8 h,按照“1.2.3”中的色谱条件分别于0、1、2、3、4、5、6、7、8 h进样分析,计算样品中VC含量和RSD值。
1.2.9 重复性试验设计
将菜用大豆样品‘川鲜豆1 号’按“1.2.2”所述方法平行制备6份供试样品溶液,按照“1.2.3”中的色谱条件分别进样分析,计算样品中VC含量和RSD值。
1.2.10 回收率试验设计
精密称取已知VC 含量的菜用大豆样品‘81-5’,加入VC标准溶液适量,按照“1.2.2”所述方法制备6份供试样品溶液和“1.2.3”中的色谱条件分别进样分析。
1.2.11 数据处理
所有试验数据均用Excel 2007软件计算处理。
2 结果与分析
2.1 提取溶剂质量浓度的确定
由表2可见,以质量浓度为30、40、50 g/L 的偏磷酸溶液作为提取溶剂,检测到的VC含量平均值无显著性差异,因此选择30 g/L偏磷酸溶液作为浸取剂提取菜用大豆鲜籽粒中VC。
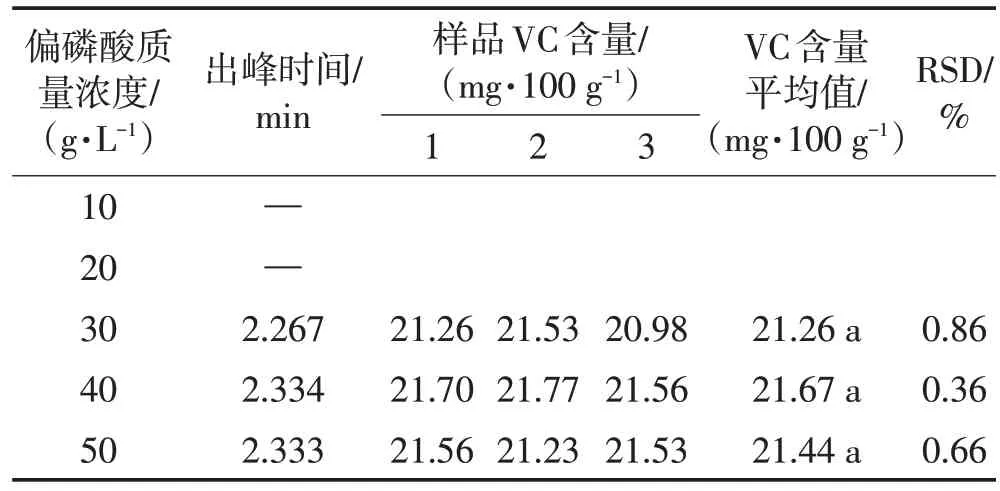
表2 提取剂质量浓度选择试验结果Table 2 Selection test results of extractant concentration
2.2 流动相的确定
以1 g/L 偏磷酸∶甲醇=96∶4(V/V)为流动相时,VC 与邻近杂质峰能够达到基线分离,液相色谱峰尖锐且样品分析时间短,因此,本研究以1 g/L 偏磷酸∶甲醇=96∶4(V/V)为流动相。图1 为VC 标准品色谱图,图2 为菜用大豆样品溶液色谱图。由图1 和图2可见,VC标准样品和菜用大豆样品中VC的保留时间分别为4.327 min和4.329 min。
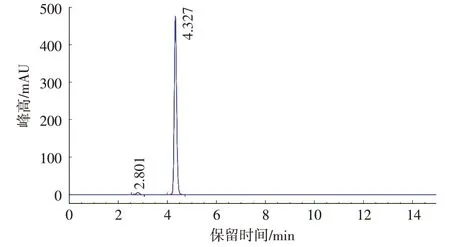
图1 VC标准溶液高效液相色谱图Fig.1 Chromatogram of vitamin C standard solution by HPLC

图2 菜用大豆样品溶液高效液相色谱图Fig.2 Chromatogram of vegetable soybean sample solution by HPLC
2.3 标准曲线绘制结果
如图3 所示,VC 标准曲线回归方程为y=80.751x-6.409 4,R2=1.000,表明VC 质量浓度范围为2~40µg/mL时,其峰面积与质量浓度的线性关系良好。

图3 VC标准曲线Fig.3 Standard curve of VC
2.4 精密度试验结果
由表3可见:RSD值为0.13%,说明本试验方法测定菜用大豆鲜籽粒VC含量的精密度良好。

表3 精密度试验结果Table 3 Precision test results
2.5 稳定性试验结果
表4 显示:8 h 时样品VC 含量为23.34 mg/100 g,RSD 值为0.30%,说明供试样品溶液在4 ℃低温下可保持8 h稳定。
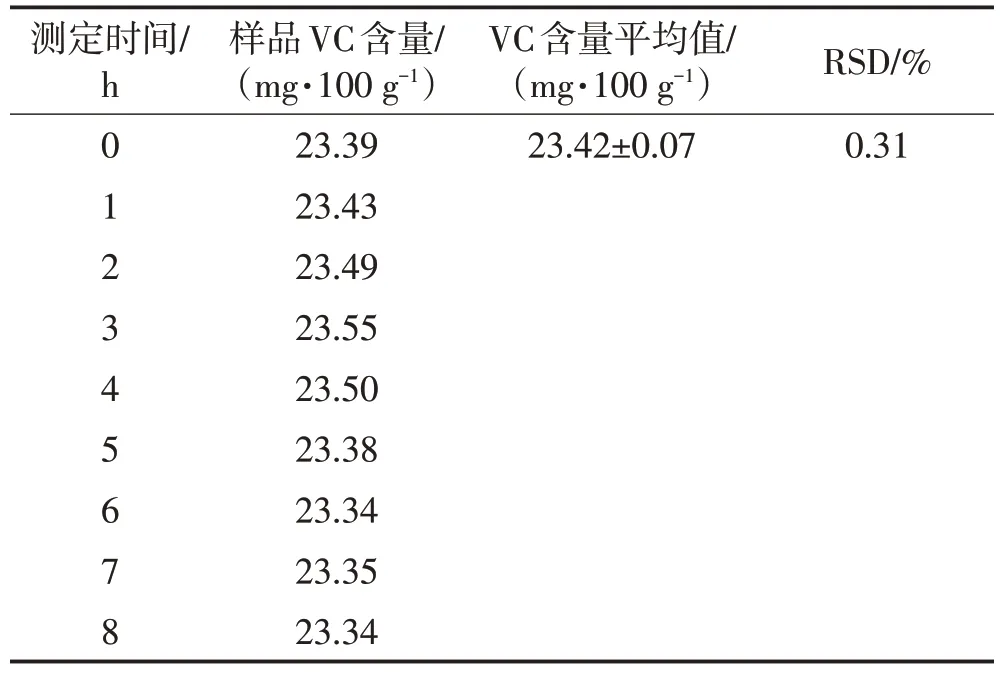
表4 稳定性试验结果Table 4 Stability test results
2.6 重复性试验结果
由表5可见:RSD值为1.03%,说明本试验方法测定菜用大豆鲜籽粒VC含量的重复性良好。

表5 重复性试验结果Table 5 Repeatability test results
2.7 回收率试验结果
由表6可见:平均加标回收率为108.14%,6次测定结果的RSD 值为1.70%,表明本试验方法准确度良好。
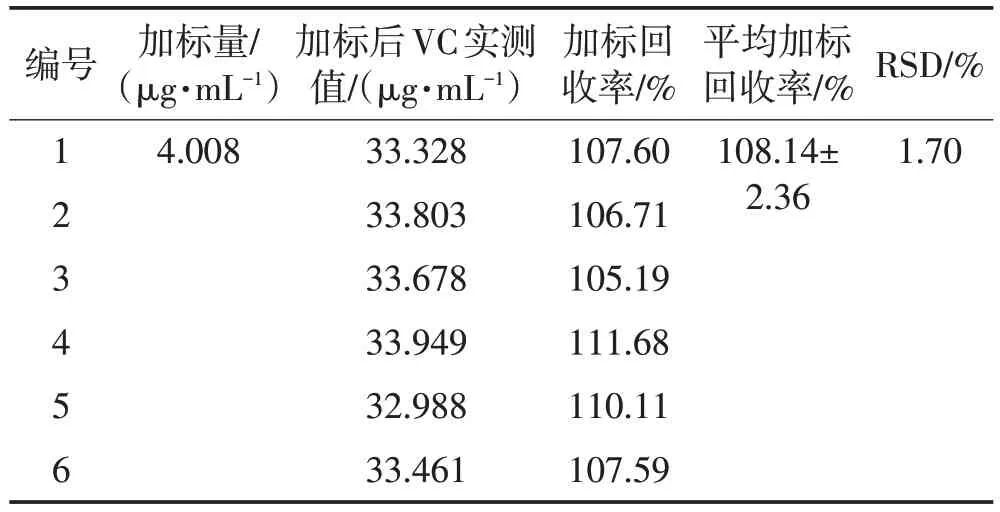
表6 回收率试验结果Table 6 Recovery rate test results
2.8 样品测定
将12 个菜用大豆样品按照“1.2.2”所述方法和“1.2.3”中的色谱条件,分别制备3份供试溶液进样分析,依照外标对照法计算VC含量,结果见表7。由表7 可见,12 个菜用大豆品种鲜籽粒中VC 平均含量范围为19.63~27.59 mg/100 g。与陈华涛等[1]采用荧光法测定9 个菜用大豆品种籽粒中VC 的平均含量(16.60~27.67 mg/100 g)范围较一致。表明此方法能有效检测出菜用大豆鲜籽粒中的VC含量。

表7 不同菜用大豆品种中VC含量测定结果Table 7 Determination results of VC content in different vegetable soybean varieties 单位:mg/100 g
3 讨论与结论
菜用大豆鲜籽粒质地较硬且含有丰富的蛋白质和淀粉[10],将样品进行匀浆处理比较困难,不易得到较高质量的匀浆样品。本研究优化的菜用大豆鲜籽粒前处理方法能有效地将鲜籽粒进行匀浆处理,得到品质较好的鲜籽粒匀浆,提高了样品中VC 萃取率,并配合低温提取减少鲜籽粒中VC 的氧化,尽量减少测定样品中VC 含量的损耗,降低试验误差,是一种有效的前处理方法。同时,该样品前处理方法也可为菜用大豆鲜籽粒中其他营养成分检测提供参考。
菜用大豆鲜籽粒中的VC 含量没有猕猴桃样品中的含量高[12],采用提取试剂10 g/L偏磷酸浓度试验效果不理想,同时采用GB 5009.86—2016[16]中提供的参考质量浓度20 g/L 检测时VC 也没有目标峰,因此对菜用大豆鲜籽粒VC 提取的最适偏磷酸质量浓度进行了探究。试验结果表明:不同提取剂质量浓度对检测结果影响较大,30 g/L偏磷酸适宜用于菜用大豆鲜籽粒VC 的提取,因此建议在检测不同作物VC含量时需要对相应的提取试剂质量浓度进行筛选,以获得更加精准的试验数据。
本研究采用高效液相色谱法测定菜用大豆鲜籽粒中VC含量,以30 g/L偏磷酸溶液作为提取溶剂,低温提取菜用大豆鲜籽粒中VC,操作简便,可避免样品中VC 被氧化和其他基质成分的干扰。从稳定性试验数据可以看出,8 h 内VC 含量变化不显著,能够保证样品和对照品溶液在测定的时间内稳定。供试样品色谱峰对称性良好,既能达到基线分离的要求,又有适宜的保留时间,测定结果稳定准确,且灵敏度高。综上所述,该方法适用于测定菜用大豆鲜籽粒中VC含量。

