辛硫磷对罗氏沼虾的毒性效应研究
纪鹏,许文静,敖士齐,吴聪聪,张晓君,高晓建,姜群
(扬州大学动物科学与技术学院,江苏 扬州 225009)
随着现代农业的发展,使用农药已成为农业生产必不可少的环节,全球每年约消耗200 万吨的农药,其中大部分是有机磷农药[1,2]。辛硫磷是一种典型的有机磷农药,具有广谱高效和对哺乳动物低毒等特点[3],广泛应用于农业生产中鳞翅目害虫的防治。近年来,农业生产中滥用辛硫磷导致了严重的环境残留问题。据报道,山西某农场土壤中辛硫磷含量达89.9 μg/L[4]。土壤中残留的辛硫磷可通过淋滤、渗透等方式汇聚到水体中,污染水体。例如墨西哥西北部某农场长期使用辛硫磷,导致周围水域辛硫磷含量达2.4 μg/L[5];我国珠三角河网水环境中辛硫磷含量最高为344.94 ng/L[6],严重影响水生生物[7]。除在农业生产中广泛应用,辛硫磷也被用于防治水产动物寄生虫病害以及鱼类败血症[8]。有报道发现,辛硫磷可导致水生动物发生行为障碍、氧化应激损伤、肝胰腺功能障碍、神经系统及免疫系统损伤等[9]。例如,辛硫磷可引起岩原鲤(Procypris rabaudi)谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-pX)、超氧化物歧化酶(Superoxide dismutase,SOD)活性下降,削弱抗氧化能力[10];造成鲫(Carassius auratus)乙酰胆碱酶(Acetylcholinease,AChE)活性降低,抑制神经系统信号传导[11],并抑制鲫的色素酶450(Cytochrome P450,CYP450)活性[12,13]。目前,辛硫磷对水产动物的毒害作用研究主要集中在鱼类[14,15],甲壳动物相关研究较少,辛硫磷对甲壳动物的影响仍需探究。
罗氏沼虾(Macrobrachium rosenbergii)主要分布于亚洲地区,生长速度快、体型大、耐盐性好、与其他鱼类相容性强,是淡水养殖主要经济虾类之一。本试验研究了辛硫磷对罗氏沼虾的急性毒性,并将罗氏沼虾暴露于浓度低于96 h LC50的辛硫磷4 d,之后转移至清水养殖7 d,分析辛硫磷暴露对罗氏沼虾的氧化防御、免疫、神经功能和组织病理损伤及可逆性,旨在探究辛硫磷对罗氏沼虾的潜在危害,并为辛硫磷对甲壳动物风险评估体系的建立提供理论依据。
1 材料与方法
1.1 材料
试验用罗氏沼虾取自江苏扬州富源水产有限公司,体质健康,平均体质量为(1.2±0.2)g,在100 L水体中适应一周。期间每日投喂两次商品饲料,水温(21.0±0.5)℃,pH 约7.0,养殖水体定期更换。
试验用辛硫磷购自艾森公司,有效浓度为40%。适应期后,开展预试验,确定急性毒性试验的最佳试验浓度范围。
1.2 方法
将罗氏沼虾暴露于按照等比间距选择的6 种辛硫磷浓度:3.125 μg/L、6.25 μg/L、12.5 μg/L、25 μg/L、50 μg/L 和100 μg/L 水体中,以不添加辛硫磷的清水作为对照组,每组30 尾罗氏沼虾,每个浓度设3个平行,采用半静水试验法进行96 h 急性毒性试验,试验水体为30 L。每日观察试验虾活动与死亡状况,以罗氏沼虾僵直沉底且对外界刺激无反应确定为死亡特征。记录死亡数和死亡时间,按Bliss 统计法计算各时间的半数致死浓度(LC50)。
为进一步探究辛硫磷对罗氏沼虾的毒性及损伤的可逆性,将罗氏沼虾暴露于1/3 96 h LC50浓度的辛硫磷水体中饲养4 d 后,转至清水中饲养7 d,每天更换1/2 水体,试验组与对照组均设置3 个平行,每组40 尾罗氏沼虾。在第0 d、4 d、11 d 随机取3尾罗氏沼虾,解剖获得肝胰腺、鳃和肠道组织,置于Bouin’s 试液固定,用于组织病理学观察;在第0 d、1 d、2 d、4 d、11 d 随机取5 尾罗氏沼虾,解剖获得肝胰腺和肌肉组织,置于液氮中快速冷冻,-80 ℃保存,用于酶活和基因表达测定。
组织病理学观察:将试验开始后第0 d、4 d、11 d 在Bouin’s 溶液固定24 h 的肝胰腺、鳃、肠道组织样本放入75%的乙醇脱水低温保存。通过组织包埋、切片后,用苏木精—伊红(HE)染色,在光学显微镜下观察及拍摄主要病理变化。
酶活的测定:将冻存的肝胰腺和肌肉组织按比例加入生理盐水匀浆,4 ℃3 000 r/min 离心取上清液,采用南京建成生物工程研究所试剂盒检测肝胰腺中丙二醛(Malondialdehyde,MDA)和过氧化物(Hydrogenperoxide,H2O2)的含量,检测SOD、GSH-pX、谷草转氨酶(Aspartate aminotransferase,GOT)、谷丙转氨酶(Alanine aminotransferase,GPT)和肌肉中的AChE 活性。
免疫相关基因表达测定:取试验第0 d、1 d、2 d、4 d、11 d 的肝胰腺样品,TRIzol 法提取总RNA,通过微型分光光度计和琼脂糖电泳检测总RNA 的纯度和完整性。按照PrimeScriptTMRT 反转录试剂盒说明书具体步骤,将RNA 反转录成cDNA,反转录后得到的cDNA 于-20 ℃保存。使用Primer 6 软件设计罗氏沼虾免疫基因引物。引物信息见表1,以β-actin 和ef1α 管家基因作为内参。本试验选取抗脂多糖因子alf 基因、热休克蛋白hsp 基因、血蓝蛋白hemocyanin 基因和酚氧化酶原proPO 基因四个免疫基因,按照GreenTMPremix Ex TaqTMII 试剂盒(南京诺唯赞生物)的步骤,进行实时荧光定量PCR(qRT-PCR),检测不同时间点肝胰腺组织中免疫相关基因的表达量。

表1 荧光定量PCR 试验所用引物序列Tab.1 Sequence of the primers used in qRT-PCR in this experiment
1.3 数据处理
采用Excel 2010 软件对罗氏沼虾的24 h、48 h、72 h、96 h 的死亡数据进行统计分析,利用Bliss 方法计算得到LC50。采用SPSS 20.0 软件对实验得出的酶活数据及定量数据进行单因素方差(ANOVA)分析,通过SNK(Student-Newman-Keuls)q 检验方法进行多重比较,采用GraphPad Prism 8.0 作图。
2 结果与分析
2.1 辛硫磷对罗氏沼虾的急性毒性
在急性毒性试验中,对照组罗氏沼虾均存活,试验组罗氏沼虾呈现不同程度的活力下降和死亡情况。暴露初期游动异常迅速,短暂兴奋后游动迟缓,活力衰减。死亡多集中在暴露试验的第1~2 d,死亡率随辛硫磷浓度增加而升高。根据统计的死亡个体数据和Bliss 方法计算,辛硫磷对罗氏沼虾的24 h、48 h、72 h、96 h LC50分别是16.83 μg/L、10.64 μg/L、8.57 μg/L和6.98 μg/L。根据国家《水与废水监测分析方法》判定辛硫磷对罗氏沼虾剧毒[14]。
2.2 辛硫磷对罗氏沼虾的组织病理损伤
对照组罗氏沼虾肝胰腺中肝小管排布紧密,管内间隙分明,具有大小不一的转运泡,组织未见明显异常(图1-a)。与对照组相比,辛硫磷暴露4 d 的肝胰腺组织肝小管紧密排布,管内间隙消失,转运泡消失(图1-b)。清水养殖7 d 后肝胰腺组织管内空隙部分恢复,肝小管排布紧密,转运泡结构未恢复(图1-c)。未经辛硫磷处理的对照组鳃组织结构如图1-d 所示,鳃丝和鳃丝基部结构分明,无明显异常,辛硫磷暴露4 d 的鳃组织鳃丝基部出现空泡(图1-e)。清水养殖7 d 后鳃丝基部空泡消失(图1-f)。对照组肠道组织肠道结构分明,肠道黏膜层上皮细胞排列紧密,肠道绒毛分明,肌层分界明显,未出现异常现象(图1-g)。辛硫磷暴露4 d 的肠道肠绒毛结构消失,黏膜层细胞脱落(图1-h)。清水养殖7d 后肠道绒毛结构恢复,但上皮细胞缺失严重,排布稀疏(图1-i)。
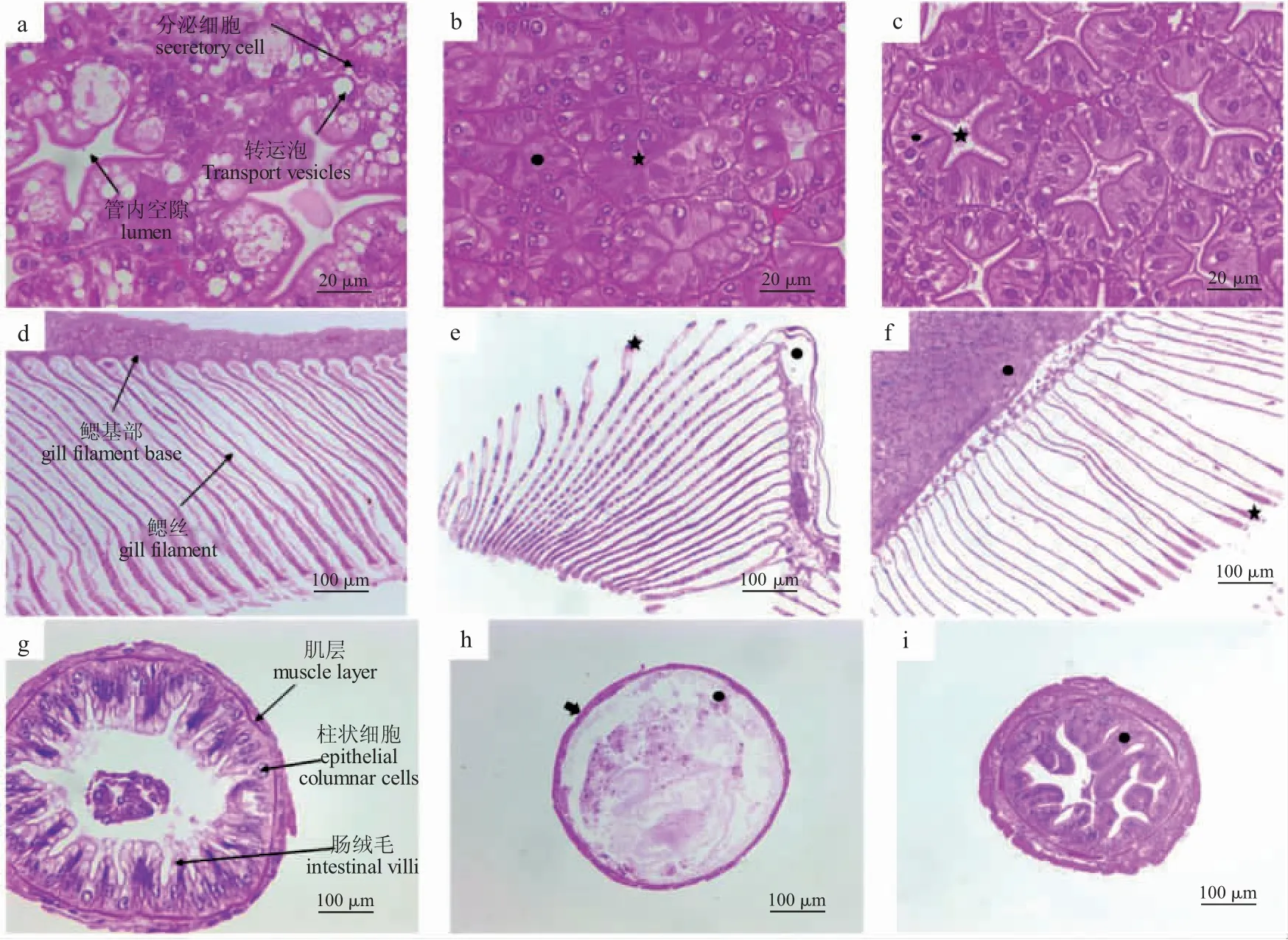
图1 辛硫磷对罗氏沼虾肝胰腺、鳃、肠的组织病理损伤Fig.1 Histopathological injury of the hepatopancreas,gill,and intestinal tissues of giant river prawn M.rosebergii exposed to phoxim
2.3 肝胰腺功能损伤
与对照组相比,辛硫磷暴露后罗氏沼虾肝胰腺组织GOT 和GPT 活性均显著降低。GPT 活性在第2 d 达到最低点,第4 d 时显著上升(P<0.05),清水恢复后GPT 活性略有上升,与第1 d、2 d、4 d 时存在显著差异,但仍显著低于对照组水平(P<0.05);GOT 活性在第1-4 d 期间显著降低,清水恢复后GOT 活性显著上升,与第1 d、2 d、4 d 存在显著差异(P<0.05),但仍显著低于对照组水平(图2)。
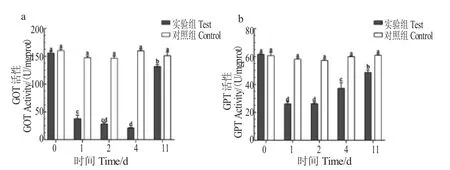
图2 辛硫磷对肝胰腺GOT 和GPT 活性的影响Fig.2 Changes in the activities of GOT and GPT in hepatopancreas tissues of giant river prawn M.rosenbergii exposed to phoxim
2.4 氧化应激功能损伤
如图3-a 和3-b 所示,与对照组相比,辛硫磷处理可导致罗氏沼虾肝胰腺组织MDA 和H2O2的大量累积,MDA 含量在辛硫磷暴露第4 d 达到峰值,与第1 d、2 d 无显著差异(P>0.05),而H2O2含量在暴露第1 d 即达最高水平,第4 d 后含量显著降低,仍显著高于对照组水平(P<0.05);经过清水养殖7 d 后,MDA 和H2O2含量均下降至对照组水平,MDA含量与第1 d、2 d、4 d 存在极显著差异(P<0.05),H202含量与第1 d、2 d 存在极显著差异,与第4 d 存在显著差异(P<0.05)。图3-c 和3-d 所示,辛硫磷暴露第1 d 罗氏沼虾SOD 和GSH-pX 的活性即下降,与对照组差异显著,4 d 的暴露试验周期内,SOD 和GSH-pX 的活性一直处于较低水平,期间无显著差异(P>0.05),清水恢复7 d 后二者活性上升,与第1 d、2 d、4 d 相比,SOD 和GSH-pX 活性均存在显著差异,SOD 活性恢复至对照组水平,GSH-pX 活性仍显著低于对照组水平。
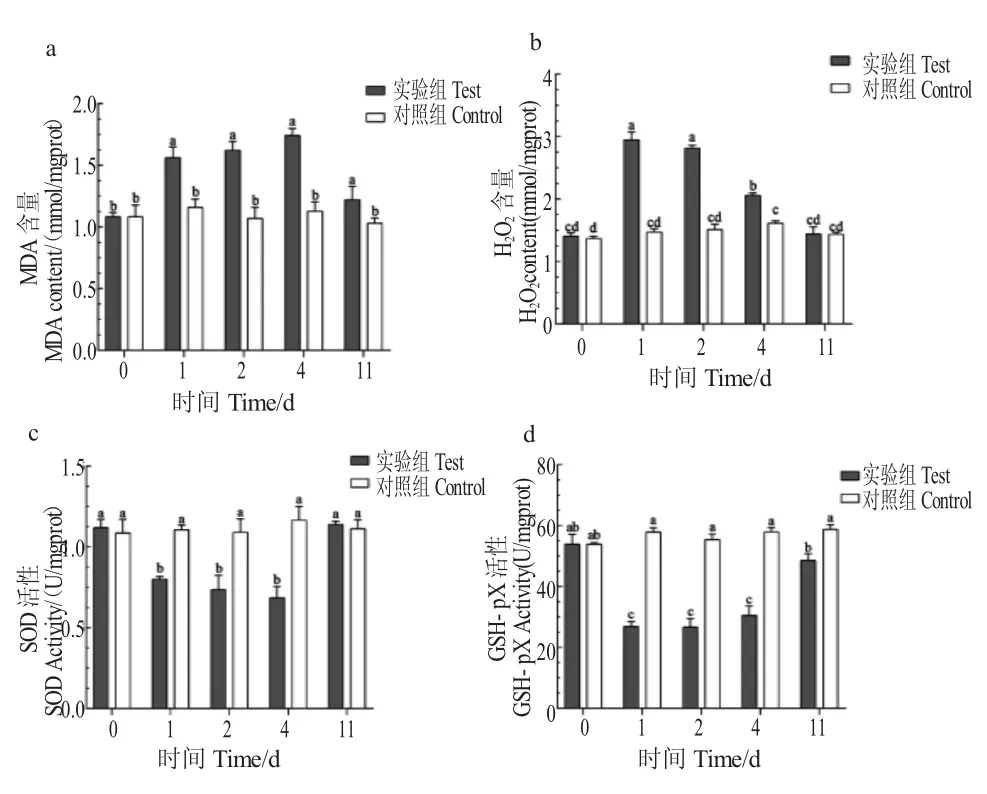
图3 辛硫磷对罗氏沼虾肝胰腺MDA 和H2O2 含量及SOD和GSH-pX 活性的影响Fig.3 Alterations in H2O2 and MDA levels and the activity of GSH-Px and SOD in hepatopancreas tissues of giant river prawn M.rosenbergii exposed to phoxim
2.5 神经系统损伤
与对照组相比,辛硫磷暴露后第2 d AChE 的活性显著下降,第4 d 略有上升,与第2 d 无明显差异(P>0.05),清水恢复后,与第1 d、2 d、4 d 相比,AChE 活性显著上升,但仍显著低于对照组水平(P<0.05,图4)。
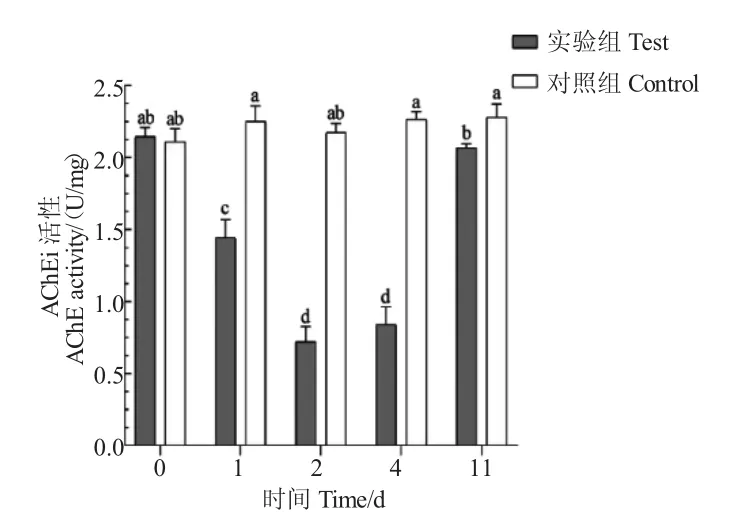
图4 辛硫磷对罗氏沼虾肌肉AChE 活性的影响Fig.4 Changes in the activity of AChE in muscle tissues of giant river prawn M.rosenbergii exposed to phoxim
2.6 免疫系统损伤
与对照组相比,辛硫磷处理抑制了罗氏沼虾肝胰腺组织4 个免疫基因的表达,proPO 基因和alf 基因的表达量在第1-4 d 显著下降,与对照组有显著差异(P<0.05),hsp 基因和hemocyanin 基因表达量呈下降趋势,第2 d 表达量显著下降(P<0.05),第4 d 略有上升,与对照组有显著差异(图5)。经过清水养殖7 d 后,hemocyanin 基因和proPO 基因的表达量,与第1 d、2 d、4 d 相比均存在极显著差异(P<0.01),与对照组比较无显著性差异(P>0.05),alf 基因和hsp 基因表达量未恢复对照组水平,与辛硫磷暴露后的第1 d、2 d、4 d 相比,alf 基因存在显著差异(P<0.05),hsp 基因表达量存在极显著差异(P<0.01),与对照组存在极显著差异(P<0.01)。
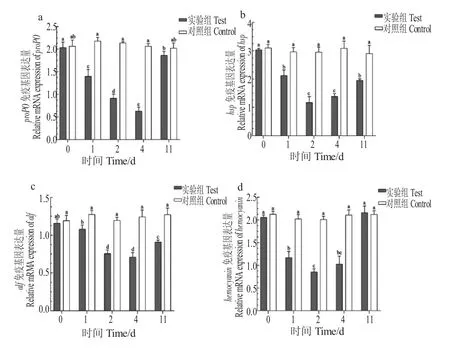
图5 辛硫磷对肝胰腺组织免疫相关基因mRNA 表达的影响Fig.5 The effect of phoxim on the relative mRNA expression of immune-related genes in hepatopancreas tissues of giant river prawn M.rosenbergii.
3 讨论
频繁过量使用的辛硫磷可通过淋滤等作用进入水环境[16-19],导致水体中辛硫磷的富集。辛硫磷在水产养殖寄生虫病害和鱼类败血症防治中的应用,也加剧了水产动物暴露于辛硫磷水体的危险。虽然辛硫磷相对易分解,不易残留,但辛硫磷的蓄积作用对水产动物存在潜在危害[21],因此有必要开展辛硫磷对水产动物毒性效应评估。辛硫磷对鲤(Cyprinus carpio)、金鱼(Carassius auratus)和黑鲷(Acanthopagrus schlegelii)幼鱼的96 h LC50分别为1.0 mg/L、10 mg/L 和0.30 mg/L[22,23]。本研究结果显示,辛硫磷对罗氏沼虾96 h LC50为6.988 μg/L,显著低于鱼类,相似的结果在凡纳滨对虾(Litopenaeus vannamei)中也有报道。周桂娴等[8]发现,辛硫磷对凡纳滨对虾24 h 和48 h LC50分别为6.32 μg/L 和1.03 μg/L,表明甲壳类动物比鱼类对辛硫磷更敏感。根据国家《水与废水监测分析方法》规定,判定辛硫磷对罗氏沼虾剧毒。为进一步分析辛硫磷对罗氏沼虾的毒性作用,将GOP、GPT、SOD、GSH-pX 和AChE 活性,MDA 和H2O2含量,以及proPO 基因、hsp 基因、alf 基因和hemocyanin 基因mRNA 表达量变化作为生物标志物,衡量罗氏沼虾生理变化,评估辛硫磷对罗氏沼虾的损伤。
3.1 辛硫磷对罗氏沼虾肝胰腺功能及免疫系统的影响
肝胰腺是罗氏沼虾重要的代谢和免疫器官,GPT 和GOT 作为动物细胞中的重要氨基酸转氨酶,是衡量肝细胞功能的敏感指标[24]。本试验中,辛硫磷暴露导致罗氏沼虾GOT 和GPT 活性急剧下降,表明辛硫磷可能损害罗氏沼虾肝胰腺功能,这与组织切片表现出的肝胰腺组织结构的破坏结果一致。在泥鳅(Misgurnus anguillicaudatus)中也有相似的报道。于敏等[25]研究发现,高浓度辛硫磷处理可导致泥鳅谷丙转氨酶GPT 活性迅速下降,蛋白浓度显著降低,推测辛硫磷暴露可影响氨基酸转氨酶活性与蛋白质的合成,进而影响肝胰腺功能。辛硫磷处理导致罗氏沼虾肝胰腺免疫相关基因(proPO 基因、hsp 基因、alf 基因和hemocyanin 基因)表达发生显著变化,推测辛硫磷可影响免疫系统。酚氧化酶原激活系统是甲壳类动物先天性免疫中重要一环,控制病原的识别、防卫和信息传递[26]。辛硫磷处理导致罗氏沼虾酚氧化酶原基因(proPO)表达先升高后显著下降,相似的研究结果在毒死蜱对凡纳滨对虾的损伤[26]中也有报道,推测辛硫磷处理初期可刺激酚氧化酶原激活系统,随着辛硫磷处理时间的延长及其对肝胰腺的损伤,显著抑制了酚氧化酶原激活系统。除proPO 基因外,hsp 基因、alf 基因和hemocyanin 基因在辛硫磷处理后均表现为显著下降。热休克蛋白(Heat Shock Proteins,hsp)作为动物机体内的热应激蛋白,可以提高细胞的应激能力,也是重要的非特异性免疫因子[28];血蓝蛋白是体液免疫的重要组成,具有抗菌、抗病毒和抗肿瘤的作用[29,30];抗脂多糖因子(antilipopolysaccharide factor,alf)是甲壳动物体内的一种抗菌肽,可以和脂多糖特异性结合,起抑菌作用。上述三种免疫基因表达的显著下调暗示了辛硫磷对罗氏沼虾非特异性免疫系统的损伤,这与焦阳等[31]报道的农药可抑制中华绒螯蟹(Eriocheir sinensis)的免疫基因表达的研究结果一致。
3.2 辛硫磷对罗氏沼虾氧化防御系统的影响
生物体在受到外界有毒物质或者有害理化因子胁迫时,活性氧自由基增加,机体受损甚至死亡。氧自由基H2O2和脂质过氧化产物MDA 是2 种重要的氧化应激标志物。辛硫磷暴露导致罗氏沼虾肝胰腺组织H2O2和MDA 含量显著上升,这与杨帆等[10]的试验结果相似,推测在受到毒性物质的胁迫时机体过量产生活性氧自由基,导致H2O2和MDA含量显著上升,表明辛硫磷暴露可破坏罗氏沼虾肝胰腺组织氧化还原平衡,氧自由基积累和脂质过氧化,为抵抗氧化损伤,生物体通过抗氧化酶等清除过多的氧自由基。超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-pX)是重要的抗氧化酶,可催化还原反应,消除活性氧,维持氧化平衡。本研究发现,辛硫磷暴露可显著降低SOD 和GSH-pX 的活性,这可能是氧自由基的大量积累导致抗氧化酶与氧自由基相互作用而失活[32,33]。丁诗华对草鱼(Ctenopharyngodon idella)的研究发现[34],少量的活性氧对抗氧化酶有刺激作用,促使抗氧化酶活性上升,但是,在长时间或高浓度胁迫时,生物体内活性氧过度积累,抑制抗氧化酶的活性[35]。本研究中SOD 和GSH-pX 活性在辛硫磷暴露初期即处于抑制状态,随着时间的推移活性不断下降,与上述高浓度胁迫试验结果一致,表明2 μg/L 浓度的辛硫磷可严重破坏罗氏沼虾抗氧化系统。
3.3 辛硫磷对罗氏沼虾神经系统的影响
乙酰胆碱酶(AChE)可以特异性水解突触释放的乙酰胆碱,参与信号传导,是神经系统正常工作的重要指标,大量存在于大脑、交感神经、肌肉等处[36]。本试验检测了肌肉组织中乙酰胆碱酶的活性来确定辛硫磷对罗氏沼虾神经系统的损伤。汪鹏鹏等[37]报道,有机磷农药进入生物体后,可抑制各组织器官内的胆碱酯酶活性,影响神经递质传递神经信号。本研究发现,辛硫磷暴露导致罗氏沼虾AChE活性下降,暴露初期游动加速,后期行动迟缓,推测罗氏沼虾AChE 活性的下降导致乙酰胆碱大量蓄积,造成暴露初期的兴奋表现,暴露时间延长后,神经系统受损严重,后期的运动迟缓,结果与斑马鱼(Danio rerio)和凡纳滨对虾研究结果一致[8,36]。
3.4 结论
辛硫磷对罗氏沼虾剧毒,低于96 h LC50浓度的辛硫磷暴露可导致罗氏沼虾的肝胰腺、肠道和鳃组织严重病理损伤,破坏氧化防御系统、免疫系统和神经系统,且部分损伤不可逆。

