QuEChERS-气相色谱-串联质谱法测定食用花卉中7种常见杀虫剂的含量
徐 倩,孙志洪,路瑞娟,郭伟伟,倪 洁
(1. 河北省沧州市疾病预防控制中心,沧州 061000;2.河北省沧州生态环境监测中心,沧州 061000;3.沧州市生态环境保护科学研究院,沧州 061000;4.沧州市生态环境保护科学研究院,061005;5.河北省衡水生态环境监测中心,衡水 053000)
食用花卉,如玫瑰花、金银花、槐花、菊花等,指的是一类可以将其花朵或叶子等直接食用的植物,该类植物不仅可以供人食用,还可用来观赏、酿酒、制药、提取香精等。食用花卉不仅富含蛋白质、维生素、氨基酸等营养物质,还含有多种微量金属元素,如铁、硒、锌等,具有提高人体免疫能力、祛除色素斑点、调节人体内分泌等作用,因此我国食用花卉种植越来越广泛[1-2]。在种植食用花卉过程中,为防治虫害影响其产量和质量,常通过喷洒等方式施用抗蚜威、三氯杀螨醇等杀虫剂[3-6]。这些杀虫剂会附着在食用花卉植物的茎、叶、花等部位,人们误食到被杀虫剂污染的食用花卉时,会产生中毒症状,轻者引起头晕、恶心等,重者引起呕吐、晕倒等,严重时可能导致死亡。因此,加强对食用花卉中杀虫剂残留的监测具有重要意义[7-8]。
现阶段,关于食用花卉中杀虫剂残留的研究较少,文献方法多采用QuEChERS-高效液相色谱法,研究的农药多为吡虫啉、啶虫脒、噻虫嗪和噻虫啉等新烟碱类农药[9-17],且QuEChERS提取法耗时长,重复性差。一些蔬菜中杀虫剂残留的分析方法所研究的杀虫剂种类也较少,且未包括食用花卉常见农药[18-19]。为能更全面研究食用花卉中常见杀虫剂残留的水平和种类[20],本工作采用QuEChERS自动样品制备系统提取,气相色谱-串联质谱法(GC-MS/MS)测定食用花卉中三氯杀螨醇、腈菌唑、对甲抑菌灵、环氟菌胺、抗蚜威、杀螟硫磷、啶虫丙醚等7种常见杀虫剂的含量。
1 试验部分
1.1 仪器与试剂
GC 2010 Plus型气相色谱仪;TQ 8040型串联质谱仪;SIO-6512型QuEChERS自动样品制备系统;DSY-VI型水浴氮吹仪; XS 205DU型电子天平(精度为0.01 mg)。
单标准溶液:三氯杀螨醇、腈菌唑、对甲抑菌灵、环氟菌胺、抗蚜威、杀螟硫磷和啶虫丙醚的质量浓度均为100 mg·L-1。
混合标准储备溶液:10 mg·L-1,取单标准溶液各1 mL置于10 mL棕色容量瓶中,用丙酮稀释而成。使用时,用丙酮稀释至所需的质量浓度。
基质匹配混合标准溶液系列:取适量混合标准储备溶液,用丙酮稀释成 0.005, 0.01, 0.05, 0.1, 1.0, 5.0 mg·L-1的混合标准溶液系列,各取1 mL置于氮吹至近干的阴性玫瑰花瓣样品溶液中,涡旋混匀,过0.22 μm滤膜,制成基质匹配混合标准溶液系列,备用。
丙酮、乙腈为色谱纯;萃取包包含4 g无水硫酸镁、1 g氯化钠、1 g柠檬酸钠、0.5 g柠檬酸二钠;净化剂为500 mg硫酸镁+150 mgN-丙基乙二胺(PSA)和15 mg石墨化碳黑(GCB)。
1.2 仪器工作条件
1.2.1 色谱条件
Rtx-5MS色谱柱(30 m×0.25 mm,0.25 μm);进样口温度230 ℃;载气为高纯氦气,纯度99.999%;柱流量1.6 mL·min-1,恒流模式;脉冲不分流进样;进样体积1.0 μL。柱升温程序:初始温度60 ℃,保持 1 min;以25 ℃·min-1速率升至150 ℃,保持2 min;以15 ℃·min-1速率 升至300 ℃,保持10 min。
1.2.2 质谱条件
电子轰击离子源;离子源温度280 ℃;传输线温度280 ℃;检测器电压0.6 kV(相对于调谐结果);碰撞气为高纯氩气,纯度99.999%;溶剂延迟时间2.0 min;扫描范围质荷比(m/z)45~450;多反应监测(MRM)模式。其他质谱参数见表1。
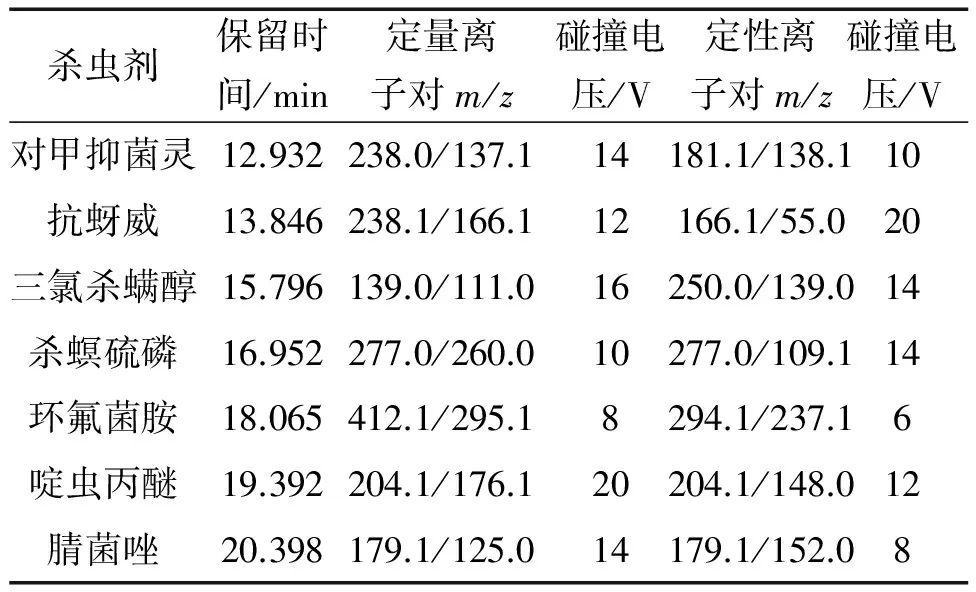
表1 质谱参数
1.3 试验方法
取10 g食用花卉样品于50 mL塑料离心管中,加入20 mL乙腈,一个萃取包和1颗均质子,闭盖剧烈振摇1 min,使样品与萃取溶剂充分接触。将预先装有净化剂的净化管迅速插入上述塑料离心管中并盖紧上盖,将离心管放入QuEChERS自动样品制备系统中,按照以下程序提取与净化:振荡提取15 min,所得提取液以转速8 000 r·min-1离心5 min,上清液振荡净化5 min,以转速8 000 r·min-1离心5 min。将全部上清液置于50 ℃水浴锅中加热15 min,所得溶液氮吹至近干,用丙酮定容至1 mL,转移至进样瓶中, 上机测定。
2 结果与讨论
2.1 稳定性差的杀虫剂色谱条件的优化
杀螟硫磷、对甲抑菌灵杀虫剂热稳定性较差,响应较低且色谱峰拖尾严重,导致这两种杀虫剂难以准确定量,主要和初始柱温低,进样后各杀虫剂在进样口和柱头积聚导致的基体效应有关。此外,样品基质中的糖类、脂肪和色素等成分未被完全净化时,进入色谱柱会对色谱柱造成严重污染,影响这两种杀虫剂的色谱行为。经过多次试验,发现可通过截除毛细管入口段、及时老化色谱柱和更换玻璃衬管等手段有效解决这两种杀虫剂测定准确度变差的现象。
2.2 质谱条件的优化
对质谱仪进行真空测试并进行自动调谐,使仪器分辨率和灵敏度处于最佳状态。在优化MRM参数前,首先选择质谱全扫描模式对混合标准溶液进行扫描,确定各杀虫剂对应的保留时间和母离子。接着对母离子进行产物离子扫描,得到碎片特征离子对,从中选择响应值较高的一对作定量离子对,次强的作定性离子对。利用保留时间和特征离子进行双定性,使定性结果更加可靠,有效排除假阳性结果。根据保留时间及碎片离子m/z对各杀虫剂进行分时段检测,并适当调整驻留时间,确保离子峰在对应时段内完全出峰。最后优化碰撞电压等质谱参数,使定量离子对灵敏度处于最优,优化结果详见表1。
在优化的仪器工作条件下,7种杀虫剂的定量色谱图见图1。
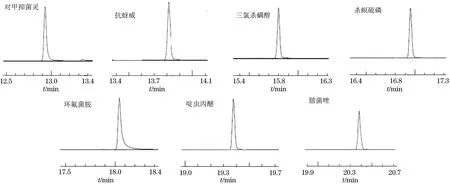
图1 7种杀虫剂的定量色谱图Fig.1 Quantitative chromatograms of 7 insecticides
2.3 前处理方法的优化
本工作采用乙腈提取各目标物,另加入1 g氯化钠和 4 g无水硫酸镁促进各杀虫剂分离,采用PSA、硫酸镁和GCB净化样品。相较传统的液液萃取法和固相萃取法,QuEChERS所用试剂量少,萃取及净化时间短,且检测结果准确度高,但是净化剂对部分目标物(对甲抑菌灵、环氟菌胺)有吸附作用,导致其回收率偏低, 在实际使用过程中需根据食用花卉的成分及色素量控制净化剂的加入量。除此之外,本工作以QuEChERS自动样品制备系统同步完成了样品的提取、净化,缩短了前处理时间,提高了工作效率。
2.4 基质效应
样品基质可能对分析物测定产生干扰,进而影响测定方法的准确度。消除或补偿基质效应的方法有基质净化法、基质匹配法等。采用基质净化法时,由于食用花卉样品基质较为复杂,会引起部分杀虫剂(杀螟硫磷、环氟菌胺和腈菌唑)损失,导致其回收率偏低;基质匹配法可以模拟样品基质,补偿受基质影响的杀虫剂的吸附或降解损失。配制0.1 mg·L-1加标样品溶液,分别采用纯溶剂标准曲线法和基质匹配工作曲线法测定。结果显示:三氯杀螨醇、腈菌唑、对甲抑菌灵、环氟菌胺、抗蚜威、杀螟硫磷和啶虫丙醚的质量浓度分别为0.086 9,0.125 6,0.0852 4, 0.127 4,0.120 1,0.128 9,0.085 01 mg·L-1和0.098 96,0.010 02,0.011 25, 0.010 38, 0.099 97,0.099 68,0.101 7 mg·L-1,前者所得测定值和理论值偏差较大,且腈菌唑、环氟菌胺、杀螟硫磷和啶虫丙醚等4种杀虫剂出现严重拖尾现象,而后者所得测定值和理论值更接近。因此,试验选择采用基质匹配法定量。
2.5 工作曲线、检出限和测定下限
按照仪器工作条件测定基质匹配混合标准溶液系列,以各目标物的质量浓度为横坐标,其对应的峰面积为纵坐标绘制工作曲线。结果显示:各目标物工作曲线的线性范围均为0.005~5.0 mg·L-1,其他线性参数见表2。
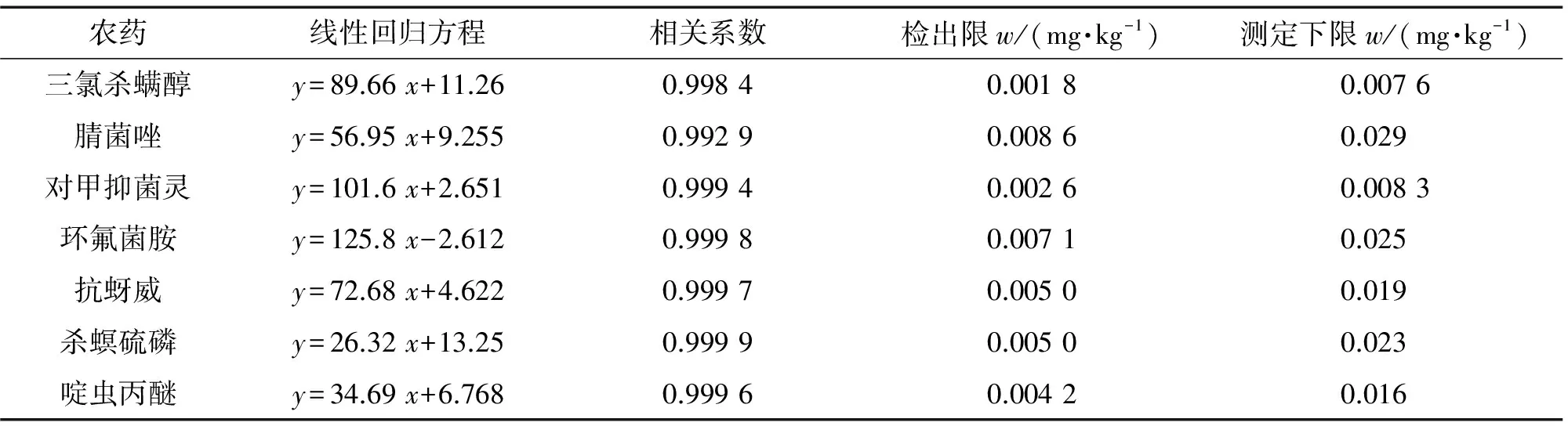
表2 线性参数、检出限和测定下限
采用空白样品加标的方法,以3, 10倍信噪比(S/N)对应的加标量计算检出限(3S/N)和测定下限(10S/N),结果见表2。
2.6 精密度与回收试验
以可食玫瑰、菊花和桃花3种食用花卉为待测对象进行加标回收试验,每个浓度水平均平行处理6份样品,计算回收率和测定值的相对标准偏差(RSD),结果见表3。
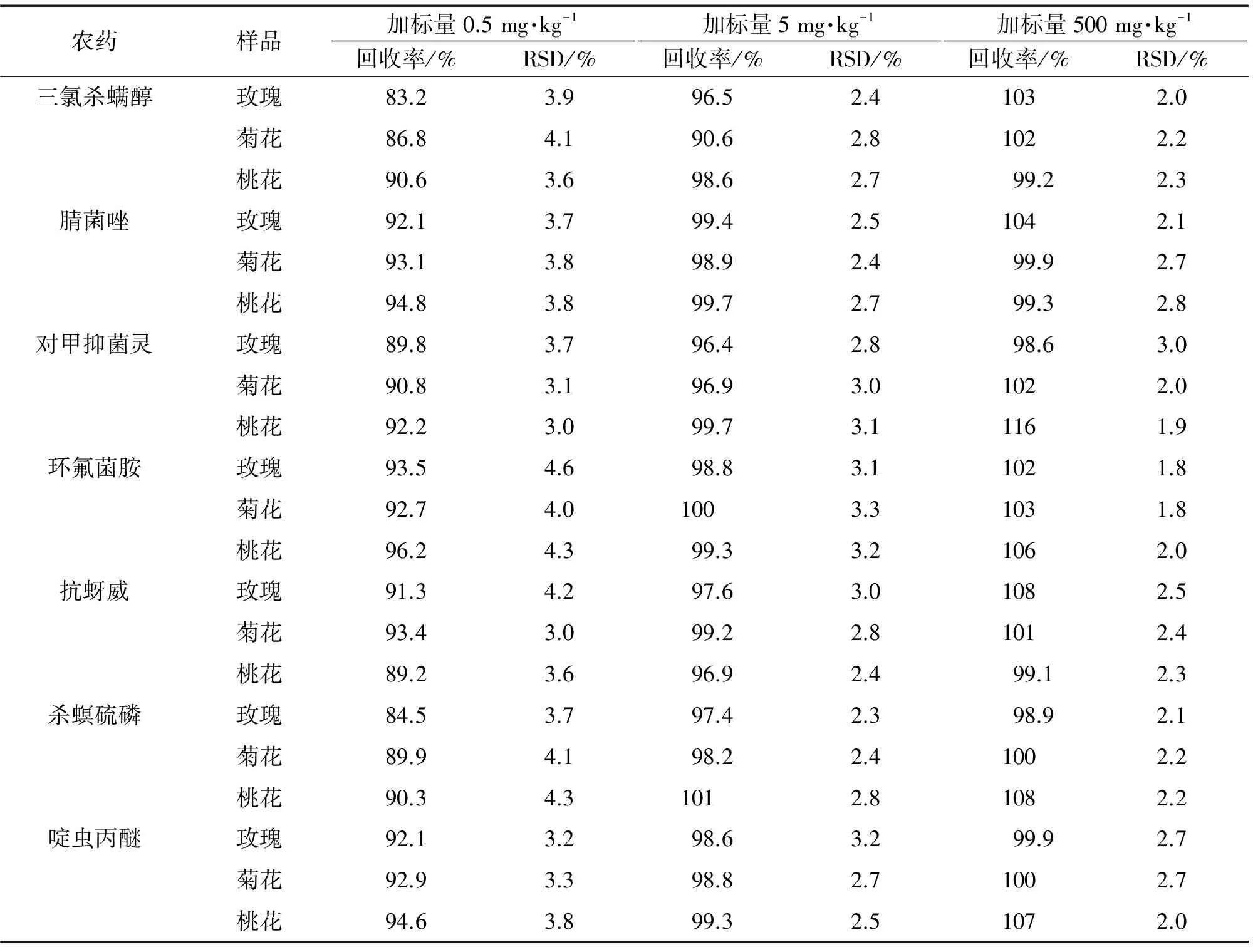
表3 精密度和回收试验结果 (n=6)
由表3可知:3种食用花卉中7种杀虫剂的回收率为83.2~116%,测定值的RSD均小于5.0%,说明方法的准确度和精密度良好。
2.7 样品分析
采用本方法分析在市场上3处不同销售点销售的玫瑰、菊花和桃花等9批食用花卉。结果显示:三氯杀螨醇检出率较高,其中有一批菊花中的检出量(0.013 mg·kg-1)超过测定下限;其余杀虫剂暂未检出。
本工作采用QuEChERS自动样品制备系统同步提取、净化食用花卉中7种杀虫剂,采用GC-MS/MS测定其含量。该方法自动化程度高、定量准确,为食用花卉中农药残留的监测提供了一种新的测试方法。

