金合欢素通过调节Sirt1介导的AMPK/Nrf2信号通路改善肺炎链球菌感染引起的肺泡上皮细胞损伤
范彩霞 张宗林 伏瑶 姜红 (.临沂市人民医院临床药理研究中心,临沂 76000;.临沂市人民医院药学部,临沂 76000; .临沂市人民医院中心实验室,临沂 76000)
肺炎链球菌(Streptococcus pneumonia,SP)是定植于人体上呼吸道的革兰阳性双球菌,人体免疫力减退时可感染肺泡上皮细胞,导致其损伤凋亡,是引发社区获得性肺炎的主要致病原因,严重时会引起败血症[1-2]。机体免疫系统参与介导SP对肺泡上皮细胞的感染过程,免疫细胞活化引发促炎因子与抗炎因子表达失衡,导致持续性炎症和高水平氧化应激,是肺泡上皮细胞受损的主要病理基础,抗炎、抗氧化治疗是减轻肺泡上皮细胞损伤,改善SP所致肺炎的有效方法[3-4]。沉默信息调节因子相关酶1(sirtuin 1,Sirt1)生物学作用广泛,与细胞衰老、自噬、增殖、凋亡等密切相关,可通过激活5'-磷酸腺苷激活的蛋白激酶(5'-AMP activated protein kinase,AMPK)信号促进自噬,降低氧化和内质网应激,抑制炎症,减轻糖尿病引发的肾损伤,还可激活核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)信号减轻肺组织炎症和氧化应激,缓解过敏性气道炎症,因此Sirt1与AMPK/Nrf2是防治SP所致肺炎的潜在作用靶点[5-6]。金合欢素是广泛存在于天然植物的黄酮类化合物,具有多重药理功效,如广谱抗菌消炎、减轻过氧化与应激反应、增强免疫功能等,是治疗新冠肺炎中药方剂黄芪六君子汤的关键成分,可通过激活Sirt1/AMPK信号减轻氧化应激、凋亡和炎症反应,治疗心肌肥厚,可作为防治SP所致肺炎的潜在药物[7-9]。本研究通过SP感染体外培养的A549细胞,探讨金合欢素通过调节Sirt1介导的AMPK/Nrf2信号通路对SP感染引起的肺泡上皮细胞损伤的影响。
1 材料与方法
1.1 材料 人肺泡上皮细胞A549(STR鉴定正确,货号:CL-0016)、胎牛血清(货号:164210-500)、Ham's F-12K(货号:PM150910)、青-链霉素(货号:PB180120)购自武汉普诺赛生命科技有限公司;SP(货号:6978)购自宁波明舟生物科技有限公司;SOD活性检测试剂盒(货号:ab65354)、丙二醛(malondialdehyde,MDA)检测试剂盒(货号:ab238537)、兔源Ki-67一抗(货号:ab92742)、CCK-8检测试剂盒(货号:ab228554)、兔源Bax一抗(货号:ab32503)、兔源caspase-9一抗(货号:ab32539)、BCA试剂盒(货号:ab102536)、人IL-1β、IL-10、TNF-α ELISA试剂盒(货号:ab214025、ab229436、ab181421)购自美国Abcam公司;兔源Sirt1一抗(货号:2496T)、兔源PCNA一抗(货号:13110T)、Annexin V-FITC/PI凋亡检测试剂盒(货号:V13242)购自美国Cell Signaling Technology公司;ROS检测试剂盒(货号:S0033S)、兔源GAPDH一抗(货号:AF1186)、RIPA裂解液(货号:P0013K)、兔源AMPK一抗(货号:AF6195)、兔源p-AMPK一抗(货号:AF5908)、兔源Nrf2一抗(货号:AF7623)、辣根过氧化物酶标记的山羊抗兔IgG(货号:A0208)购自上海碧云天公司;SpectraMaxM5多功能酶标仪购自美谷分子仪器有限公司;DYCZ-24KF电泳仪购自北京六一生物科技有限公司;MiniBlotTM蛋白转膜系统购自上海碧云天公司;MoFlo AstriosEQ流式细胞仪购自美国贝克曼库尔特公司。
1.2 方法
1.2.1 细胞损伤模型构建及金合欢素最佳作用浓度筛选 37 ℃水浴快速融化A549细胞,培养基(Ham's F-12K+10%胎牛血清+1%青-链霉素)复苏培养,SP菌株以血平板培养,制成1×108CFU/ml菌液,传代后的A549细胞接种于96孔板,培养12 h,以终浓度0、5、25、50、100、150、200 μmol/L的金合欢素处理细胞48 h[10],每个浓度设6孔,并选6孔不接种细胞做空白对照,未以金合欢素处理的细胞作为对照组,以终浓度1×108CFU/ml SP菌液感染细胞构建细胞损伤模型[11],24 h后加入CCK-8处理1 h,酶标仪测量450 nm波长下各孔吸光度(A),细胞活力(%)=(A药物处理组-A空白对照组)(/A对照组-A空白对照组)×100%,筛选金合欢素最佳作用浓度。
1.2.2 分组处理细胞及标本收集 取传代的A549细胞接种于24孔板培养,随机分为对照组、模型组、金合欢素组、EX527组、金合欢素+EX527组。细胞生长12 h后,金合欢素组以终浓度150 μmol/L金合欢素处理;EX527组细胞以终浓度40 μmol/L Sirt1抑制剂EX527处理[12];金合欢素+EX527组细胞以终浓度150 μmol/L金合欢素处理,同时以终浓度40 μmol/L EX527处理;对照组和模型组细胞不做处理,各组均处理48 h,除对照组外,其余各组以终浓度1×108CFU/ml SP菌液感染细胞构建细胞损伤模型,继续培养24 h分别收集各组细胞和各组细胞培养液。
1.2.3 检测各组细胞增殖和凋亡 取传代培养的A549细胞接种于96孔板,培养12 h,以1.2.2方法分组处理,CCK-8检测各组细胞活力,步骤同1.2.1。取1.2.2收集的各组细胞,PBS重悬,加入Annexin V-FITC和PI避光孵育,离心后洗涤细胞沉淀,再次PBS重悬混匀后流式细胞仪检测。
1.2.4 各组细胞ROS、MDA、SOD、LDH水平及其产生的IL-10、IL-1β、TNF-α水平检测 取1.2.2收集的各组细胞,加入RIPA裂解液冰水浴中提取总蛋白,离心,BCA测量上清中总蛋白浓度,各组取0.2 ml,采用试剂盒测定ROS、MDA、SOD、LDH水平,剩余蛋白样品用于免疫印迹检测。取1.2.2收集的各组细胞培养液,离心后各组取0.2 ml上清,采用试剂盒测定其中IL-10、IL-1β、TNF-α水平。
1.2.5 测定各组细胞Sirt1蛋白、增殖、凋亡相关蛋白、AMPK/Nrf2信号通路相关蛋白表达 取1.2.4中各组剩余的蛋白样品20 μg,变性(100 ℃煮沸5 min)、电泳(120 V恒压80 min)、湿转(120 V恒压90 min)、3%牛血清白蛋白封闭(37.5 ℃孵育2 h),剪下目的蛋白Ki-67、PCNA、caspase-9、Bax、Sirt1、p-AMPK、GAPDH、AMPK、Nrf2,孵育兔源一抗(4 ℃孵育10 h)、洗涤(TBST洗3次,5 min/次)、孵育二抗(37.5 ℃孵育2.5 h)、洗涤(TBST洗3次,5 min/次)、显影(化学发光法)、拍照,Image J软件定量各蛋白灰度并计算其与内参GAPDH的比值,统计学分析可得各组蛋白相对表达。
1.3 统计学分析 数据均以±s表示,计量数据利用SPSS24.0软件进行统计学分析,两组间比较行t检验;组间比较采用单因素方差分析,进一步两两比较行LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 金合欢素对SP感染的A549细胞增殖的影响 金合欢素可促进SP感染的A549细胞生长增殖,一定浓度范围内,浓度越高,细胞活力越强,浓度达到150 μmol/L时,A549细胞生长进入平台期,几乎不再促进其增殖(图1),因此后续实验选择150 μmol/L金合欢素处理SP感染的A549细胞。

图1 不同浓度金合欢素对SP感染的A549细胞活力的影响Fig.1 Effect of different concentration of acacetin on activity of A549 cells infected by SP
2.2 金合欢素对各组A549细胞增殖与凋亡的影响 与对照组比较,模型组A549细胞活力降低(P<0.05),凋亡率升高(P<0.05)。与模型组、金合欢素+EX527组分别比较,金合欢素组A549细胞活力均升高(P<0.05),凋亡率均降低(P<0.05);EX527组A549细胞活力均降低(P<0.05),凋亡率均升高(P<0.05,图2、表1)。
表1 各组A549细胞活力与凋亡率(±s,n=6)Tab.1 Viability and apoptosis rate of A549 cells in each group (±s,n=6)

表1 各组A549细胞活力与凋亡率(±s,n=6)Tab.1 Viability and apoptosis rate of A549 cells in each group (±s,n=6)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with acacetin+EX527 group,3)P<0.05.
Groups Control Model Acacetin EX527 Acacetin+EX527 Cell viability/%Apoptosis rate/%2.07±0.30 61.48±5.051)12.02±2.622)3)80.79±10.132)3)56.03±7.11 100.00±0.00 40.75±8.021)89.91±10.342)3)21.86±3.522)3)45.14±8.47
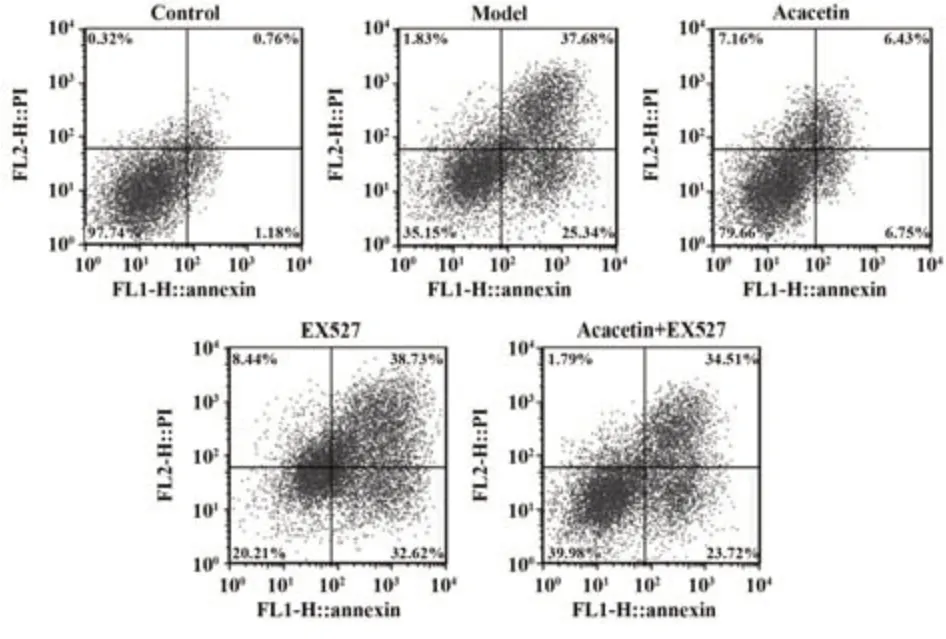
图2 流式细胞术检测A549细胞凋亡Fig.2 Apoptosis of A549 cells detected by flow cytometry
2.3 金合欢素对各组A549细胞SOD、LDH、ROS水平的影响 与对照组比较,模型组A549细胞SOD水平降低(P<0.05),MDA、LDH与ROS水平升高(P<0.05)。与模型组、金合欢素+EX527组分别比较,金合欢素组A549细胞SOD水平均升高(P<0.05),MDA、LDH与ROS水平均降低(P<0.05);EX527组A549细胞SOD水平均降低(P<0.05),MDA、LDH与ROS水平均升高(P<0.05,表2)。
表2 各组A549细胞SOD、LDH与ROS水平(±s,n=6)Tab.2 SOD, LDH and ROS levels of A549 cells in each group (±s,n=6)
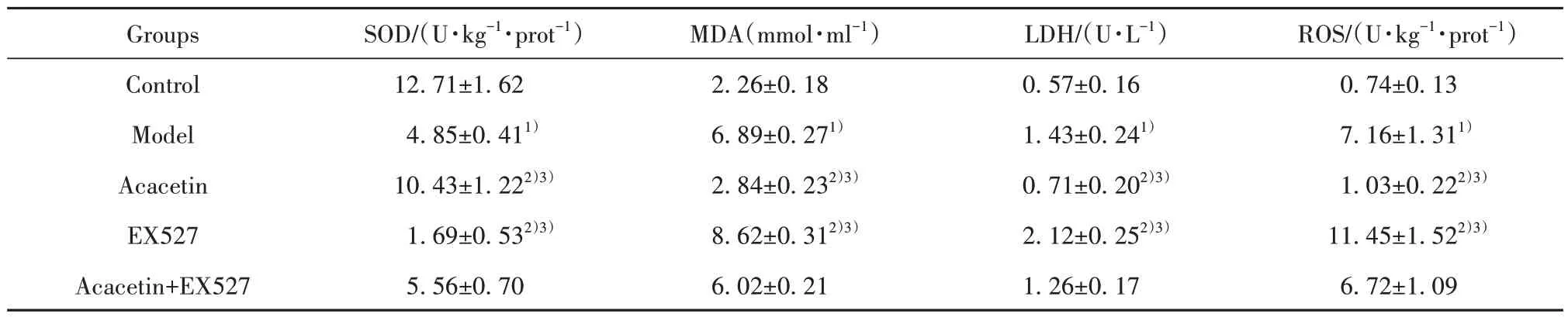
表2 各组A549细胞SOD、LDH与ROS水平(±s,n=6)Tab.2 SOD, LDH and ROS levels of A549 cells in each group (±s,n=6)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with acacetin+EX527 group,3)P<0.05.
ROS/(U·kg-1·prot-1)0.74±0.13 7.16±1.311)1.03±0.222)3)11.45±1.522)3)6.72±1.09 Groups Control Model Acacetin EX527 Acacetin+EX527 SOD/(U·kg-1·prot-1)12.71±1.62 4.85±0.411)10.43±1.222)3)1.69±0.532)3)5.56±0.70 MDA(mmol·ml-1)2.26±0.18 6.89±0.271)2.84±0.232)3)8.62±0.312)3)6.02±0.21 LDH/(U·L-1)0.57±0.16 1.43±0.241)0.71±0.202)3)2.12±0.252)3)1.26±0.17
2.4 金合欢素对各组A549细胞产生IL-10、IL-1β、TNF-α水平的影响 与对照组比较,模型组A549细胞产生IL-10的水平降低(P<0.05),IL-1β与TNF-α水平升高(P<0.05)。与模型组、金合欢素+EX527组分别比较,金合欢素组A549细胞产生IL-10的水平升高(P<0.05),IL-1β与TNF-α水平均降低(P<0.05);EX527组A549细胞产生IL-10的水平均降低(P<0.05),IL-1β与TNF-α水平均升高(P<0.05)。见表3。
表3 各组A549细胞产生IL-10、IL-1β、TNF-α的水平(±s,n=6,pg/ml)Tab.3 IL-10, IL-1β and TNF-α levels produced by A549 cells in each group (±s,n=6,pg/ml)

表3 各组A549细胞产生IL-10、IL-1β、TNF-α的水平(±s,n=6,pg/ml)Tab.3 IL-10, IL-1β and TNF-α levels produced by A549 cells in each group (±s,n=6,pg/ml)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with acacetin+EX527 group,3)P<0.05.
TNF-α 130.52±20.30 494.65±46.181)141.03±24.612)3)675.93±60.352)3)480.74±50.16 Groups Control Model Acacetin EX527 Acacetin+EX527 IL-10 280.73±30.14 52.69±5.211)267.12±32.352)3)18.31±4.232)3)60.45±6.17 IL-1β 23.79±5.14 96.85±11.021)29.83±4.912)3)152.78±17.352)3)87.96±12.03
2.5 金合欢素对各组A549细胞增殖与凋亡相关蛋白表达的影响 与对照组比较,模型组A549细胞增殖相关蛋白Ki-67与PCNA表达降低(P<0.05),凋亡相关蛋白caspase-9与Bax表达升高(P<0.05)。与模型组、金合欢素+EX527组分别比较,金合欢素组A549细胞增殖相关蛋白Ki-67与PCNA表达均升高(P<0.05),凋亡相关蛋白caspase-9与Bax表达均降低(P<0.05);EX527组A549细胞增殖相关蛋白Ki-67与PCNA表达均降低(P<0.05),凋亡相关蛋白caspase-9与Bax表达均升高(P<0.05,图3、表4)。
表4 各组A549细胞增殖与凋亡相关蛋白表达(±s,n=6)Tab.4 Proliferation and apoptosis related proteins expressions of A549 cells in each group (±s,n=6)
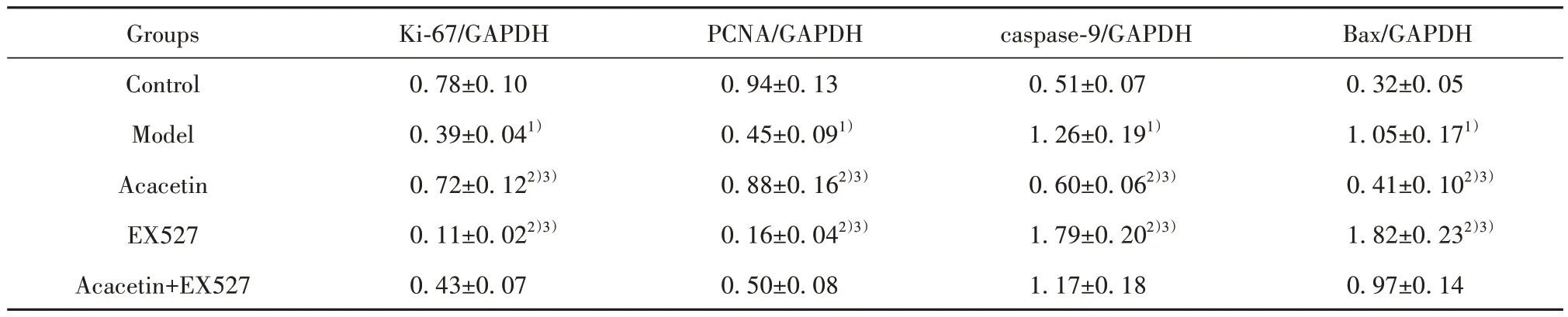
表4 各组A549细胞增殖与凋亡相关蛋白表达(±s,n=6)Tab.4 Proliferation and apoptosis related proteins expressions of A549 cells in each group (±s,n=6)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with acacetin+EX527 group,3)P<0.05.
Groups Control Model Acacetin EX527 Acacetin+EX527 Ki-67/GAPDH PCNA/GAPDH caspase-9/GAPDH Bax/GAPDH 0.32±0.05 1.05±0.171)0.41±0.102)3)1.82±0.232)3)0.97±0.14 0.78±0.10 0.39±0.041)0.72±0.122)3)0.11±0.022)3)0.43±0.07 0.94±0.13 0.45±0.091)0.88±0.162)3)0.16±0.042)3)0.50±0.08 0.51±0.07 1.26±0.191)0.60±0.062)3)1.79±0.202)3)1.17±0.18

图3 免疫印迹检测各组细胞增殖与凋亡相关蛋白表达Fig.3 Western blot detects expressions of cell proliferation and apoptosis related proteins in each group
2.6 金合欢素对各组A549细胞Sirt1与AMPK/Nrf2信号通路蛋白表达的影响 与对照组比较,模型组A549细胞p-AMPK/AMPK、Sirt1与Nrf2蛋白表达降低(P<0.05)。与模型组、金合欢素+EX527组分别比较,金合欢素组A549细胞p-AMPK/AMPK、Sirt1与Nrf2蛋白表达均升高(P<0.05);EX527组A549细胞p-AMPK/AMPK、Sirt1与Nrf2蛋白表达均降低(P<0.05,图4、表5)。
表5 各组A549细胞Sirt1与AMPK/Nrf2信号通路蛋白表达(±s,n=6)Tab.5 Sirt1 and AMPK/Nrf2 signaling pathway proteins expressions in A549 cells of each group (±s,n=6)

表5 各组A549细胞Sirt1与AMPK/Nrf2信号通路蛋白表达(±s,n=6)Tab.5 Sirt1 and AMPK/Nrf2 signaling pathway proteins expressions in A549 cells of each group (±s,n=6)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with acacetin+EX527 group,3)P<0.05.
Nrf2/GAPDH 1.13±0.21 0.52±0.101)1.02±0.172)3)0.22±0.042)3)0.59±0.09 Groups Control Model Acacetin EX527 Acacetin+EX527 Sirt1/GAPDH 0.82±0.10 0.41±0.061)0.77±0.122)3)0.13±0.032)3)0.46±0.05 p-AMPK/AMPK 0.96±0.13 0.47±0.071)0.90±0.142)3)0.15±0.042)3)0.51±0.06

图4 免疫印迹检测各组A549细胞Sirt1与AMPK/Nrf2信号通路蛋白表达Fig.4 Western blot detects expressions of Sirt1 and AMPK/Nrf2 signaling pathway proteins in A549 cells of each group
3 讨论
SP感染所致肺炎发病率逐年升高,严重影响患者的工作和日常活动,降低其生活质量,已成为我国急需解决的公共卫生问题,抗生素治疗是临床常选策略,但因抗药性对部分患者疗效不佳,研发非抗生素类药物更有临床价值[13-14]。作为人类呼吸道的天然定植菌,SP感染上皮细胞可激活机体免疫反应,促进炎症基因表达,打破氧化还原稳态,引发持续炎症与氧化应激,损伤肺泡上皮细胞,是造成肺炎的主要病理基础,抑制SP感染的肺泡上皮细胞炎症和凋亡是防治SP肺炎的良好途径[15-16]。本文以SP感染A549细胞模拟以上病理过程,结果显示A549细胞被SP感染后,产生的抗炎因子IL-10及抗氧化酶SOD水平明显降低,促炎因子IL-1β、TNF-α水平与ROS水平明显升高,引发强烈炎症及高水平氧化应激,导致MDA、LDH水平升高,最终造成细胞活力降低、损伤凋亡,揭示细胞损伤模型建立成功,可在细胞水平模拟SP肺炎病理过程。
金合欢素是金合欢树、黄芩、菊花等天然植物中提取纯化的化合物,是一种天然抗炎抗氧化剂,在柴胡-黄芩治疗COVID-19所致肺炎过程中发挥重要作用,可通过调控TNF、IL-17等炎症信号抑制炎症和细胞凋亡、减轻肺损伤[7,17]。本实验以金合欢素处理SP感染的A549细胞,可提高细胞产生的抗炎因子IL-10及抗氧化酶SOD水平,降低促炎因子IL-1β、TNF-α、MDA水平与ROS水平,拮抗炎症与氧化应激反应发生发展,增强细胞活力,抑制细胞凋亡,改善细胞损伤,提示金合欢素可通过抗炎与抗氧化功效减轻SP感染的肺泡上皮细胞损伤。
AMPK/Nrf2是调控机体氧化还原稳态与炎症基因表达的重要信号途径,促进其传导可减少促炎因子释放、降低氧化应激和炎症水平,抑制肺细胞凋亡,进而减轻铅诱导的肺损伤[18]。Sirt1也是一种重要的炎症调控分子,可通过抑制NF-κB信号减轻神经炎症,还可激活AMPK和Nrf2信号清除ROS,发挥抗细胞凋亡作用[19-20]。本研究结果显示,SP感染的A549细胞p-AMPK/AMPK、Sirt1、Nrf2蛋白表达均明显降低,Sirt1抑制剂EX527处理可促进炎症与氧化应激发展,加重细胞损伤,说明Sirt1通过调控AMPK/Nrf2信号介导SP感染的肺泡上皮细胞损伤过程。本实验结果表明金合欢素可提高SP感染的A549细胞p-AMPK/AMPK、Sirt1、Nrf2蛋白表达,金合欢素与EX527联合处理SP感染的A549细胞可降低金合欢素的抗炎、抗氧化功效,减弱其对A549细胞凋亡的抑制作用,逆转金合欢素的细胞保护作用,揭示金合欢素减轻SP感染引发的A549细胞损伤是通过上调Sirt1表达,激活AMPK/Nrf2信号实现的。
总之,本实验证明金合欢素可通过上调Sirt1表达促进AMPK/Nrf2信号传导,进而提高抗炎因子及抗氧化酶水平,降低促炎因子水平,减弱氧化应激与炎症反应,最终增强肺泡上皮细胞活力,抑制其损伤凋亡,通过介导Sirt1激活AMPK/Nrf2信号是其分子机制之一。本研究揭示金合欢素可作为防治SP肺炎的候选药物,在临床治疗中具有很好的发展前景。

