FBXW7/MCM7信号轴介导肝癌细胞增殖的研究*
李英, 王兴, 李永宁, 刘鹏, 刘松柏, 潘耀振
(贵州医科大学附属肿瘤医院 肝胆外科, 贵州 贵阳 550000)
肝细胞肝癌(hepatocellular carcinoma, HCC)是消化系统常见的恶性肿瘤之一,每年约超过 905 000例新发病例和830 000例死亡病例,是全球第六位常见的恶性肿瘤和第三大癌症相关的死亡原因[1]。随着肝移植、放化疗、靶向免疫等治疗方法的发展,肝癌的临床预后有所改善[2-4]。但由于早期检测手段缺乏、病程进展迅速、肿瘤细胞恶性程度高及增殖能力强,多数肝癌发现时已处于中晚期阶段,丧失根治性手术时机,且传统放化疗效果较差[5],故探讨肝癌发生发展的分子机制对肝癌的临床诊治具有重要意义。含F-box和WD重复结构域蛋白7(F-box and WD repeat domain-containing protein 7,FBXW7)作为肿瘤抑制因子已在多种类型肿瘤的研究中被报道,FBXW7可抑制肿瘤细胞的增殖与转移,与患者的临床预后呈正相关[6]。本课题组前期研究表明,FBXW7在肝癌组织中的表达高于癌旁非肿瘤组织,过表达FBXW7后显著抑制了肝癌细胞的迁移侵袭能力[7]。结合近期实验结果及预测分析发现,微小染色体维持蛋白-7 (minichromosome maintenance complex component 7, MCM7)可能作为FBXW7的潜在靶点,在肝癌生物学功能的调控中发挥重要作用。Qu等[8]研究也表明MCM7可促进肝癌细胞增殖并可作为肝癌不良预后的预测因子,但其具体的调控机制仍鲜有研究。本研究将主要探讨肝癌细胞中FBXW7对MCM7的调控作用及对肝癌细胞增殖的影响。
1 材料与方法
1.1 实验材料
1.1.1细胞株 人肝癌细胞系MHCC-97H购自上海生科院细胞资源中心。
1.1.2主要试剂 胎牛血清、DMEM培养基及胰蛋白酶购自Gibco公司;青、链霉素双抗购自Hyclone公司;FBXW7抗体购自Abcam公司;MCM7抗体购自武汉三鹰公司;GAPDH抗体、羊抗鼠及羊抗兔二抗购自博士德公司;Alexa Fluor 488和CoraLite594荧光二抗购自赛默飞公司;Protein A+G Agarose Beads购自碧云天公司;CCK-8试剂盒为日本同仁产品;siRNA转染试剂盒购自锐博生物公司;FBXW7及MCM7过表达慢病毒质粒由吉凯基因构建及包装。
1.2 研究方法
1.2.1细胞培养与分组 MHCC-97H细胞用含10%胎牛血清和1%青、链霉素双抗的DMEM培养基,于37 ℃、5%CO2的恒温培养箱中常规培养。首先,通过感染过表达慢病毒质粒及对照空载体病毒将细胞分为4组:对照空载体组(Vector组)、FBXW7过表达组(FBXW7组)、对照空载体与MCM7过表达病毒质粒共感染组(Vector+MCM7组)、FBXW7过表达病毒质粒与MCM7过表达病毒质粒共感染组(FBXW7+MCM7组)。其次,siRNA转染MHCC-97H细胞下调FBXW7和(或)MCM7的表达,将细胞分为4组:空载体组(NC组)、FBXW7下调组(siFBXW7组)、空载体与MCM7下调序列共转染组(NC+siMCM7组)、FBXW7与MCM7表达同时下调组(siFBXW7+siMCM7组)。
1.2.2FBXW7与MCM7蛋白互作关系检测 采用免疫共沉淀(co-immunoprecipitation,Co-IP)实验,细胞中加入NP40裂解液(含10 μL蛋白酶抑制剂500 μL、磷酸酶抑制剂10 μL、PMSF 5 μL )提取总蛋白。蛋白提取物加入 Protein A+G Agarose Beads 20 μL于4 ℃摇床孵育2 h进行预纯化。将纯化后的提取物分为3份,分别为IgG纯化抗体孵育组(IP-IgG组)、FBXW7抗体孵育组(IP-FBXW7组)及对照组(Input组),置于4 ℃摇床孵育过夜。IgG组和FBXW7组各自加入Protein A+G Agarose Beads 40 μL 于4 ℃孵育4 h,离心收集沉淀,加入2×蛋白上样缓冲液,100 ℃变性5 min。采用SDS-PAGE凝胶电泳对结合蛋白进行检测。
1.2.3FBXW7与MCM7共定位分析 采用免疫荧光(immunofluorescence staining, IF)共定位实验,收集细胞进行细胞爬片,待贴壁后PBS洗3遍,4%多聚甲醛固定30 min,破膜剂室温破膜20 min,5%牛血清白蛋白封闭30 min,加入FBXW7和MCM7一抗溶液于4 ℃孵育过夜。PBST洗3遍后加入Alexa Fluor 488和CoraLite594荧光二抗,室温避光孵育1 h,滴加DAPI染料室温避光孵育5 min,洗去多余的染料后滴加封片剂封片,荧光显微镜下观察FBXW7和MCM7在肝癌细胞中表达分布情况。
1.2.4MCM7蛋白表达检测 通过Western blot实验分析FBXW7对MCM7表达的影响。采用RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度。行10% SDS-PAGE凝胶电泳分离蛋白,电泳结束将蛋白条带湿转至PVDF膜上,用5%脱脂牛奶室温封闭2 h。封闭后分别将目的条带放入对应的一抗溶液中4 ℃摇床孵育过夜。TBST洗去膜表面一抗后,放入二抗溶液中室温孵育1 h。采用ECL法对条带进行显影,以GAPDH作为内参计算目的蛋白的相对表达量。
1.2.5CCK-8细胞活性检测 细胞消化计数,96孔板内每孔接种4 000个细胞,每组设5个复孔。分别于细胞贴壁后的24 h、48 h及72 h检测各组细胞的吸光度值。检测时每孔加入110 μL经无血清培养基稀释的CCK-8液(无血清培养基∶CCK-8液=10∶1),37 ℃温箱孵育2 h后在酶标仪下检测波长450 nm处的吸光度值,观察各组细胞增殖活性的变化。
1.2.6EdU细胞增殖检测 按操作说明将细胞接种于96 孔板中,待细胞贴壁后加入EdU试剂(50 μmol/L)孵化2 h,4%多聚甲醛固定30 min,再加入Apollo Dye Solution染色30 min,细胞核用DAPI染色5 min。于荧光显微镜下观察并采集图片,计算EdU阳性细胞百分比。
1.2.7细胞集落形成数检测 采用平板克隆实验,细胞消化计数,按2×103个/孔接种于6孔板中,补加培养基至2 mL。使细胞均匀的分布于孔板中,放于细胞培养箱常规培养,定期观察细胞集落形成情况。培养10~14 d后,4%多聚甲醛固定30 min,1%结晶紫染色30 min,PBS清洗后烘干拍照,统计细胞集落形成数量。
1.3 统计学分析
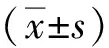
2 结果
2.1 FBXW7与MCM7在蛋白水平存在结合关系
结果显示,用FBXW7抗体特异性免疫沉淀FBXW7蛋白时,可同时检测到MCM7蛋白的表达(图1A);FBXW7与MCM7在细胞中的表达主要共定位在细胞核(图1B)。上述结果表明FBXW7与MCM7之间存在相互作用的可能。

注:A为Co-IP实验结果;B为IF共定位结果 (400×)
2.2 过表达FBXW7对肝癌细胞中MCM7蛋白表达的影响
与Vector组比较,过表达FBXW7后,FBXW7组细胞中MCM7的表达水平明显降低(P<0.001);与Vector+MCM7组相比,在MCM7表达水平上调的基础上同时过表达FBXW7后,FBXW7+MCM7组细胞中MCM7蛋白的表达明显降低(P=0.002);结果提示过表达FBXW7可抑制肝癌细胞中MCM7的蛋白表达水平。见图2。

注:A为蛋白免疫印迹实验结果;B为蛋白相对表达量统计图;与Vector组比较, (1)P<0.01,(2) P<0.001;(3)与Vector+MCM7比较, P<0.01。
2.3 敲低FBXW7对肝癌细胞中MCM7蛋白表达的影响
与NC组相比,下调FBXW7后,siFBXW7组细胞中MCM7的表达水平显著增加(P<0.001);与NC+siMCM7相比,抑制MCM7表达的同时下调FBXW7的表达后,siFBXW7+siMCM7组细胞中MCM7的表达水平明显增加(P=0.004);结果提示在肝癌细胞中FBXW7可调控靶蛋白MCM7的表达。见图3。

注:A为蛋白免疫印迹实验结果;B为蛋白相对表达量统计图;与NC组比较, (1)P<0.01,(2) P<0.001;(3)与NC+siMCM7比较,P<0.01。
2.4 过表达FBXW7调控MCM7对肝癌细胞增殖的影响
与Vector组相比,过表达FBXW7后,FBXW7组细胞增殖活性、EdU阳性细胞比例及集落形成数量均降低,差异具有统计学意义(P<0.05);Vector + MCM7组细胞的增殖活性、EdU阳性细胞比例及集落形成数量均增加,差异具有统计学意义(P<0.05);与Vector+MCM7组相比,FBXW7+MCM7组细胞的增殖能力降低,差异具有统计学意义(P<0.05)。见表1及图4。

表1 CCK-8实验比较各组细胞的增殖活性Tab.1 Analysis of the proliferation activity of cells in each group by CCK-8

注:A为EdU实验结果;B为平板克隆实验结果;与Vector组比较,(1)P<0.05, (2)P<0.01;与Vector+MCM7组比较,(3)P<0.05, (4)P<0.01。
2.5 敲低FBXW7调控MCM7对肝癌细胞增殖的影响
与NC组相比,siFBXW7组细胞的增殖活性、EdU阳性细胞比例及集落形成数量均增加(P<0.05);NC+siMCM7组细胞的增殖活性、EdU阳性细胞比例及集落形成数量均下降,差异均具有统计学意义(P<0.05)。与NC+siMCM7组对比,在抑制MCM7表达的同时干扰FBXW7的表达可增强siFBXW7+siMCM7组细胞的增殖能力,差异具有统计学意义(P<0.05)。上述结果提示FBXW7可调控MCM7的表达影响肝癌细胞的增殖能力。见表2、图5。

表2 CCK-8实验比较各组细胞的增殖活性Tab.2 Analysis of the proliferation activity of cells in each group by CCK-8

注:A为EdU实验结果;B为平板克隆实验结果;与NC组比较,(1)P<0.05, (2)P<0.01,(3)P<0.001;(4)与NC+siMCM7组比较, P<0.01。
3 讨论
HCC是肝癌最主要的组织学亚型,虽然通过临床和基础上的不断研究,发现了诱发HCC的多种风险因素和遗传变异[9-10],但由于治疗方法有限,其预后仍然较差,术后5年生存率仅达18%左右[1]。HCC相关的疾病症状通常直到疾病中晚期才出现,这也进一步限制了患者获得有效治疗的机会和降低了患者的存活率。因此,在表观分子水平上理解HCC的发生及发展,或有望发掘出新型潜在的药物靶点,为开发治疗肝癌的新型疗法提供理论基础。
FBXW7作为Cullin-RING E3泛素连接酶中SCF复合体(SKP1-CUL1-F-box)的成员之一,主要参与底物蛋白的特异性识别和结合[11]。FBXW7可抑制一系列关键癌基因的表达发挥抑癌作用,如c-Myc、cyclinE1、mTOR和Notch1等[12-15]。众多编码F-box蛋白的相关基因在临床肿瘤中的检测结果表明,在人类肿瘤细胞中FBXW7是这些基因中突变最频繁的[6]。在结直肠癌中FBXW7的突变率达10%,FBXW7突变或缺失的肿瘤组织中相关促癌基因的表达丰度增加、肿瘤细胞的恶性表型增强[16]。与之对应的在其他多种类型的肿瘤中也发现FBXW7的表达降低或功能缺失[17-19],进一步说明了FBXW7在肿瘤发生发展中有着重要的抑癌作用。
本研究基于前期数据进一步分析FBXW7影响肝癌细胞增殖的分子机制,Co-IP实验及IF共定位分析结果证实,MCM7是FBXW7的分子靶点。既往研究表明,MCM是DNA复制前复合物的重要组成部分,在DNA复制启动过程和DNA损伤修复中发挥着重要作用[20]。MCM复合体由6个高度保守的MCM蛋白组成,即MCM2~MCM7,与肿瘤的发生密切相关[21-23]。研究发现MCM7在近半数以上的临床肝癌样本中表达升高,并与肝内转移、血管侵犯及化疗耐药显著相关[24-25]。近期研究报道MCM7通过cyclin D1的信号转导促进肿瘤进展,可作为肝癌患者预后不良的标志物[8]。越来越多的证据表明MCM7在肝癌中起着重要作用,但MCM7发挥促癌功能和影响临床预后的分子机制仍有待阐明。
本研究通过基因干扰技术及功能学实验,初步探索了肝癌细胞中FBXW7对靶点MCM7 的表达及功能的调控作用。实验结果表明过表达FBXW7可显著抑制细胞中MCM7表达水平,发挥着抑制肝癌细胞增殖活性、EdU阳性细胞比例及集落形成能力的作用,而该抑制作用可被MCM7过表达而削减;敲低FBXW7后细胞中MCM7的表达明显增加,功能上表现为促进细胞增殖活性、EdU阳性细胞比例及集落形成能力,而同时下调MCM7后细胞的增殖能力被明显抑制。
综上所述,FBXW7可抑制肝癌细胞增殖能力,其机制可能与靶向MCM7并抑制其蛋白水平表达有关。本研究首次发现,FBXW7/MCM7信号轴对肝癌细胞增殖具有调控作用,为临床上肝癌的分子诊断和靶向治疗提供了新的思路和理论依据。

