木犀草素、欧当归内酯A和黄芪皂苷Ⅰ单用及联用对人肝星状细胞株LX-2增殖、活化的影响*
陆倩, 张金娟, 蒋先慧, 国小利, 廖尚高,3***
(1.贵州医科大学 药学院, 贵州 贵阳 550025; 2.贵州医科大学 基础医学院机能实验室, 贵州 贵阳 550025; 3.贵州医科大学 民族药与中药开发应用教育部工程研究中心/贵州省药物制剂重点实验室, 贵州 贵阳 550004)
肝纤维化(hepatic fibrosis,HF)是各种急慢性肝损伤引起的以炎症反应和细胞外基质(extracellular matrix,ECM)在肝脏中过度累积为主要损伤修复特点的病理过程[1],是各种慢性肝病向肝硬化乃至肝癌发展的中间环节[2]。HF的逆转可有效降低肝癌的发生率[3],但目前临床尚无有效的抗HF药物[4]。故寻找安全有效的HF治疗方法及药物成为临床急需解决的重要问题。HF的发展是多基因、多步骤作用的过程,中药可从多途径、多靶点发挥作用,在抗HF方面有着独特的优势[5-6]。与此同时,中医中药有着完备的理论体系和丰富的临床经验,故从中药资源宝库中寻找抗HF药物不失为一种有效途径。韦凌霞等[7]收集临床治疗HF的含当归中药复方,并对频数>10的中药进行系统聚类分析,发现丹参、当归、黄芪累计频次最高且聚为一类;此外,丹参、当归和黄芪存在于多种治疗HF的复方中,且占比较大,如扶肝化纤汤、复原化纤汤等[8]。课题组前期通过网络药理学对丹参、当归和黄芪的抗HF成分及其作用机制进行分析,结果显示木犀草素(luteolin, Lut)、欧当归内酯A(levistilide a, Lev)及黄芪皂苷Ⅰ(astragaloside Ⅰ, Ast)分别为丹参、当归和黄芪中的潜在核心抗HF活性成分;进一步对Lut、Lev及Ast的潜在抗HF靶点进行富集分析,发现3者既存在相同的抗HF靶点及通路,也存在不同的靶点及通路,并且均与促纤维化因子(transforming growth factor-β1,TGF-β1)相关;故而推测Lut、Lev及Ast 3个核心活性成分联用可能会产生协同抗HF作用。LX-2细胞是永生化的人肝星状细胞系,因其高转染性和在无血清培养基中的高生存能力被广泛用于体外HF的研究[9]。本研究拟考察Lut、Lev及Ast单用及联用对LX-2细胞增殖、活化的影响,以期为Lut、Lev和Ast联用治疗HF提供实验依据。
1 材料与方法
1.1 实验材料
人肝星状细胞株LX-2,(广州吉尼欧有限公司),Lut、Lev和Ase(成都埃法),DMEM高糖培养基(美国Gibco),0.25%胰蛋白酶(武汉赛维尔),胎牛血清(加拿大维森特),二甲基亚砜(dimethyl sulfoxide,DMSO)、噻唑蓝(methyl thiazolyl tetrazolium,MTT)试剂(北京索莱宝),α-smooth actin(α-SMA,南京巴傲得),TGF-β1(武汉爱博泰克),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH;上海优宁维)。
1.2 主要仪器
MS105DC型梅特勒-托利多十万分之一天平(北京赛多利斯),2001HY-6003型CO2细胞培养箱(美国ThermoFisher Scientific),酶标仪(美国Bio-Tek),SW-CJ-2D型超净工作台(苏州净化设备),DYY-6C型电泳仪(北京六一),TS-8型转移脱色摇床(海门其林贝尔)。
1.3 研究方法
1.3.1细胞培养 LX-2细胞使用含有10%胎牛血清和1%双抗(青霉素和链霉素)的DMEM高糖培养基(完全培养基)于37 ℃、5%CO2培养箱中培养,待细胞融合至80%~90%时传代培养,取对数生长期细胞用于后续试验。
1.3.2Lut、Lev及Ast对TGF-β1诱导LX-2细胞增殖的影响及联用比例确定 取对数生长期的LX-2细胞,以3 500个/孔接种于96孔板中,细胞培养24 h,吸弃培养液,加入不含胎牛血清的DMEM饥饿12 h。之后将细胞分为Con组(完全培养基)、TGF-β1组(10.00 μg/L TGF-β1)、SB431542不同剂量组(10.00 μg/L的TGF-β1分别加6.25、12.50、25.00、50.00、100.00 μmol/L的SB431542)、Lut不同剂量组(10.00 μg/L TGF-β1分别加6.25、12.50、25.00、50.00、100.00 μmol/L的Lut)、Lev不同剂量组(10.00 μg/L TGF-β1分别加6.25、12.50、25.00、50.00、100.00 μmol/L的Lev)、Ast不同剂量组(10.00 μg/L TGF-β1分别加6.25、12.50、25.00、50.00、100.00 μmol/L的Ast),每组6个复孔。各组细胞按各自药物和剂量加药后培养48 h,吸弃培养液,加入5 g/L MTT溶液20 μL,继续孵育4 h,弃尽孔中溶液,每孔加入 DMSO 100 μL,摇床振荡10 min。以只加完全培养基的孔作为调零孔,在酶标仪上测定490 nm波长处的吸光度(optical density, OD)。计算细胞增殖抑制率:细胞增殖抑制率(%)=[(ODTGFβ1组-OD实验组)/(ODTGFβ1组-OD调零孔)]×100%。使用Graph Pad Prism 8.0.1软件计算IC50,以Lut、Lev和Ast的IC50比值作为联用的比例。
1.3.3Lut、Lev及Ast联用对TGF-β1诱导的LX-2细胞增殖的影响 按照“1.3.2”所述方法进行实验,将细胞分为Con组(完全培养基)、TGF-β1组、SB431542组、联用组为10.00 μg/L TGF-β1分别与Lut+Lev、Lut+Ast、Lev+Ast、Lut+Lev+Ast的组合(Lut∶Lev∶Ast=1∶1∶10,以Lut为基准,将浓度设为0.94、1.88、3.75、7.50、15.00、30.00、60.00 μmol/L)。按照“1.3.2”所述方法测定OD并计算细胞增殖抑制率。
1.3.4Lut、Lev及Ast联用类型的分析 将Lut、Lev和Ast联用比例、浓度及对应的细胞增殖抑制率输入到CalcuSyn软件中,计算CI值,以CI值分析Lut、Lev和Ast联用类型,CI>1为拮抗作用,CI<1为协同作用,CI=1为加和作用。
1.3.5Western blot检测TGF-β1诱导的LX-2细胞中α-SMA蛋白的表达 取对数生长期的LX-2细胞,以2×105个/孔接种于6孔板中。细胞培养24 h,吸弃培养液,加入不含胎牛血清的DMEM饥饿12 h。之后将细胞分为Con组(完全培养基)、TGF-β1组(10.00 μg/L TGF-β1)、SB431542组(10.00 μg/L TGF-β1加15.00 μmol/L的SB431542)、Lut组(10.00 μg/L TGF-β1加15.00 μmol/L的Lut)、Lev组(10.00 μg/L TGF-β1加15.00 μmol/L的Lev)、Ast组(10.00 μg/L TGF-β1与150.00 μmol/L的Ast)、联用组(10.00 μg/L TGF-β1分别与Lut+Lev、Lut+Ast、Lev+Ast、Lut+Lev+Ast组合)。各组细胞按各自药物和剂量加药后培养48 h,经细胞蛋白裂解液裂解,BCA蛋白浓度测定试剂盒定量。SDS-PAGE凝胶进行电泳,常规方法进行转膜、封闭后,一抗4 ℃孵育过夜。TBST洗膜(10.00 min/次、×3次),加入辣根过氧化物酶标记的羊抗兔IgG(二抗)室温孵育2 h,洗膜。用ECL发光试剂盒显影,采用Image J软件分析。以GAPDH灰度值进行校正,计算α-SMA蛋白的相对表达量。
1.3.6Western blot检测LX-2细胞中TGF-β1蛋白的表达 取对数生长期的LX-2细胞,以2×105个/孔接种于6孔板中。细胞培养24 h后,分为Con组(完全培养基)、SB431542组(30.00 μmol/L)、Lut组(30.00 μmol/L)、Lev组(30.00 μmol/L)、Ast组(300.00 μmol/L)、联用组为(Lut+Lev、Lut+Ast、Lev+Ast、Lut+Lev+Ast组合)。按照“1.3.5”所述方法进行实验,计算TGF-β1蛋白的相对表达量。
1.4 统计学方法
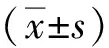
2 结果
2.1 Lut、Lev及Ast对TGF-β1诱导LX-2细胞增殖的影响及联用比例确定
与Con组比较,TGF-β1组细胞增殖明显(P<0.01);与TGF-β1组比较,各给药组对细胞增殖具有显著的抑制作用(P<0.01);且抑制率都随浓度的增加而升高,具有浓度依赖性。Lut、Lev及Ast的IC50分别为38.60、34.40及303.80 μmol/L,确定Lut、Lev及Ast联用摩尔比为1∶1∶10。不同剂量药物组细胞存活率见图1。

注:A~D分别为不同浓度SB431542、Lut、Lev及Ast组LX-2细胞存活率;(1)与Con组比较,P<0.01;(2)与TGF-β1组比较,P<0.01。
2.2 Lut、Lev及Ast联用对TGF-β1诱导的LX-2细胞增殖的影响
各药物联用组细胞增殖抑制率如图2所示。Lut+Lev+Ast组在0.94~60.00 μmol/L范围内细胞增殖抑制率高于Lut+Lev、Lut+Ast和Lev+Ast组;Lut+Lev组在0.94~15.00 μmol/L范围内细胞增殖抑制率低于Lut+Ast组,在15.00~60.00 μmol/L范围内细胞增殖抑制率高于Lut+Ast组;Lev+Ast组在0.94~60.00 μmol/L范围内细胞增殖抑制率高于Lut+Lev和Lut+Ast组。

图2 Lut、Lev和Ast联用对TGF-β1诱导的LX-2细胞增殖的影响Fig.2 Effect of Lut, Lev and Ast on the proliferation of TGF-β1-induced LX-2 cells
2.3 Lut、Lev和Ast联用类型的分析
结果显示,Lev+Ast组在细胞增殖抑制率>40%时的CI<1,Lut+Ast、Lut+Lev组在不同细胞增殖抑制率下CI≥1,3者联用组在细胞增殖抑制率>15%时CI<1,表明Lut、Lev和Ast联用在细胞增殖抑制率>15%时具有协同增效作用;初步确定3者联合使用对TGF-β1诱导的LX-2细胞的增殖具有协同抑制作用。Lut、Lev和Ast联用的CI见图3。

注:Fa为细胞增殖抑制率,CI为联合指数。
2.4 α-SMA蛋白表达
各组细胞中α-SMA蛋白表达结果如图4所示,与Con组比较,TGF-β1组α-SMA蛋白表达显著升高(P<0.01);与TGF-β1组相比,各给药组的α-SMA蛋白表达显著降低(P<0.01);其中3者联用组的α-SMA蛋白表达较其他组均降低更显著(P<0.05),提示Lut、Lev及Ast联用可抑制LX-2细胞的活化。

注:A 为Lut、Lev、Ast单用及联用时TGF-β1诱导的LX-2细胞中α-SMA蛋白条带图,B为相对表达量;(1)与Con组比较,P<0.01;与TGF-β1组比较,(2)P<0.05,(3)P<0.01。
2.5 TGF-β1蛋白表达
各组细胞中TGF-β1蛋白表达结果如图5所示,与Con组比较,各给药组TGF-β1蛋白表达均降低(P<0.05),3者联用组细胞中TGF-β1蛋白表达较其他给药组降低更显著(P<0.01);提示Lut、Lev和Ast联用对LX-2细胞增殖、活化的协同抑制作用可能与下调TGF-β1蛋白表达有关。

注:A 为Lut、Lev、Ast单用及联用时LX-2细胞中TGF-β1蛋白条带图,B为相对表达量;与Con组比较(1)P<0.01,(2)P<0.05。
3 讨论
肝组织ECM的异常沉积会导致肝正常的结构和功能被破坏,是HF病理过程中的特征性改变[10-11]。在生理情况下,ECM的合成与降解是一个动态平衡过程,由肝细胞、内皮细胞、肝星状细胞等多种细胞调控,其中肝星状细胞被认为是ECM的主要来源[12]。正常肝组织中的肝星状细胞处于静息状态,是储存维生素A和类视黄醇的主要细胞;当肝脏受损时,静息的肝星状细胞被激活,迅速增殖产生大量ECM,打破原有的合成与降解平衡,从而引起肝组织结构重建进而促进HF的发生[13]。TGF-β1是迄今为止作用最强的促纤维化细胞因子之一,在纤维化进程中发挥关键作用[14];体外实验常用TGF-β1诱导LX-2细胞使其活化,建立HF细胞模型从而开展实验研究[15-16]。本实验通过MTT法考察了Lut、Lev和Ast单用及联用对TGF-β1诱导的LX-2细胞增殖的影响。结果显示,3者单用及联用均能抑制TGF-β1诱导的LX-2细胞的增殖,且联用作用更为突出,并呈浓度依赖。
目前,用于评估药物联用类型的方法主要有Chou-Talalay组合指数法、等效线图分析和曲线位移分析等[17];其中Chou-Talalay组合指数法是根据中效方程计算单用及联合用药在各种抑制率时的中效浓度,能够在给定的抑制率水平下对药物联用影响疗效的合理性提供量化指标[18],该方法应用最为广泛。为了消除计算过程中的主观评价和实现数据自动分析,该方法被整合到软件程序(CalcuSyn)中,现在广泛用于生物医学科学的研究;CalcuSyn软件通常建议以IC50或半数有效量(half maximal effective dose, ED50)为恒定比例进行联合用药[19]。为了探讨Lut、Lev和Ast联用是否具有协同作用,本研究采用CalcuSyn软件进行分析,通过Graph Pad Prism8.0.1软件计算IC50,以IC50作为药物联合的恒定比例进行试验。结果显示,3者联用在细胞增殖抑制率大于15%时CI<1,证实Lut、Lev和Ast联用对TGF-β1诱导的LX-2细胞的增殖具有协同增效的抑制作用。α-SMA在肝星状细胞被激活时表达上调,被认为是肝星状细胞激活的标志,其表达水平与肝脏的纤维化程度呈正相关[20-21]。本实验研究显示,Lut、Lev和Ast联用能够显著下调TGF-β1诱导的LX-2细胞中α-SMA 蛋白的表达,提示3者联用能抑制肝星状细胞的激活。TGF-β1/Smad信号通路是介导肝星状细胞激活、促进肝星状细胞增殖和产生ECM的主要信号通路,在HF的进程中发挥着较为关键的作用,阻断TGF-β1/Smad信号通路,对HF的治疗有重要意义[22]。本研究结果显示,Lut、Lev和Ast联用能够显著下调LX-2细胞中TGF-β1蛋白的表达,提示3者联用抑制LX-2细胞增殖、活化的协同增效的作用可能与下调肝星状细胞TGF-β1蛋白表达有关。
综上所述,Lut、Lev和Ast单用及联用均能抑制TGF-β1诱导的LX-2细胞的增殖、活化,其中3者联用抑制作用最强,且具有协同增效的作用,这种抑制作用可能与下调肝星状细胞TGF-β1蛋白表达有关。本研究为Lut、Lev和Ast联用治疗HF提供了实验依据。

