皂荚枝条对低温胁迫的生理响应及抗寒性评价
陈思,韩丽君,郝向春,周帅,,张峻尘
(1山西省林业和草原科学研究院,太原 030012;2山西农业大学林学院,山西太谷 030800)
0 引言
皂荚(GleditsiasinensisLam.)为豆科皂荚属的落叶乔木,是山西省新兴发展的特色经济林树种,在医药、食品和日用化工等方面有着广泛的应用前景,并且是一种耐干旱、耐盐碱、适应能力强的深根性乡土阔叶树种,在园林绿化和生态防护等方面具有重要作用[1-3]。目前,皂荚已选育出‘帅丁’、‘帅荚1号’、‘帅荚2号’等多个良种,被广泛栽培。近年来,由于全球温室气体排放量增加导致极端气候频发,植物经常遭遇连续低温寒潮天气,而皂荚对生境温度较为敏感,气温突变易引发冻害抽梢、坐果率低、产量下降等问题,甚至造成不可逆的伤害,制约了皂荚产业的健康发展。抗寒性是林木良种选育过程中一个重要的性状指标,直接影响其生长分布及推广栽培范围,在选育高经济附加值的皂荚品种基础上进行植物的抗性生理研究,是良种选育的必然趋势。因此,对皂荚进行抗寒性评价显得尤为重要和迫切。
关于植物抗寒性的研究,普遍认为丙二醛(malondialdehyde,MDA)的含量是抗寒生理研究中的一个重要指标,MDA含量随着温度的逐渐降低呈现升高或者“降-升-降”的趋势[4-6]。陆新华等[7]研究发现,低温胁迫会破坏植物细胞膜的结构和功能,引起MDA的大量积累和外渗。低温伤害也会导致植物体内保护酶等发生一系列生理生化反应,以抵御气候条件的变化[8]。吴青霞[9]在试验春季低温胁迫对小麦的影响时发现,小麦叶片MDA 含量、超氧化物歧化酶(superoxide dismutase,SOD)活性等均有不同程度的升高。众多学者以相对电导率(Relative electrical conductivity,REC)来反映植物的抗寒能力。史清华等[10]用电导法和原子吸收分光光度法对5个杨树无性系抗寒性进行了测定与评价,得出-30℃是鉴定杨树无性系抗寒性的关键温度。于立洋等[11]采用电导法和电阻抗图谱法对新疆野苹果(Malussieversii)进行了无性系抗寒性研究,筛选出了抗寒表现较好的无性系3 个无性系。在受到胁迫时,植物体内色素含量及生理生化状况会发生相应的变化,从而导致植物反射光谱特性发生变化[12-14]。利用反射光谱仪进行光谱分析,可以评估植物的受胁迫程度及生长状况,分析低温胁迫条件下反射光谱各参数与温度变化的相互关系,探究其响应机制。
目前,皂荚主要依靠嫁接手段进行扩繁,但在生产中发现皂荚不同无性系间的抗寒能力存在差异,但其差异产生机制尚不清晰。本研究以11 个皂荚无性系的1 年生枝条为试材,采用连续测定与控制试验的方法,评估不同低温环境中皂荚枝条的细胞膜完整性、保护酶活性和反射光谱,同时测量枝条横截面结构比例,以比较11个皂荚无性系枝条的抗寒能力,并分析不同无性系间抗寒能力差异的原因,为皂荚抗寒无性系的评价筛选及良种选育提供理论依据。
1 材料与方法
1.1 试验地概况
试验地点位于山西省临汾市襄汾县,属于温带季风气候。年平均气温12.6℃,1 月为-4.5℃,7 月为26℃。年降水量约550 mm 左右,主要集中在7、8 月,无霜期约185 d。试验地的土壤为淡褐土,平均土层厚度1.0 m,pH 7.8。
1.2 试验材料
试验所用砧木为2020 年播种的同一种源皂荚实生苗,定植于山西省林业和草原科学研究院襄汾试验基地,接穗来自项目组前期收集筛选的11个皂荚优良无性系,分别为‘帅荚三号’、‘西贾二号’、‘羊角皂’、‘LKHD5’、‘牛家峪’、‘LKHD4’、‘河林一号’、‘302’、‘涧头村’、‘LKSD’、‘北山底’,无性系详细信息见表1。2022 年3 月,采集各无性系粗度基本一致、无病虫害、芽饱满的1年生枝条制成接穗,于4月进行嫁接,每个无性系至少嫁接100 株,采用完全随机区组排列。2022年11月,选取11个无性系嫁接苗长势良好的1年生枝条,处理成长约10 cm、粗度相似的短截,用蒸馏水冲洗两遍,干净纱布擦干后,石蜡封闭两端剪口,低温保湿储藏带回实验室。

表1 皂荚无性系材料及来源
1.3 低温处理
将每个无性系的枝条均分成8 组,其中一组置于人工气候箱,环境参数为光照强度0 μmol/(m2·s),环境温度为25°C,空气湿度为(50±10) %,作为对照(CK)。其余枝条装入聚乙烯自封袋内,置于低温冰箱(BCD-225SDPC,青岛海尔股份有限公司,中国)进行低温胁迫,设置5 ℃、0 ℃、-5 ℃、-10 ℃、-15 ℃、-20 ℃、-25 ℃等7 个低温梯度。各处理在目标温度处理12 h 后,在对照环境下解冻10 min,之后再放置12 h 后测定各项指标。处理时温度下降速率和解冻时温度回升速率均为5 ℃/h。每个处理3次重复,每个重复处理10根枝条。
1.4 测定指标与方法
1.4.1 反射光谱测定使用反射光谱仪(RP410-UVIS,Photon Systems Instruments,捷克)测定枝条表皮的反射光谱。光谱测量范围380~790 nm。每个温度处理下,每个无性系测量9根枝条,每条测定1次,记为9次重复。试验采用的反射光谱参数见表2。

表2 反射光谱参数
1.4.2 相对电导率测定将低温处理后的枝条避开芽眼剪成2~3 mm 左右的薄片,称取2.0 g,用冷冻研磨机(Scientz-48L,宁波新芝生物,中国)粉碎后倒入30 mL具塞试管内,加入20 mL 去离子水。用摇床(WD-9405DN,中国)震荡30 min再静置30 min,然后用电导率仪(DDSJ-308F,中国)测定待测液的电导率E1。试管封口放入沸水中水浴30 min,冷却至室温,测定电导率E2,并测定去离子水的电导率Lck。
每个温度处理下,每个无性系测量3次,记为3次重复。
1.4.3 MDA、SOD 含量的测定称取0.2 g 低温胁迫处理的一年生枝条,用冷冻研磨机(Scientz-48L,宁波新芝生物,中国)粉碎后,使用南京建成生物工程研究所生产的试剂盒进行测定。每个温度处理下,每个无性系测量3次,记为3次重复。
1.4.4 枝条横截面测定在每个无性系随机选择5根枝条,切片机切片,利用显微镜(BX43F,Olympus,日本)对枝条横截面进行拍照,并利用仪器配套软件测量枝条横截面的皮层厚度、韧皮部厚度、木质部厚度、髓心半径。
1.5 数据处理
数据统计分析采用SPSS 22,采用Origin 2019 进行数据拟合、Heatmap 聚类分析和制图。在分析前对数据进行了正态性和同质性测试,必要时对数据进行对数转换,以满足分析需要。
2 结果与分析
2.1 低温对相对电导率的影响
皂荚各无性系室温和不同低温处理条件下的平均REC(相对电导率)见表3。由表3可知,低温胁迫下各无性系REC总体均值为0.42,为室温条件下(0.31) 的1.35倍;在低温胁迫下,REC最大的无性系为Z10,其值为0.47,比总体平均值高11.90%,比最小值Z3(0.38)高23.68%;可以看出皂荚各无性系枝条REC在-15 ℃时出现第1个峰值,均值为0.49,在-25℃时出现第2个峰值,均值为0.51。在同一温度不同无性系间,5℃时,最大值Z11比最小值Z5高出45.16%(P<0.05);0℃时,最大值Z10比最小值Z2高出21.21%(P>0.05);-5℃时,最大值Z2比最小值Z1高出45.16%(P<0.05);-10℃时,最大值Z6比最小值Z5高出54.55%(P<0.05);-15℃时,最大值Z10比最小值Z2高出46.34%(P<0.05);-20℃时,最大值Z10比最小值Z4高出34.29%(P<0.05);-25℃时,最大值Z10比最小值Z4高出35.71%(P<0.05)。

表3 皂荚各无性系枝条在室温及不同低温条件下REC均值
经过低温处理后,植物细胞膜结构发生变化,胞内电解质外渗,电导率升高。REC越高,表明细胞膜的透性越强,受伤害程度越大,抗寒性越低[21-22]。由表3 可知,对11个皂荚无性系进行室温(25℃)和低温胁迫后,皂荚枝条REC对低温的响应大体上随着温度的降低呈现上升趋势,但不同无性系变化趋势有所不同,在一定范围内存在波动性,说明皂荚不同无性系枝条对低温的应答反应不同。整体上Z1、Z2、Z3、Z6、Z8、Z9无性系枝条REC随着温度的降低呈逐渐升高的趋势,Z4、Z5、Z7、Z10、Z11无性系枝条REC随着温度的降低呈“升-降-升”的趋势,尤其在-15℃~-25℃温度区间呈现显著的先下降后升高的趋势(P<0.05),说明随着温度的下降,皂荚对低温表现出一定的适应性,抗寒能力增强,REC出现短暂的下降,随着温度的继续降低植物细胞结构破坏严重,REC升高,抗寒能力减弱。
2.2 主成分分析
为进一步比较皂荚各无性系在不同温度下的综合表现,基于相对电导率进行主成分分析。结果显示,在提取前4 个公因子(PC1、PC2、PC3、PC4)后,解释的累计方差达88.11%,可用前4 个公因子作为评价不同皂荚无性系枝条抗寒性的综合指标。其中PC1公因子涵盖-20℃、-10℃、25℃,PC2 公因子涵盖-25℃,PC3 公因子涵盖-5℃、5℃,PC4公因子涵盖-15℃、0℃(图1)。
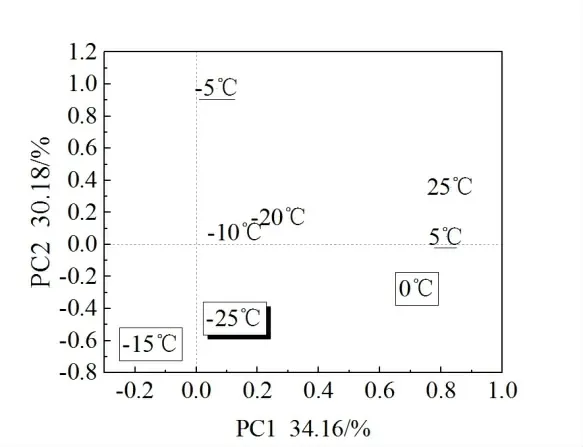
图1 旋转后的公因子载荷散点图
根据各公因子所对应的特征值计算出11个皂荚无性系枝条REC相应的综合得分,并对其按照综合得分进行排序(表4)。因REC越低抗寒性越强,Z3综合得分值最低,故Z3抗寒能力最强,各无性系抗寒能力排序为:Z3>Z4>Z11>Z1>Z5>Z8>Z7>Z9>Z2>Z6>Z10。
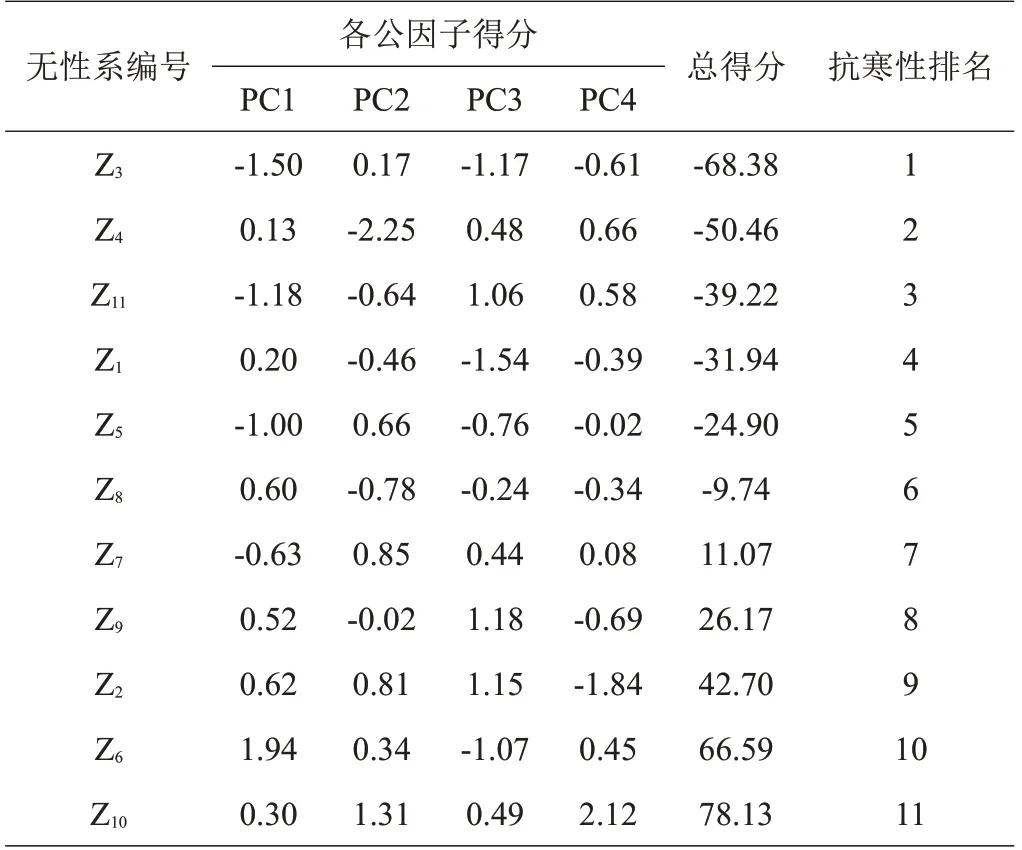
表4 各公因子得分表
2.3 聚类分析
以相对电导率为基础对皂荚各无性系进行聚类分析,结果如图2所示。可将供试的11个皂荚无性系枝条分为3 大类,其中Ⅰ类包括Z1、Z8、Z3、Z5、Z7无性系、Ⅱ类包括Z2、Z9、Z4、Z11无性系、Ⅲ类包括Z6、Z10无性系;以温度为基础可分为A、B、C 三组,其中A 组为-25℃和-15℃、B 组为-20℃和-10℃、C 组为-5℃、0℃、5℃、25℃。根据聚类分析结果,每一类中选取一个目标进行抗寒性差异原因分析,无性系选择Z3、Z2、Z10,温度选择25℃、-10℃、-25℃。

图2 不同温度处理下参数的Heatmap分析图
2.4 皂荚不同无性系枝条抗寒性差异分析
2.4.1 枝条结构与抗寒性的关系由图3可知,在3个无性系中,皮百分比、韧百分比均以Z10为最高,Z2次之,Z3最低,且各无性系间基本达到差异显著;木/韧以Z3为最高,且与Z10差异显著,但与Z2差异不显著;木百分比为Z3>Z2>Z10,但各无性系间差异不显著。由此分析可以初步得出,皂荚枝条抗寒性强弱和皮层厚度、韧皮部厚度以及木质部厚度与韧皮部厚度的比值存在一定的相关性,皮层和韧皮部比率越小,木质部/韧皮部比值越大,品种抗寒性越强。这反映了皂荚抗寒性在遗传上的结构特征。

图3 不同低温条件下皂荚无性系枝条主要参数对比
2.4.2 反射光谱参数与抗寒性的关系随着低温胁迫的加深,皂荚枝条的反射光谱参数在不同低温处理下的表现有所差异。从图3 可以看出,在-10℃、-25℃低温条件下,Z3无性系枝条的NDVI、ARI2、SIPI 要高于Z2和Z10(P<0.05),而其NPCI、CTR2 要低于Z2和Z10(P<0.05),说明NDVI、ARI2、SIPI 参数与皂荚枝条的抗寒性成正比,NPCI、CTR2参数与皂荚枝条的抗寒性成反比。而CRI2 在-10℃时排序为Z2>Z3>Z10(P<0.05),当温度下降到-25℃时,Z3枝条CRI2含量升高,Z2和Z10枝条CRI2含量下降,说明抗寒性强的无性系在低温胁迫时,会加速合成类胡萝卜素来抵御温度变化,而抗寒性较弱的无性系在低温环境下CRI2 合成受到阻碍。在25℃条件下,SRPI 排序为Z3>Z2>Z10(P<0.05),说明色素含量与皂荚枝条抗寒性有一定关系,室温条件下,抗寒性强的无性系枝条色素含量高,随着温度不断下降,不同无性系SRPI 含量差异不显著,这可能意味着低温胁迫影响了枝条色素的合成。
2.4.3 酶活性与抗寒性的关系MDA、SOD含量均能反映植物抗寒能力的强弱[23-24]。由图3可知,在25℃常温条件下,不同皂荚无性系枝条MDA 含量排序为Z10>Z2>Z3(P<0.05);在-10℃低温条件下,不同皂荚无性系枝条MDA 含量排序为Z10>Z2>Z3(P<0.05);在-25℃低温条件下为Z10>Z2>Z3(P<0.05)。对比3个皂荚无性系抗寒能力,说明低温条件下,皂荚枝条MDA含量越高,抗寒能力越弱,受胁迫程度越深,且随着温度的不断降低,有害物质MDA有不断积累的趋势。
在25℃常温条件下,不同皂荚无性系枝条SOD含量排序为Z3>Z2>Z10(P<0.05);在-10℃低温条件下,不同皂荚无性系枝条SOD 含量排序为Z3>Z2>Z10(P<0.05);在-25℃低温条件下为Z3>Z2>Z10(P<0.05)。可以看出,抗寒性越强,皂荚无性系枝条SOD含量越高,Z3枝条内SOD含量随着温度的降低呈现不断升高的趋势,而Z2、Z10枝条内SOD 含量随温度降低呈现先升高后降低的趋势。
3 讨论
3.1 低温胁迫与相对电导率(REC)的关系
细胞膜系统是植物受到低温胁迫时的原发部位[25],会发生一系列生理生化变化,导致渗透性改变,而REC的变化能反映植物遭受低温伤害后细胞膜透性的改变,常作为植物抗寒性强弱的重要测定指标[26]。有学者研究发现,低温胁迫下,植物REC越高,膜系统稳定性越差,抗寒性越弱;反之,REC较小的植物膜系统稳定性较好,抗寒性较强[27]。本研究发现,随着温度的降低,皂荚枝条REC总体呈现升高的趋势,部分无性系枝条REC表现出“升—降—升”的变化趋势,这与郑密等[28]对长白落叶松(Larixolgensis)和王洋[29]等对羊蹄甲(Bauhiniapurpurea)、洋紫荆(Bauhinia variegata)的研究一致。皂荚各无性系枝条REC在-15℃时出现第一个峰值,均值为0.49,在-25℃时出现第二个峰值,均值为0.51。当温度为-20℃时,部分无性系如Z4、Z5、Z7、Z10、Z11的枝条REC呈现下降趋势,可能是这些无性系在温度下降过程中,对低温表现出一定的适应性或者防御性,细胞膜得到一定的修复,具体生理代谢机制有待进一步研究。本试验中,平均REC最大的无性系为Z10,抗寒性最弱,平均REC最小的为Z3,抗寒性最强。
3.2 低温胁迫与枝条结构的关系
低温除了影响植物内部的生理生化活动,还会对其自身组织结构产生影响,抗寒性是植物长期适应寒冷环境而形成的一种遗传特性,因此,在研究植物抗寒性时,其组织解剖结构也常作为重要的参考指标[30]。有研究发现,植物的不同器官及不同组织结构,其抗寒性存在很大差异,抗寒性强的品种枝条木栓层厚,细胞层数多,木栓化程度高[31-33];木质部占比与品质抗寒性成正相关,皮层占比与抗寒性呈负相关[34]。皮层在越冬时期活细胞数较多,休眠期较浅,低温环境下细胞膜系统易破损,对低温胁迫较敏感,抗寒性较差[35]。木质部细胞的细胞壁多数已木质化,在低温胁迫时能起到一定的支撑和保护作用。因此,枝条的组织结构可以作为皂荚无性系抗寒性研究的评价依据。本研究对Z2、Z3、Z10无性系枝条组织结构观察和测量发现,与其他2 个无性系相比,Z3枝条的木质部厚度与韧皮部厚度的比值较大,皮层和韧皮部所占比例较小,抗寒性相对较强。在腊梅(Chimonanthuspraecox)[36]、杏(Prunus armeniaca)[37]、花椒(Zanthoxylumbungeanum)[38]等植物的抗寒性研究上都得出过类似的结论。对于低温条件下皂荚枝条结构是否发生显著变化,需在今后进一步深入研究。
3.3 低温胁迫与反射光谱参数的关系
不同物质对不同波长的电磁波的吸收和反射不同,对于不同波段光谱的响应特征产生不同的光谱特性[39]。植物的反射光谱受自身颜色和结构、发育阶段、水热状况、胁迫程度等多种因素的影响。因此,通过光谱分析,可以对植物的生理、生化变化进行分析研究。前人研究发现,当植物在受到低温胁迫时,其色素质量分数降低,色素质量分数与光谱反射率有显著的相关性[40]。本试验结果显示,不同无性系皂荚枝条的反射光谱参数在不同低温处理下的表现有所差异。低温胁迫下,抗寒性较强的无性系枝条NDVI、ARI2、SIPI 参数值较高,NPCI、CTR2参数值较低,NDVI、ARI2、SIPI参数与皂荚枝条的抗寒性成正比,NPCI、CTR2参数与皂荚枝条的抗寒性成反比。随着温度的降低,抗寒性较强的无性系枝条CRI2含量出现升高趋势,而抗寒性较弱的无性系枝条CRI2含量下降,说明低温胁迫促使抗寒性强的无性系加速合成CRI2来抵御温度变化,而抗寒性较弱的无性系在低温环境下CRI2 合成可能受到一定的阻碍,同时猜测由于细胞结构的破坏,酶活性的降低,加速了类胡萝卜素的降解。在25℃条件下,SRPI含量与皂荚无性系枝条抗寒性强弱成正比,推测色素含量与皂荚枝条抗寒性有一定关系,室温条件下,抗寒性强的无性系枝条色素含量高,但是随着胁迫程度的加深,不同无性系枝条SRPI 含量差异不显著,可能枝条色素合成受阻。
3.4 低温胁迫与酶活性的关系
在逆境条件下,植物细胞膜脂往往发生过氧化反应,丙二醛MDA是膜脂过氧化的主要产物,其细胞毒性会严重损伤生物膜,降低膜的流动性,最终导致其死亡,因而常用MDA 作为判断膜系统损伤程度和抗逆性的重要指标之一[41-42]。本研究发现,在低温胁迫下,抗寒性强的Z3无性系,其MDA质量摩尔浓度低,抗寒性较弱的Z2、Z10,MDA 浓度维持在较高水平;且MAD含量随温度的降低有不断升高的趋势,说明细胞膜脂过氧化程度随温度降低而逐渐加深。这与范宗民等[43]对‘赤霞珠’葡萄(CabernetSauvignon)枝条、欧欢[44]等对扁桃(AmygdalusCommunis)枝条的抗寒性研究结果一致。
在逆境胁迫下,植物体细胞加重膜脂过氧化作用时,会产生超氧化物歧化酶SOD等保护酶来清除过氧化物来抵御伤害,从而对机体起到保护作用,一般认为,SOD 活性与植物抗寒性有一定相关性[45-46]。本研究中,Z3无性系枝条SOD活性表现高于Z2、Z10,即抗寒性越强的品种在受到低温胁迫时,SOD 活性越高,在张学财等[47]对剑麻(Agavesisalana)、杨豫等[24]对葡萄的研究中也发现相似的规律。本研究还发现,Z2、Z10无性系枝条SOD 活性随胁迫温度降低呈现先升高后降低的趋势,这可能是由于温度的骤降,细胞内自由基浓度超过了保护酶清除作用的阈值,高浓度的过氧化物破坏了蛋白结构,从而致使SOD活性的丧失[48]。郭祥泉[46]认为随着温度的降低,SOD 酶活性存在一个温度拐点,而本试验Z3枝条SOD活性随温度降低而不断上升,即推测-25℃还未到达其低温承受极限。
本研究采集离体的枝条进行低温处理,该方法也常用于杨树[10]、落叶松[28]、苹果[41]、枣树[48]等枝条的抗寒性研究中。同时,植物越冬过程中,除了受到低温胁迫,生理干旱也是影响因素之一,对于皂荚在越冬过程中出现的抽梢、冻害等问题,有待在今后的试验中结合环境、形态、生理、生化等指标进一步深入研究。此外,植物的抗寒机制是一个动态的、复杂的生理过程,各皂荚无性系的抗寒性与田间栽培表现是否一致,有待下一步通过调查研究进行验证。
4 结论
本研究利用不同低温胁迫条件处理11 个皂荚无性系枝条,并基于相对电导率对其抗寒性进行了主成分分析,得出各皂荚无性系枝条抗寒性强弱依次为:Z3>Z4>Z11>Z1>Z5>Z8>Z7>Z9>Z2>Z6>Z10,即‘羊角皂’>‘LKHD5’>‘北山底’>‘帅荚三号’>‘牛家峪’>‘302’>‘河林一号’>‘涧头村’>‘西贾二号’>‘LKHD4’>‘LKSD’。本研究根据各无性系在不同温度条件下的相对电导率,运用聚类分析法,将各无性系聚为3类,其中‘帅荚三号’、‘302’、‘羊角皂’、‘牛家峪’、‘河林一号’的抗寒性较强,‘西贾二号’、‘涧头村’、‘LKHD5’、‘北山底’抗寒性中等,‘LKHD4’、‘LKSD’抗寒性较弱。研究还进一步对抗寒性差异明显的Z2、Z3、Z10(‘西贾二号’、‘羊角皂’、‘LKSD’)进行分析,得出‘羊角皂’枝条的木质部/韧皮部比例较大,皮层和韧皮部所占比例较小,低温条件下相对电导率较小,NDVI、ARI2、SIPI、CRI2 参数较高,MDA 含量低而SOD 酶活性高,所以相较于其他无性系其抗寒性最强,可以尝试在山西偏北部地区推广种植;另外,可考虑将抗寒性较强的品种作为嫁接砧木或者杂交亲本,以期培育出抗性更强的新无性系。

