NaCl胁迫下宁夏枸杞ABA代谢相关基因差异表达分析
梁旺利 于雯静 胡进红 宋繁 王玲霞 梁文裕


摘 要 为解析宁夏枸杞响应NaCl胁迫的ABA代谢分子调控机制,检测NaCl胁迫下宁夏枸杞叶片脱落酸(ABA)含量变化,并利用RNA-seq和qRT-PCR技术研究NaCl胁迫下ABA代谢相关基因的差异表达规律。结果表明,不同浓度NaCl胁迫下,宁夏枸杞叶片中ABA含量随NaCl浓度的增加呈现增加趋势;通过转录组测序筛选得到21个ABA代谢相关的差异表达基因,从100 mmol/L、200 mmol/L、300 mmol/L NaCl处理下的宁夏枸杞叶片中检测到ABA代谢相关的差异表达基因分别有17、11、9个,qRT-PCR检测结果与转录组测序结果基本一致。宁夏枸杞通过相关基因的差异表达调控ABA代谢和信号通路,从而参与调控其响应NaCl胁迫。
关键词 宁夏枸杞;NaCl胁迫;ABA;代谢;差异基因表达
土地盐碱化是全球面临的日益严重的环境问题。盐胁迫引起土壤盐渍化和离子稳态失衡,导致植物代谢紊乱、营养缺乏和氧化损伤等,对光合作用、呼吸作用和能量代谢等一系列生理过程产生抑制作用[1]。植物内源激素是植物自身合成并对其生长发育起重要调控作用的物质,激素水平是调控植物响应盐胁迫的重要因素,如脱落酸(ABA)和水杨酸(SA)可正调控苦豆子对盐胁迫的反应,而乙烯(ETH)和茉莉酸(JA)可负调控苦豆子响应盐胁迫[2]。ABA作为植物逆境响应的核心激素,其代谢和信号转导是近年来研究的热点[3-4],尤其对ABA调控植物响应盐胁迫的分子机制有了一定的认识,如植物遭遇到盐胁迫时ABA迅速合成,先后与PYR/PYL和PP2C相结合而增强SnRK2活性,激活下游ABA应答基因,同时分解代谢途径使ABA含量达到动态平衡[5];ABA生物合成关键基因NCED2和NCED6的表达量在盐胁迫下强烈增加,影响了番茄的抗盐能力[6];PYR/PYL/RCAR基因和SnRK2基因上调表达、PP2C基因下调表达共同增强了结缕草的耐盐能力[7];富士苹果栽培的早期阶段 CYP707A1和 CYP707A2表达减少有助于弱化ABA分解代谢而防御盐胁迫[8]。虽然ABA可调控植物耐盐性已被人们熟知,但木本灌木在盐胁迫下基因差异表达调控ABA代谢的分子机制还有许多未知之处。
宁夏枸杞(Lycium barbarum L.)是茄科枸杞属多年生落叶灌木,具有耐盐碱、耐瘠薄的特点和极高的经济及药用价值。目前宁夏枸杞激素相关研究主要集中在果实内源激素与果实发育[9]、外源激素对枸杞生长和繁殖的影响[10]、激素处理对宁夏枸杞扦插生根效果评价[11]等方面,而关于盐胁迫下宁夏枸杞基因差异表达调控ABA代谢的分子机制方面缺少相应的研究报道。因此,本研究对NaCl胁迫下宁夏枸杞叶片ABA含量的变化进行检测,采用RNA-seq技术对ABA代谢相关差异表达基因进行筛选,并通过qRT-PCR技术验证了关键基因差异表达情况,进而解析盐胁迫下宁夏枸杞ABA代谢相关基因差异表达规律,为深入认识宁夏枸杞耐盐碱的激素代谢分子机理奠定基础,为宁夏枸杞耐盐新品种的培育提供理论和试验依据。
1 材料与方法
1.1 材料与处理
宁夏枸杞‘宁杞1号由宁夏农林科学院枸杞工程技术研究所惠赠。宁夏枸杞幼苗培养及处理在人工温室[温度(25±2) ℃、湿度42%、光周期16 h/8 h、光照强度60 μmol/(m 2·s)]内完成。幼苗在草木灰、珍珠岩与蛭石1∶1∶1(体积比)混合后的基质中,加入Hoagland營养液培养1个月后,除去基质进行水培至8~12叶期,选择健康且长势一致的幼苗进行NaCl(分析纯,购自天津市永大化学试剂有限公司)胁迫处理。胁迫处理设定0 mmol/L NaCl(A)、100 mmol/L NaCl(B)、200 mmol/L NaCl(C)、300 mmol/L NaCl(D)4个浓度,处理7 d后选取植株同一部位叶片取样,-80 ℃保存,备用。每组处理3次生物学重复。
1.2 方法
1.2.1 NaCl胁迫下宁夏枸杞叶片ABA含量测定 ABA的提取参考Fu等[12]的方法并加以改进。称取0.2 g宁夏枸杞叶片于液氮中研磨至干粉状,加入1 mL 90%甲醇(色谱纯,购自天根生化科技有限公司),4 ℃ 12 h后10 000 r/min离心5 min,上清液倒入MCX-WAX串联柱,用1.2 mL 90%甲醇洗提后分离MCX-WAX 串联柱,WAX柱先用2 mL 5%富里酸淋洗,再用1.5 mL甲醇洗脱,氮气吹干洗脱液,用100 μL 40%甲醇溶液复溶(所有步骤于4 ℃进行)。
ABA含量使用Agilent 1290高效液相色谱仪串联AB Sciex QTRAP 6500+质谱仪测定。液相条件:采用Waters ACQUITY UPLC BEH C18(100×2.1 mm,1.7 μm)色谱柱;流动相: 甲∶乙=(0.1%甲酸甲醇)∶(0.1%甲酸水);柱温40 ℃;洗脱梯度:0~1 min,甲=20%;1~3 min,甲递增至50%;3~9 min,甲递增至90%; 9~10.5 min,甲=90%;10.5~10.6 min,甲递减至20%;10.6~13.5 min,甲=20%;进样量 2 μL。质谱条件:电喷雾电离源 ESI;雾化温度:500 ℃;气帘气(CUR):35 psi;喷雾电压(IS): 4 500 V;雾化气压力(Gas1):60 psi;辅助气压力(Gas2):60 psi;监测模式:MRM。ABA标准品选用Sigma公司产品。每个处理进行3个生物学重复测定。
1.2.2 RNA提取、文库构建及测序 利用多糖多酚植物总RNA提取试剂盒(购自天根生化科技有限公司)提取NaCl胁迫处理的宁夏枸杞叶片总RNA,样品总RNA质量检测合格后,构建cDNA测序文库,对文库插入片段长度和有效浓度进行检测。使用高通量Illumina HiSeq PE150测序平台对文库进行测序获得原始数据,对raw reads进行过滤处理得到clean reads。采用Trinity软件对clean reads进行拼接以获取后续分析参考序列。
1.2.3 基因功能注释及差异基因筛选 将Unigene序列与Nr、Pfam、Swiss-prot、KEGG、GO数据库进行比对,获得基因功能注释。采用DESeq 2进行基因的差异表达分析,以P<0.05且|log2(Fold Change)|>1为差异显著性标准,筛选ABA代谢相关的差异表达基因(DEG)。
1.2.4 ABA相关基因的qRT-PCR分析 对转录组测序获得的数据进行分析,挑选ABA代谢关键基因进行qRT-PCR分析(试剂盒购自南京诺唯赞生物科技有限公司)。根据转录本序列,用Primer Premier 5.0设计目的基因扩增引物(表1)。PCR扩增条件为95 ℃ 10 min,95 ℃ 30 s,60 ℃ 1 min,共41个循环,每个反应3次重复。采用2-ΔΔCt法[13-14]计算相对表达量。
1.3 数据处理
使用SPSS 26、Origin 2018和Excel等软件进行数据处理、方差分析与图表绘制。
2 结果与分析
2.1 NaCl胁迫下宁夏枸杞叶片ABA含量变化
宁夏枸杞叶片中ABA含量随着NaCl胁迫浓度的增加呈增加趋势。ABA含量在NaCl胁迫浓度为0 mmol/L时与200 mmol/L、300 mmol/L处理组相比呈现显著差异(P<0.05),与100 mmol/L处理组相比无显著性差异(P>0.05)(图1)。
2.2 NaCl胁迫下宁夏枸杞ABA代谢相关基因的差异表达
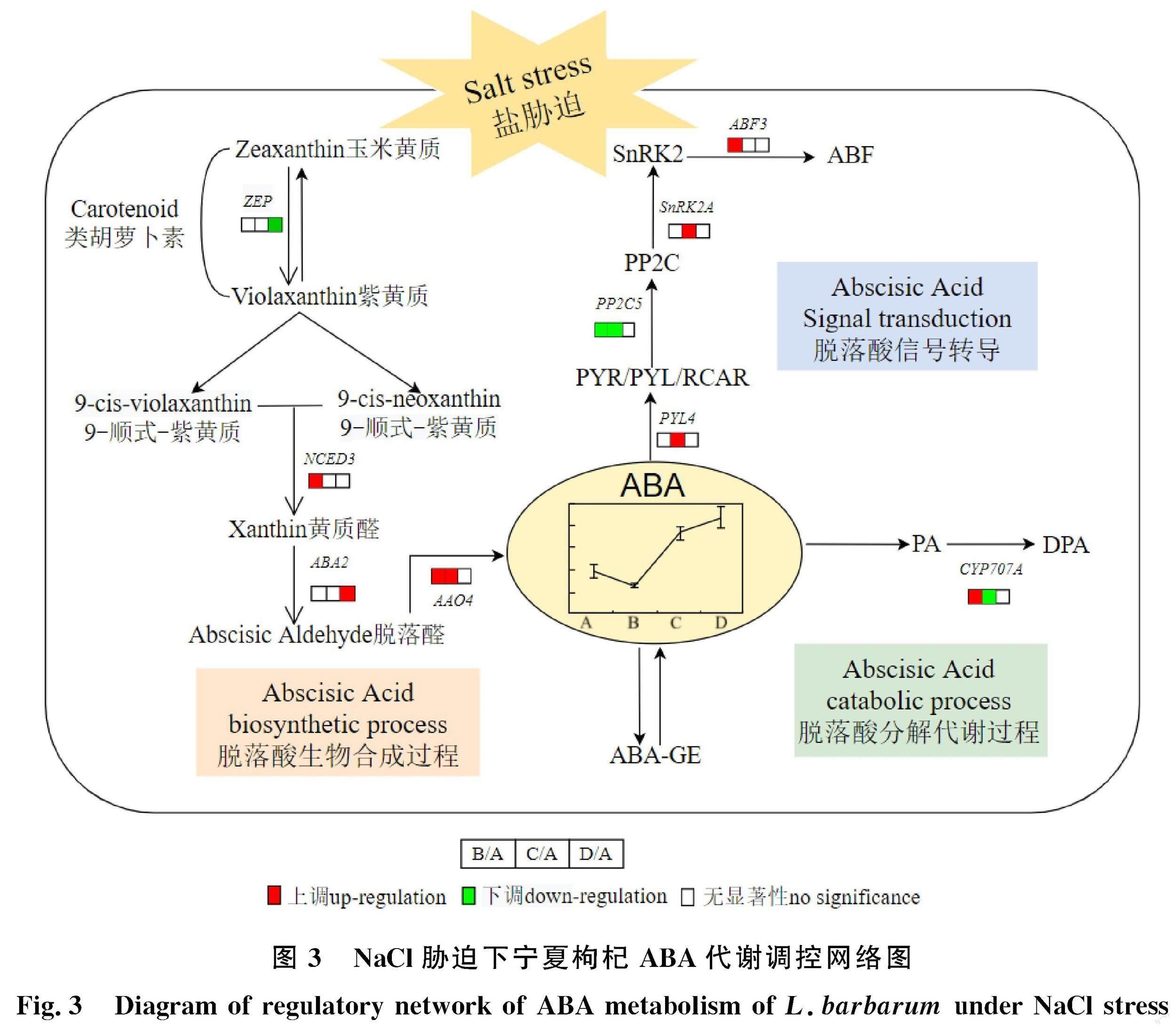
对NaCl胁迫下宁夏枸杞所有差异表达基因进行KEGG pathway显著性富集分析,筛选21个富集到ABA代谢途径的差异表达基因(P< 0.05)(表2)。以0 mmol/L NaCl处理为对照,100 mmol/L NaCl处理的宁夏枸杞叶片中共检测到17个ABA代谢相关的差异基因,其中包括11个上调表达和6个下调表达基因,且分别占ABA代谢总差异基因的52.38%和28.57%;200mmol/L NaCl处理的宁夏枸杞叶片中检测到11个ABA代谢相关的差异基因,包括4个上调表达和7个下调表达基因,分别占ABA代谢总差异基因的19.05%和33.33%;300 mmol/L NaCl处理的宁夏枸杞叶片中检测到9个ABA代谢相关差异基因,包括3个上调和6个下调表达基因,分别占ABA代谢总差异基因的14.29%和 28.57%;4个差异表达基因在3种处理下都检测到上调或下调表达(图2)。这些差异表达基因主要通过诱导ABA生物合成、信号转导及分解代谢来调控宁夏枸杞响应NaCl胁迫(图3)。
2.3 NaCl胁迫下宁夏枸杞叶片ABA代谢相关差异基因的qRT-PCR分析
挑选与NaCl胁迫下宁夏枸杞ABA代谢密切相关的黄质醛脱氢酶2( ABA2)、醛氧化酶4( AAO4)、脱落酸8′-羟化酶( CYP707A)、9-顺式环氧类胡萝卜素双加氧酶3( NCED3 )、脱落酸受体4( PYL4)、SNF1相关蛋白激酶2A ( SnRK2A)、蛋白磷酸酯酶2C 5( PP2C5)、转录因子MYB1R1( MYB1R1)等基因进行qRT-PCR表达验证分析。结果显示:随着NaCl浓度的增加,宁夏枸杞叶片中 ABA2的表达量呈上升趋势, AAO4的表达量呈先上升后下降的趋势, CYP707A和 NCED3 的表达量呈先上升后下降再上升的趋势, PP2C5和 MYB1R1的表达量呈下降趋势, PYL4和 SnRK2A 的表达量呈先下降后上升再下降的趋势(图4)。qRT-PCR的验证结果与RNA-Seq结果基本吻合。
3 讨 论
植物激素是调节植物生长发育和应对各种胁迫耐受性或敏感性的内源分子,可通过诱导复杂的生理生化反應,激活自身免疫系统以应对生物或非生物胁迫。ABA作为植物中最重要的应激反应激素之一,在植物调控生物与非生物应激反应以及在植物不同生长和发育进程中发挥重要 作用。
ABA的生物合成是植物应对非生物胁迫最快的反应之一。真核生物ABA的早期生物合成主要为甲基赤藓糖磷酸(MEP)途径合成类胡萝卜素,继而促进ABA生物合成。类胡萝卜素氧化衍生物玉米黄质和紫黄质是ABA合成过程中重要前体物质,二者可在玉米黄质环氧化酶(ZEP)与紫黄质脱环氧化酶(VDE)的作用下相互转化。紫黄质可异构化为9-顺式-紫黄质和9-顺式-新黄质,在9-顺式环氧类胡萝卜素双加氧酶(NCED)的作用下生成黄质醛;黄质醛经黄质醛脱氢酶2(ABA2)作用产生脱落醛,最终经ABA醛氧化酶(AAO)催化生成ABA。ABA生物合成相关基因之间互相影响,共同调控着植物响应盐胁迫。Wang等[15]研究表明叶绿体中类脂蛋白基因OsVDE可负调控水稻幼苗 OsNECD2/4/5的表达及ABA的生物合成和耐盐性。NCED是ABA合成中的关键限速酶,也是关键调控酶,过表达At NCED3 基因可明显提高内源ABA水平,同时上调ABA合成酶基因ZEP、 AAO3等的表达水平[16];而利用CRISPR/Cas9敲除 OsNCED5后,水稻的耐盐性显著降低[17]。而且PEG6000胁迫烟草试验也发现了干旱胁迫诱导 NCED3 基因上调表达以及内源ABA的积累[18]。此外,绒毛白蜡体内 FvNCED3 基因在脱水、盐胁迫和外源ABA的作用下的表达量升高,且 FvNCED3 可以通过响应外界刺激增强植物下游基因的表达和抗逆性[19]。还有研究发现, ABA2可以正反馈调节ABA的积累,例如水稻中ABA2利用NAD做辅因子,催化黄质醛转化为脱落醛,在ABA生物合成过程中发挥重要作用[20]。而且外源ABA也能上调拟南芥中ZEP、AAO3和MCSU基因表达水平[21-22]。转基因水稻相较于野生型与非转基因水稻中的AAO基因显著上调表达,且具有较高的耐盐性[23]。本研究发现宁夏枸杞叶片中 VDE1基因在300 mmol/L NaCl处理下显著下调表达,表明玉米黄质向紫黄质的转化可能促进了ABA的生物合成。 NCED3 在100 mmol/L NaCl处理下显著上调,而在300 mmol/L NaCl处理下变化不显著; ABA2在300 mmol/L NaCl处理下显著上调; AAO4在100、200 mmol/L NaCl处理下显著上调,而在300 mmol/L NaCl处理下变化不显著,推测200 mmol/L、300 mmol/L NaCl处理下宁夏枸杞中ABA含量升高的原因可能与以上基因的表达有关,提示了宁夏枸杞在NaCl胁迫下通过诱导ABA合成关键基因差异表达进而增加ABA含量,以此参与应对盐胁迫环境。
现有研究认为ABA响应盐胁迫的信号转导途径主要有依赖ABA和不依赖ABA途径[24]。不依赖ABA途径中,植物将识别到的盐胁迫信号以Ca2+和干旱应答元件为中心进行信号转导,诱导植物产生相应的生理生化反应以缓解盐害带来的负面影响[25]。依赖ABA的信号转导途径主要以PYR/PYL/RCAR-PP2C-SnRK2复合物作为主要框架,通过ABA受体PYR/PYL/RCAR、A类蛋白磷酸酶PP2C及第Ⅲ亚类SNF1相关蛋白激酶2(SnRK2s)及下游响应因子发挥作用[26]。在盐胁迫下,植物内源ABA水平迅速升高被ABA受体PYL/PYR感知,后与蛋白磷酸酶PP2C结合,减少PP2C对SnRK2的抑制,从而激活SnRK2的表达,启动下游ABA反应元件(ABRE)结合蛋白(AREBs)/ABRE结合因子ABFs,引起气孔关闭、种子休眠[2,27]。PP2C与PYR/PYL/RCAR受体的选择性相互作用取决于组织中现存ABA的含量,拟南芥中已鉴定的14个PYL受体,在ABA存在的情况下,只有 PYL1、 PYL3、 PYL6、 PYL8、 PYL9、 PYL10、 PYL11受体与植物激素分子结合后,使 PP2C失活启动信号转导通路的正调控因子[28]。在盐胁迫和渗透胁迫下,ABA信号增强激活 SnRK2,引起下游转录因子磷酸化,从而提高植物抗逆性[29]。拟南芥 ABF4基因参与了ABA信号转导通路,且在马铃薯中的表达增强了其耐盐和耐旱性[30]。本研究发现 PLY4基因在200 mmol/L NaCl处理下表达量显著增加; PP2C5基因在100 mmol/L和200 mmol/L NaCl处理下表达量显著减少; SnRK2A基因在200 mmol/L NaCl处理下表达量显著增加(表2,图4),说明 PP2C5与ABA受体结合后 SnRK2A被释放发挥作用,这暗示了NaCl胁迫下宁夏枸杞叶片中ABA信号转导通路被激活。另外, ABF2、 ABF3、 ABF4基因均在100 mmol/L NaCl胁迫下表达显著上调,在200 mmol/L处理下变化不显著,可能意味着ABA信号转导通路的下游响应因子被启动进而对盐胁迫信号做出了反应。此外,植物最大的转录因子家族之一MYB也可以参与ABA信号传导通路及调节植物耐盐性[31-32]。 AtMYB20可通过抑制拟南芥中 PP2C的表达来增强抗盐性[33],而玉米可通过增强 ZmMYB3R的表达调节气孔开度赋予玉米耐盐性[34],另外过表达 GmMYB3a可负调控大豆耐盐性[35]。本研究发现 MYB1R1在盐胁迫下表达量显著下降,而 MYB44在盐胁迫下表达量显著增加,推测宁夏枸杞在响应盐胁迫过程中不同的MYB转录因子可能具有不同的调控ABA代谢作用,其具体机制还有待于进一步研究。因此,宁夏枸杞在NaCl胁迫下可能通过激活ABA信号转导通路中相关调控基因,进而参与应答宁夏枸杞对盐胁迫的 响应。
为有效调节植物体内ABA水平以响应应激反应,除加强ABA生物合成途径外,抑制ABA代谢也是增强植物ABA水平的一个有价值且非常重要的举措[36]。ABA的分解代谢主要包括与葡萄糖结合和羟基化作用。当植物体内ABA含量过高时,葡萄糖基转移酶(UGT)催化其与葡萄糖反应生成脱落酸葡萄糖酯(ABA-GE);当植物体内ABA过低时,ABA-GE又可将ABA释放出来[37]。羟基化作用中,ABA分解代谢通过氧化失活方式产生红花菜豆酸(PA),其关键限速酶是脱落酸8′-羟化酶[38]。Liu等[39]通过RNAi对水稻 OsABA8ox1( CYP707A5)基因进行抑制,提高了水稻植株内源ABA水平,显著提高了水稻对碱胁迫的耐受性。在对水稻冷胁迫研究[40]中发现过表达 OsABA8ox1的转基因水稻品系ABA含量降低,同时其对干旱和寒冷耐受性降低,这意味着随着 OsABA8ox1表达的升高,ABA水平受到负反馈调控。另有研究表明, CYP707A基因的转录本可增加植物对盐、渗透、脱水压力以及ABA的响应[41]。本研究发现宁夏枸杞叶片在100 mmol/L NaCl胁迫下 CYP707A基因顯著上调表达,可能加速了ABA降解使得ABA含量下降,而200 mmol/L NaCl胁迫下 CYP707A基因表达量显著下调,减缓了ABA羟基化分解代谢。因此,宁夏枸杞在NaCl胁迫过程中可能通过抑制其降解相关基因表达,从而提高植物体内ABA的含量,达到对盐胁迫防御的调控作用。
综上所述,宁夏枸杞通过相关基因的差异表达调控ABA代谢和信号通路,从而调控其响应NaCl胁迫。研究结果为深入解析宁夏枸杞耐盐的ABA代谢调控和信号转导机理奠定了基础,并为宁夏枸杞耐盐新品种的培育提供了理论和试验依据。
参考文献 Reference:
[1] ZHU D,LUO F,ZOU R,et al.Integrated physiological and chloroplast proteome analysis of wheat seedling leaves under salt and osmotic stresses[J].Journal of Proteomics,2021,234:104097.
[2]ZHU Y CH,WANG Q Y,GAO Z W,et al.Analysis of phytohormone signal transduction in Sophora alopecuroides under salt stress[J].International Journal of Molecular Sciences,2021,22(14):7313.
[3]CHONG L,GUO P CH,ZHU Y F.Mediator complex:A pivotal regulator of ABA signaling pathway and abiotic stress response in plants[J].International Journal of Molecular Sciences,2020,21(20):7755.
[4]熊孟连,戴 星,简 燕,等.脱落酸依赖的与非依赖的信号途径的研究进展[J].基因组学与应用生物学,2020, 39(12):5796-5802.
XIONG M L,DAI X,JIAN Y,et al.Advances in the study of abscisic acid-dependent and non-dependent signaling pathways[J].Genomics and Applied Biology,2020, 39(12):5796-5802.
[5]张 岩,许 兴,朱永兴,等.ABA响应植物盐胁迫的机制研究进展[J].中国农学通报,2015,31(24):143-148.
ZHANG Y,XU X,ZHU Y X,et al.Progress of mechanisms of ABA response to plant salt stress [J].Chinese Agricultural Science Bulletin,2015,31(24):143-148.
[6]HOLSTEEN S K,DE J I,WYNANTS A,et al.Mild and severe salt stress responses are age-dependently regulated by abscisic acid in tomato[J].Frontiers in Plant Science,2022,13:982622.
[7]娜木日嘎.日本结缕草ABA途径对盐胁迫响应分子机制[D].北京:北京林业大学,2017.
NAMARIGA.Molecular mechanism of ABA pathway of Zoysia japonica in response to salt stress[D].Beijing:Beijing Forestry University,2017.
[8]SALES L,OHARA H,OHKAWA K,et al.Salt tolerance in apple seedlings is affected by an inhibitor of ABA 8′-hydroxylase CYP707A[J].Journal of Plant Growth Regulation,2017,36(3):643-650.
[9]杨晓婉.宁夏枸杞果实内源激素含量变化及其与果实发育关系的研究[D].银川:宁夏大学,2013.
YANG X W.Studies on the changes of endogenous hormone content and fruit development and their relationship in Lycium barbarum L.[D].Yinchuan:NingXia University,2013.
[10]柴 淳,黎云祥,陈光登,等.外源植物激素对宁夏枸杞种子萌发和幼苗生长的影响[J].干旱地区农业研究,2010,28(5):149-153.
CHAI CH,LI Y X,CHEN G D,et al.Effects of exogenous hormones on the germination and seedling growth of Lycium barbarum L.[J].Agricultural Research in the Arid Areas,2010,28(5):149-153.
[11]丁丽萍,马 力,占玉芳,等.基于主成分分析的不同激素处理下宁夏枸杞扦插生根效果的綜合评价[J].经济林研究,2017,35(2):110-115.
DING L P,MA L,ZHAN Y F,et al.Comprehensive evaluation of rooting effect of different hormone treatments on Lycium barbarum L.cuttings based on principal component analysis[J].Nonwood Forest Research,2017,35(2):110-115.
[12]FU J H,CHU J F,SUN X H,et al. Simple,rapid,and simultaneous assay of multiple carboxyl containing phytohormones in wounded tomatoes by UPLC-MS/MS using single SPE purification and isotope dilution[J].Analytical Sciences,2012,28(11):1081-1087.
[13]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-DDCt Method[J].Methods,2001,25(4):402-408.
[14]ADNAN M,MORTON G,HADI S.Analysis of rpoS and bolA gene expression under various stress-induced environments in planktonic and biofilm phase using 2△△CT method[J].Molecular and Cellular Biochemistry,2011,357(1/2):275-282.
[15]WANG X C,REN P X,JI L X,et al.OsVDE,a xanthophyll cycle key enzyme,mediates abscisic acid biosynthesis and negatively regulates salinity tolerance in rice[J].Planta,2021,255(1):6.
[16]XIONG L,ISHITANI M,LEE H,et al. The Arabidopsis LOS5/ABA3 locus encodes a molybdenum cofactor sulfurase and modulates cold stress-and osmotic stress-responsive gene expression[J].Plant Cell,2001,13(9):2063-2083.
[17]HUANGY,JIAO Y,XIE N,et al.OsNCED5,a 9-cis-epoxycarotenoid dioxygenase gene,regulates salt and water stress tolerance and leaf senescence in rice[J].Plant Sciences,2019,287:110188.
[18]牛志强,刘国顺,师婷婷,等.烟草 NCED3 基因的克隆及其干旱胁迫表达分析[J].中国烟草学报,2015,21(3):100-106.
NIU ZH Q,LIU G SH,SHI T T,et al.Cloning of NCED3 gene in Nicotiana tabacum and analysis of its drought stress-induced expression[J].Acta Tabacaria Sinica,2015,21(3):100-106.
[19]LIT,SUN J K,LI C R,et al.Cloning and expression analysis of the FvNCED3 gene and its promoter from ash (Fraxinus velutina) [J].Journal of Forestry Research,2019,30(2):471-482.
[20]WEI K,CHEN J,CHEN Y,et al.Molecular mechanism for dynamic regulation of endogenous ABA signal level[J].Hereditas,2012,34(3):296-306.
[21]XIONG L M,GONG ZH ZH,ROCK C D,et al.Modulation of abscisic acid signal transduction and biosynthesis by an Sm-like protein in Arabidopsis[J].Developmental Cell,2001,1(6):771-781.
[22]XIONG L M,LEE H J,ISHITANI M,et al. Regulation of osmotic stress-responsive gene expression by the LOS6/ABA1 locus in Arabidopsis [J].Journal of Biological Chemistry,2002,277 (10) :8588-8596.
[23]SAENG-NGAMS,TAKPIROM W,BUABOOCHA T, et al. The role of the OsCam1-1 salt stress sensor in ABA accumulation and salt tolerance in rice[J].Journal of Plant Biology,2012,55(3):198-208.
[24]SOMA F,TAKAHASHI F,YAMAGUCHI-SHINOZAKI K,et al.Cellular phosphorylation signaling and gene expression in drought stress responses:ABA-dependent and ABA-independent regulatory systems[J].Plants (Basel),2021,10(4):756
[25]劉云芬,彭 华,王薇薇,等.植物耐盐性生理与分子机制研究进展[J].江苏农业科学,2019,47(12):30-36.
LIU Y F,PENG H,WANG W W,et al.Research progress on physiological and molecular mechanisms of salt tolerance for plants [J].Jiangsu Agricultural Sciences,2019,47(12):30-36.
[26]UMEZAWA T,SUGIYAMA N,MIZOGUCHI M,et al.Type 2C protein phosphatases directly regulate abscisic acid-activated protein kinases in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(41):17588-17593.
[27]陳素梅,王新慧,李 菲,等.ABA调控植物盐胁迫应答机制研究进展[J].南京农业大学学报,2022,45(5):856-863.
CHEN S M,WANG X H,LI F,et al.Advances in ABA regulated responses of plant to salt stress[J].Journal of Nanjing Agricultural University,2022,45(5):856-863.
[28]RAGHAVENDRA A S,GONUGUNTA V K,CHRISTMANN A,et al.ABA perception and signalling[J].Trends in Plant Science,2010,15(7):395-401.
[29]YU Z P,DUAN X B,LUO L,et al.How plant hormones mediate salt stress responses[J].Trends in Plant Science,2020,25(11):1117-1130.
[30]GARCIA M N M,CORTELEZZI J I,FUMAGALLI M, et al.Expression of the Arabidopsis ABF4 gene in potato increases tuber yield,improves tuber quality and enhances salt and drought tolerance[J].Plant Molecular Biology,2018,98(1/2):137-152.
[31]WYRZYKOWSK A A,BIELEWICZ D,PLEWKA P, et al. The MYB33,MYB65,and MYB101 transcription factors affect Arabidopsis and potato responses to drought by regulating the ABA signaling pathway[J].Physiol Plant,2022,174(5):e13775.
[32]LEE H G,SEO P J.MYB96 recruits the HDA15 protein to suppress negative regulators of ABA signaling in Arabidopsis[J].Korean Breeding Society Academic presentation,2019,10(1):1713
[33]CUI M H,YOO K S,HYOUNG S,et al.An Arabidopsis R2R3-MYB transcription factor,AtMYB20,negatively regulates type 2C serine/threonine protein phosphatases to enhance salt tolerance[J].Febs Letters,2013,587(12):1773-1778.
[34]WU J D,JIANG Y L,LIANG Y N,et al.Expression of the maize MYB transcription factor ZmMYB3R enhances drought and salt stress tolerance in transgenic plants[J].Plant Physiol Biochem,2019,137:179-188.
[35]HE Y X,YANG X D,XU CH,et al.Overexpression of a novel transcriptional repressor GmMYB3a negatively regulates salt-alkali tolerance and stress-related genes in soybean[J].Biochem Biophys Res Commun,2018,498(3):586-591.
[36]CHEN K,LI G J,BRESSAN R A,et al. Abscisic acid dynamics,signaling,and functions in plants[J].Journal of Integrative Plant Biology,2020,62(1):25-54.
[37]宋松泉,刘 军,徐恒恒,等.脱落酸代谢与信号传递及其调控种子休眠与萌发的分子机制[J].中国农业科学,2020,53(5):857-873.
SONG S Q,LIU J,XU H H,et al. ABA metabolism and mignaling and their molecular mechanism regulating seed dormancy and germination[J].Scientia Agricultura Sinica,2020,53(5):857-873.
[38]YOSHIDA T,CHRISTMANN A,YAMAGUCHI-SHINOZAKI K,et al.Revisiting the basal role of ABA-roles outside of stress[J].Trends in Plant Science,2019, 24(7):625-635.
[39]LIU X L,XIE X ZH,ZHENG CH K,et al. RNAi-mediated suppression of the abscisic acid catabolism gene OsABA8ox1 increases abscisic acid content and tolerance to saline-alkaline stress in rice (Oryza sativa L.) [J].The Crop Journal,2022,10(2):354-367.
[40]MEGA R,MEGURO-MAOKA A,ENDO A,et al.Sustained low abscisic acid levels increase seedling vigor under cold stress in rice (Oryza sativa L.) [J].Scientific Reports,2015,5:13819.
[41]SAITO S,HIRAI N,MATSUMOTO C,et al.Arabidopsis CYP707As encode (+)-abscisic acid 8′-hydroxylase,a key enzyme in the oxidative catabolism of abscisic acid[J].Plant Physiology,2004,134(4):1439-1449.
Differential Expression of ABA Metabolism-Related Genes in Lycium barbarum under NaCl Stress
Abstract To analyze the molecular regulation mechanism of ABA metabolism of Lycium barbarum in response to NaCl-induced stress,we detected ABA contents of L.barbarum leaves under NaCl stress,and used RNA-seq and qRT-PCR techniques to analyze the differential expression of ABA metabolism related genes.The results showed that ABA content in leaves of L.barbarum increased by NaCl stress.21 ABA metabolism-related genes were differentially expressed in L.barbarum,and 17,11 and 9 ABA metabolism-related genes were differentially expressed in 100 mmol/L,200 mmol/L and 300 mmol/L NaCl,respectively.Meanwhile,the results of qRT-PCR were consistent with the results of transcriptome sequencing.L.barbarum responded to NaCl stress through regulating ABA metabolism and signal pathway by differential expression of related genes.
Key words Lycium barbarum; NaCl stress; ABA; Metabolism; Differential expression of genes

