猪血中抗菌肽的提取
王延卓,董晓庆,曲桂娟,白永平
(1.乌兰察布职业学院生物技术系,内蒙古乌兰察布012000;2.吉林农业大学动物科技学院,吉林长春130118)
抗菌肽是生物体内诱导表达具有广谱抗菌活性的小分子多肽[1-2]。这些多肽是生物体非专一性的免疫应答产物,是生物体内免疫系统的重要成分[3]。
国内外关于猪源抗菌肽的研究,主要针对猪小肠中的抗菌肽,而血中抗菌肽的提取及抗菌活性研究在国内外却很少有报道[4-6]。基于猪血液中白细胞是免疫系统中起主要作用的免疫细胞,其中性粒细胞约占白细胞总量的70%,所以本试验试图从猪血中性粒细胞中提取抗菌肽,优化提取工艺,提高抗菌肽的回收率和纯度。
1 材料与方法
1.1 材料 从长春市净月屠宰场采取新鲜猪血2~3 L,使用5%柠檬酸钠抗凝。
1.2 方法
1.2.1 萃取 将新鲜猪血放置37℃温箱静置1~2 h,取上清按照1∶4(V∶V)的比例加入0.84%氯化铵溶液,混匀静置 3 min,常温400 r/min离心 10 min,弃上清按比例加入氯化铵溶液混匀静置 3 min,再次500 r/min离心 10 min。弃上清,使沉淀与少量冷的生理盐水(4℃)短时间混合,再用200 mL冷的10%冰醋酸(4℃)使沉淀悬浮,充分混匀,倒入50 mL烧杯,超声波处理50次,然后溶液使用磁力搅拌器混匀搅动于4℃下萃取一夜。次日,将萃取的溶液取出15 000 r/min离心30 min,取上清4℃下保存,沉淀再次混悬于冷的10%醋酸中,充分混匀,混匀搅动于4℃下萃取一夜。第3天,将萃取的溶液取出15 000 r/min离心30 min,取上清用紫外分光光度计分别测其在260 nm和280 nm处的吸收值,记录结果,最后将溶液4℃下保存。
1.2.2 除酸、浓缩 合并所保存的溶液,将溶液注入透析袋,扎紧袋口,然后将其放入烧杯,再向烧杯中倒入蒸馏水,蒸馏水液面要超过透析袋,4℃下透析除酸,每12 h换水一次,直至透析袋外蒸馏水pH大于6,此时,将透析袋放入瓷盘中,撒上聚乙二醇-6000,透析浓缩约3~4 h后即可将透析袋取出,将浓缩的溶液取出低温冻干,转移至青霉素小瓶中,密封-20℃保存。
1.2.3 抗菌肽的分离 将冻干样品用0.5%甲醇溶解,再上样于层析柱葡聚糖凝胶Sephadex G25,同时打开柱的下端出口,注意控制流速为1 mL/min,5 mL/管。用部分收集器收集洗脱液,5 mL/管,收集的溶液用紫外分光光度计测其在280 nm处的吸收值,再测其在260 nm处的吸收值,记录结果,将在280 nm处有吸收的溶液分装于青霉素瓶中,再在低温冻干机中冻干,-80℃保存。取各瓶冻干保存的样品各20 mg,分别溶于灭菌双蒸水中,无菌条件下用微孔滤膜过滤样品,将药敏纸片浸泡于过滤后的样品中,浸泡过夜后,用平皿纸片法初筛,测定各峰收集组分的抗菌活性,收集具有抗菌活性的组分,置于 5℃保存,用来进一步做 Sephadex G100层析、分离。仍使用层析柱(1.8 cm×100 cm),将部分收集的有抗菌活性的组分溶液以0.5%甲醇溶液作为洗脱液,以部分收集器收集,将在280 nm处有吸收的溶液分装于青霉素瓶中,再在低温冻干机中冻干,-80℃保存。用平皿纸片法测定各峰收集组分的抗菌活性,收集具有抗菌活性的组分,置于5℃保存。
1.2.4 抗菌肽的纯化与浓缩 使用超滤装置进行超滤,膜包选用截流分子量为20 kD。洗脱液选用0.5%甲醇溶液,滤出液既为所要获得的溶液,置于5℃保存。从而进一步纯化。然后将溶液注入透析袋,扎紧袋口,4℃下透析除酸,每12 h换水1次,换水3次后,将透析袋放入瓷盘中,撒上聚乙二醇-6000,透析浓缩约3~4 h后即可将透析袋取出,将浓缩的溶液取出低温冻干,转移至青霉素小瓶中,-20℃密封保存。
1.2.5 抗菌肽的Tricine SDS-PAGE电泳 将纯化的猪中性粒细胞肽,低分子量标准蛋白进行T ricine SDS-PAGE电泳,分离胶浓度15%,积层胶浓度5%,凝胶厚度0.75 mm,阳极缓冲液为0.2 mol/L Tris溶液(pH 8.9),阴极缓冲液为0.1 mol/L T ris溶液(pH 8.3),每孔上样量为15 μ L。染色、脱色,回收。
1.2.6 酸性尿素聚丙烯酰胺凝胶电泳法测定抗菌肽抗菌活性 取大肠杆菌ATCC25922接种于大豆培养基中,37℃振摇培养8 h,此时的菌液为幼龄菌液,立即取幼龄菌0.1 mL,将取出的0.1 mL菌液加入已经灭菌的0.9 mL的生理盐水中,稀释,混匀,取1 mL加入2号试管中,再混匀,再取0.1 mL依次进行10×稀释,共计8只试管,依次的浓度为10-1、10-2………10-7。10倍稀释之后,接种于已经制备好的琼脂平板中,37℃培养24 h,进行菌落计数,通过稀释得到5×106-107个/mL范围内的这个浓度的菌,将该浓度的菌液40 μ L加入50℃~60℃熔化状态的底层培养基中使菌液浓度为5×104-105个/mL,混匀后,均匀铺于培养皿中,待凝固后,再将PBS洗涤后的AU-PAGE凝胶铺于底层培养基上,置于37℃温箱孵育3~4 h,从而使凝胶中的蛋白质弥散进入底层培养基,之后取出凝胶,倒入顶层培养基37℃培养18 h,使细菌生长,第2天,使用0.001%考马斯亮蓝对琼脂糖平板染色10 h,亮区无菌生长。
2 结果
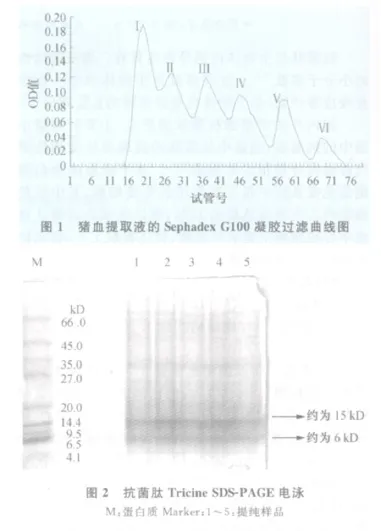
2.1 凝胶过滤分离、纯化 粗提液经Sephadex G25柱层析分离后,出现2个峰,前峰为大分子蛋白质,后峰为小分子蛋白质及多肽。将收集的各管溶液各取15 μ L进行抗菌活性测定,结果从第46管开始有抑菌圈出现,第49管抑菌圈最大(直径2.1 cm),至第54管抑菌圈消失,合并45~54管溶液,使用Sephadex G100再次层析分离,出现6个峰(见图1),抗菌活性测定,结果从第35管开始有抑菌圈出现,第38管抑菌圈最大(直径2.2 cm),至第44管抑菌圈消失,说明抗菌肽位于第3洗脱峰内。
2.2 纯化物的T ricine SDS-PAGE电泳 纯化物经Tricine SDS-PAGE电泳出现两条主带(见图2),其中左数第1条带为低分子量蛋白质Maker,其他条带为样品纯化物。样品电泳显示为含两条主带,其中位于电泳图谱最下端的一条主带分子量约为6 kD,其上一条带约为15 kD。
2.3 抗菌肽抗菌活性测定 经考马斯亮蓝染色的琼脂糖平板,结果发现,只有分子量约为6 kD的多肽带发亮,回收该条带的多肽进行抗菌活性测定,结果见图3、4、5、6。证明此条带上无菌生长,该条带的多肽具有抗菌活性,应含有抗菌肽。

图3 纯化物对链球菌ATCC55121抑菌试验结果

3 分析与讨论
分离抗菌肽,国内外最广泛使用的方法,是化学试剂提取法[7-8],本研究首先使用氯化铵溶液溶解红细胞,白细胞(70%~75%PMNs,5%~10%嗜酸性细胞,15%~25%淋巴细胞和单核细胞)在4℃生理盐水可恢复其活性,然后超声波破碎细胞,内部物质释放出来,在4℃下用10%冰醋酸混悬该溶液,进一步破碎细胞,高速离心即获得低分子量的蛋白质和多肽,再使用葡聚糖凝胶Sephadex G25过滤分离盐离子和大分子蛋白质,使用葡聚糖凝胶Sephadex G100细分出有活性的小分子多肽,最后使用超滤法纯化所提取的小分子多肽。
Sephadex G型葡聚糖凝胶虽然价位很高,但性能颇佳,又可再生利用,此外上柱样品损失很少,对处理小分子样品效果较好,因此本试验使用了Sephadex G型葡聚糖凝胶。又因为Sephadex G型葡聚糖凝胶只适合在水中使用,所以本试验所使用的缓冲液为0.5%甲醇水溶液。抗菌肽为小分子多肽,因此本试验超滤装置中所使用的膜包截留分子量为20 kD。
Tricine SDS-PAGE电泳在分离、鉴定和纯化蛋白质、多肽方面有着广泛的应用,该方法操作方便,所需仪器简单,重现性好,时间短,只需微克量的多肽便可显带且能迅速估测出其相对分子量,因此,本试验应用 Tricine SDS-PAGE电泳分离纯化物,从而更简单、快捷地分离小分子多肽,结果有较好的显带,分出两条主带,分子量分别约为6 kD和15 kD。
应用AU-PAGE电泳分离小分子多肽,使多肽保持了活性,结合前面所讲的凝胶覆盖测定法,最终鉴定出分子量在6 kD左右的带具有抗菌活性,而我们已知抗菌肽分子量大多在4 kDa左右,由此推测该条带应含有抗菌肽。当然,经 Tricine SDSPAGE电泳鉴定为的单一区带不能证明为一纯的多肽带,如果在以后的试验中采用其他方法如:高效液相色谱法(HPLC),氮端氨基酸序列测定,肽质谱分析法等,对于该条带的鉴定将更加具有说服力。
[1]Boman H G,Hultmark D.Cell free immunity in insects[J].Ann Rev Microbiol,1987,41:103-126.
[2]罗刚,魏泓.猪防御素基因(PBD-I、PBD-Ⅱ)在大肠杆菌中的重组和融合表达[J].第三军医大学学报,2003,14(25):1300-1302.
[3]孙学军,阎虎生.蜂毒肽片段类似物的合成及其生物活性研究[D].天津:南开大学,2003.
[4]Piers K L,Brown M H,Hancock R W.Recombinant DNA procedures for producing small antimicrobial cationic peptide in bacteria[J].Gene,1993,134:7-11.
[5]Dmy tro P,Yevtushenko,Rafael Romero,et al.Santosh Misra Pathogen-induced expression of a cecropin A-melittin antimicrobial peptide gene confers antifungal resistance in transgenic tobacco[J].J Exp Bot,2005,56:1685-1695.
[6]张艳艳.猪血中抗菌肽类物质的分离纯化和抗菌活性研究[J].科技导报,2008,26(2):33-37.
[7]Yarus S,Rosen J M,Cole A M,et al.Production of active bovine tracheal antimicrobial peptide in milk of transgenic mice[J].PNAS,1996,93:14-18.
[8]韩新燕,许梓荣.抗菌肽在哺乳动物防御系统中的作用[J].中国预防兽医学报,2003,25(6):499-502.

