MRCP与LAVA技术联合应用在肝门部胆管癌术前评估中的价值
杜 滂,秦 越,王 玮,魏经国,崔光彬,郭 炜,黄 进,金大永
(第四军医大学唐都医院放射科,陕西 西安 710038)
肝门部胆管癌是指原发于胆囊管开口以上的肝总管至左、右肝管部位的黏膜上皮癌,占肝外胆管癌的60%~70%[1-2]。手术是治愈该病的唯一机会,据文献报道根治性切除的胆管癌患者的5年生存率可达40%。随着对其生物学特性的深入了解和外科手术技术的不断进步,根治性切除的适应症逐步扩大。近年的临床实践表明,有为数不少的BismuthⅣ型患者通过手术实现了病灶完整切除,甚至是根治切除,术前准确了解胆管侵犯的范围及病变与相邻组织、器官间的关系与手术方案的制定关系密切。MR技术的进步,尤其是磁共振LAVA及MRCP的应用为胆管癌的定位、定性诊断及手术切除的可行性的判断提供了重要参考依据。本研究应用MRI平扫、MRCP及LAVA检查技术,明确肿瘤的部位、大小及肝内胆管受浸润范围,了解肿瘤与肝门部血管尤其是门静脉的关系及淋巴结受累情况,结合术中探查及手术结果进行综合评价,探讨MRCP及LAVA检查技术对胆管癌术前指导外科治疗方式的价值。
1 材料与方法
1.1 临床资料
回顾我院2007年11月~2009年2月资料完整的胆管癌患者87例,其中男53例,女34例。年龄32~78岁(平均62岁),其中50~70岁年龄组居多,约占75%。全部病人均经病理学证实。主要临床表现为无痛性黄疸、上腹不适、食欲减低、皮肤瘙痒及体重减轻,少数患者出现发热、寒战等症状。其中黄疸 82例(94.6%)、上腹痛 31例(36.2%)、纳差 83例(95.1%)、 尿色加深 76例 (87.5%)、 灰白色大便 25例(28.7%)、 全身皮肤瘙痒 30例 (35.6%)、 体重减轻 24例(27.4%)、发热 11例(12.7%)。
1.2 实验室检查
所有病人总胆红素及间接胆红素、碱性磷酸酶(ALP)、γ-谷氨酰基转移酶(GGT)均明显升高,59例(68%)丙氨酸氨基转移酶、天冬氨酸氨基转移酶升高。64例病人行血清CA-199检测,其中49例(56%)升高。
1.3 MR检查方法
所有病人均采用美国GE公司Signa HD 3.0T超导型磁共振仪进行检查。扫描采用体部相阵控线圈,增强扫描应用高压注射器注射Gd-DTPA。所有图像在GE ADW 4.3工作站上进行图像重建及分析。
所有患者首先进行常规轴位T1WI、T2WI、STIR及冠状位T2WI平扫、LAVA及COR FS MRCP 3D RT扫描。利用LAVA技术分别获得动脉期、门静脉期及平衡期图像。每次LAVA序列采集均在一次屏气内完成,单次采集时间为11~13s。扫描以肝门部为中心,单层层厚为4.0mm,整个3D容积扫描层厚为80~100mm。 对比剂剂量为 15ml,注射速率 2~3ml/s。
1.4 图像分析
在MRI、MRCP及LAVA图像上观察肿瘤的部位、大小、范围,胆管壁受侵情况;肿块与肝门血管的关系,肝动脉和门静脉有无受浸润变窄或受压、癌栓形成;有无肝门淋巴结转移、肝内转移以及远处转移。肿瘤分型按照Bismuth-Corlette分类法[2]:Ⅰ型,肿瘤仅侵犯肝总管而未侵汇合部;Ⅱ型,肿瘤侵犯肝总管及其汇合部;Ⅲ型,肿瘤侵犯肝总管、汇合部及一侧2级肝内胆管 (Ⅲa型侵犯右肝管;Ⅲb型侵犯左肝管);Ⅳ型,肿瘤同时侵犯肝总管和左右肝管。肿瘤与血管的接触面≥1/2周径,且肿瘤与静脉接触长度≥2cm,视为侵犯血管。
2 结果
2.1 肝门部胆管癌的MRI、MRCP及LAVA的影像学特点
肝门部胆管癌在T1WI上呈略低信号或等信号,T2WI上呈等信号或略高信号,信号不均匀,其中32例在T2WI还可见中央低信号。MRCP上87例均表现为肝内胆管明显扩张,呈“软藤”样改变,76例累及全肝并延伸到肝脏外周带,扩张程度0.5~2.3cm。梗阻部位胆管断端表现为:突然截断31例、不规则狭窄41例、腔内充盈缺损15例。梗阻部位以下胆管不扩张,胆囊不大。
LAVA示24例动脉期可见轻度强化,53例于静脉期开始强化,所有病例于平衡期及延迟期呈持续的中度强化(图1~8)。有9例可见门静脉及其分支边缘不规则,与肿瘤间界限不清4例、肝动脉受压移位3例。14例见肝门部或腹膜后淋巴结肿大,2例见肝内转移灶,未见明确的远处转移征象。结合MRI平扫、MRCP、LAVA影像结果分析,本组62例表现为浸润性生长,16例表现为腔内生长,9例表现为肿块样生长。
2.2 MRI分型分期判断与手术对照
79例病人行手术治疗,其中66例行根治性手术切除,3例行部分病变切除,10例行姑息性手术治疗。术前及术后诊断一致者72例,符合率约91%。术中探查见肝脏明显淤胆,呈黑褐色,于肝门部扪及肿块,质硬,肿瘤大小1.6~6.2cm,平均3.4cm。MR术前诊断肝实质受侵26例,血管明确受侵8例,可疑受累1例,肝内转移2例,肝门部、腹膜后淋巴结转移6例。MRI术前评估69例可行根治性手术切除,按照Bismuth-Corlette分类法进行肿瘤分型,其中Ⅰ型14例,Ⅱ型23例,Ⅲ型28例,Ⅳ型12例。术中观察及术后病理回报显示肝实质受侵31例,符合率84%;血管受侵犯8例,符合率100%;肝门部、腹膜后淋巴结转移9例,符合率67%;术中66例病人行根治性手术切除,按照Bismuth-Corlette分类法进行肿瘤分型,其中Ⅰ型14例,Ⅱ型20例,Ⅲ型26例,Ⅳ型6例。其中术前术后分型一致者63例,Bismuth分型诊断符合率92%。
3 讨论
胆管癌病因不明,原发性硬化性胆管炎、慢性胆系感染、胆管结石、长期毒素接触等被认为是胆管癌的高危致病因素[1-3]。胆管癌根据其生长特点可分为管壁浸润型、肿块型和腔内生长型3类[4]。管壁浸润型最常见,占70%以上,病变有沿胆管及肝内胆管浸润的特点[5-6]。在组织学上,胆管癌多为高或中分化腺癌,其中以硬癌多见,为丰富的纤维组织和基质包埋少许癌细胞[6-8]。胆管癌根据其生长部位分为肝内胆管癌和肝外胆管癌,肝外胆管癌又分为上段胆管癌和中下段胆管癌,上段胆管癌亦称肝门部胆管癌,由Klatskin首先描述,故又称Klatskin瘤,现在一般指位于左右肝管、左右肝管汇合部及肝总管的癌,大约60%~70%的胆管癌发生于左右肝管交汇区[1-2]。
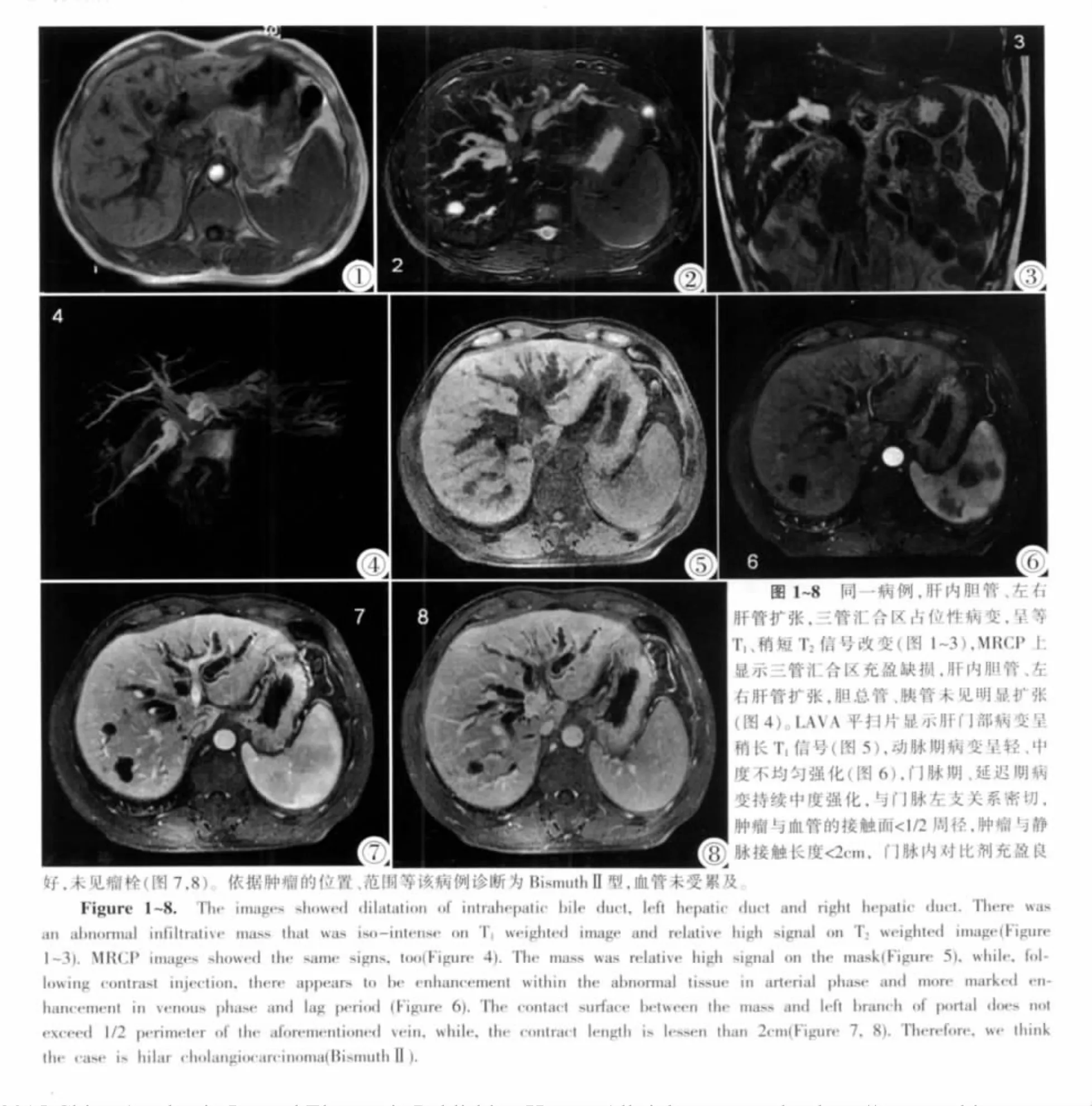
图1~8 同一病例,肝内胆管、左右肝管扩张,三管汇合区占位性病变,呈等T1、稍短 T2信号改变(图 1~3),MRCP 上显示三管汇合区充盈缺损,肝内胆管、左右肝管扩张,胆总管、胰管未见明显扩张(图4)。LAVA平扫片显示肝门部病变呈稍长T1信号(图5),动脉期病变呈轻、中度不均匀强化(图6),门脉期、延迟期病变持续中度强化,与门脉左支关系密切,肿瘤与血管的接触面<1/2周径,肿瘤与静脉接触长度<2cm,门脉内对比剂充盈良好,未见瘤栓(图7,8)。依据肿瘤的位置、范围等该病例诊断为BismuthⅡ型,血管未受累及。Figure 1~8. The images showed dilatation of intrahepatic bile duct,left hepatic duct and right hepatic duct.There was an abnormal infiltrative mass that was iso-intense on T1weighted image and relative high signal on T2weighted image(Figure 1~3).MRCP images showed the same signs,too(Figure 4).The mass was relative high signal on the mask(Figure 5),while,following contrast injection,there appears to be enhancement within the abnormal tissue in arterial phase and more marked enhancement in venous phase and lag period(Figure 6).The contact surface between the mass and left branch of portal does not exceed 1/2 perimeter of the aforementioned vein,while,the contract length is lessen than 2cm(Figure 7,8).Therefore,we think the case is hilar cholangiocarcinoma(BismuthⅡ).
肝门部胆管癌的患者常见临床表现为无痛性黄疸。患者的主诉通常为瘙痒、腹痛、消瘦、发热,以及与胆系梗阻有关的陶土色大便等。肝门部胆管癌的病理特点表现为局灶性狭窄或浸润型狭窄,最常见的侵犯形式是沿胆管树的局部蔓延侵犯肝脏。除了直接侵犯、血行和淋巴转移外,肝门部胆管癌可通过神经侵犯和发生跳跃式转移。由于肝门部胆管癌局部软组织侵犯和胆管壁黏膜下浸润的特点,因而手术后局部复发率高。因此,目前强调胆管癌不仅是一个局部性病变,更是一个区域性病变[9-11]。手术是该病非常重要的治疗手段之一,因此,肝门部胆管癌术前评估非常重要,其目的是确定根治性手术切除的可行性和切除范围。术前影像学评估的主要内容包括:①明确肿瘤的部位和大小;②了解肿瘤与肝门部血管的关系,尤其是门静脉是否受侵及其侵犯程度;③肝内胆管受浸润范围。既往,肝门胆管癌的影像学评估常依赖于直接胆管造影,如ERCP及PTC,二者曾被认为是术前评价胆管癌沿纵轴侵犯范围的最佳方法[12-14]。但直接胆管造影可导致严重的并发症,且不能评估肿瘤对胆管壁横轴的浸润程度。另外,对腔内生长型的病例,直接胆管造影可因腔内坏死物质的存在而高估胆管的受累范围[15-17]。随着医学影像学技术的进步,特别是高场强MRI及MR新技术的应用,胆管癌无创的早期诊断及术前评估成为可能。本组资料提示,MRI、MRCP及LAVA,在评估肝门部胆管癌的可切除性方面具有重要意义。它们可以显示胆管、血管及附近肝实质的受侵情况。
本组87例肝门部胆管癌在T1WI上为低信号,在T2WI上为高信号,32例在T2WI还可见中央低信号,反应了肿块内的纤维间质。MRCP上87例均表现为肝内胆管明显扩张,呈“软藤”样改变,76例累及全肝并延伸到肝脏外周带,扩张程度0.5~2.3cm。梗阻部位胆管断端呈突然截断、不规则狭窄、腔内充盈缺损等。梗阻部位以下胆管不扩张,胆囊不大。上述表现与文献报道一致。容积动态增强扫描显示24例动脉期可见轻度强化,53例于静脉期开始强化,所有病例于平衡期及延迟期呈持续的中度强化,较大病变先边缘中度强化,随后中央逐渐强化。文献报道肝门胆管癌血供不丰富而且富含纤维组织,细胞外间隙大,动态增强时呈缓慢延迟强化[4,18]。本组部分病例增强方式与上述文献报道有一定差异,影像学资料分析显示,动脉期强化的病变都为肝门部浸润型胆管癌,再者,早期病变尚未形成较明显的软组织肿块,T2WI信号较均匀或病变纤维化改变尚不明显,故而血供可能相对丰富。因此,笔者认为胆管癌的强化方式与其分型、分期密切相关,上述推测尚需大量病例加以证实。
术前对肝动脉及门静脉受累情况的精确评估十分重要。在评估肝门血管系统受累方面,应用LAVA技术,血管壁的狭窄、突然截断及局部不规则缺损清晰可见。据本组资料显示,冠状面动态增强扫描对鉴别血管与胆管很有帮助,并能显示肿瘤与门静脉的关系,这种扫描方式可更直观地显示门静脉及胆管的全貌,使肝门区病变容易定位,且冠状面成像的解剖效果与手术所见相似[13-14]。同时,利用LAVA的原始图像采用MIP技术可重建血管的三维图像,可更直观、多角度观察血管受侵犯的范围及管腔狭窄程度。既往认为门静脉受累是手术的禁忌症,随着外科技术的发展,血管重建技术的应用,相当一部分门脉受累的病人实施了手术治疗。本组病例显示门脉受累的准确率为100%,因此,多种MRI技术综合评价胆管癌与相邻血管的关系是准确、可靠的。
MRCP是胆管系统较理想的检查方法,相对于ERCP和PTC有明显优势。首先,MRCP无创、无放射性;其次,MRCP可完整显示肝内外胆道树图像、病变范围及肝内胆管受累程度,不受黄疸和左右肝管被肿瘤分隔的影响,检查成功率高;第三,MRCP可显示肿瘤的直接征象,对于胆管癌的分型具有指导意义。研究表明MRCP评估胆系梗阻平面及胆管受累的准确率可达88%~96%[15-16]。但是,MRCP不能显示胆管壁的情况,对于肿瘤沿胆管侵犯的范围难以作出精确的判断,而在延迟扫描中,胆管壁延迟强化的有无及其强化程度对估计病变沿胆管侵犯具有重要价值。此外,准确评价肝实质受侵的情况对评估肿瘤的可切除性具有重要意义。LAVA扫描是基于脂肪抑制的对比剂增强扫描,脂肪抑制技术能抑制肝门区的脂肪,提高胆管癌的显示效果,并利于估测肿瘤的范围及其对周围组织、器官的浸润情况[17-18],而且其对显示肝实质的浸润及转移也很有帮助。
综上所述,MRI的软组织分辨率高,MRCP能完整地显示整个胆管系统,判断胆管受累情况以及肝内外胆管的继发改变,LAVA技术能准确评估肝门胆管癌的大小、分型、侵犯范围及血管壁的狭窄、截断及瘤栓形成的情况。上述技术的联合应用,可更准确的评价肝门部胆管癌的大小、分型及相邻组织结构的改变,进而对制订手术方案具有重要的指导意义。
[1]Manfredi R,Brizi MG,Masselli G,et al.Malignant biliary hilar stenosis:MR cholangiography compared with direct cholangiography[J].Radiol Med,2001,102(1-2):48-54.
[2]Manfredi R,Barbaro B,Masselli G,et al.Magnetic resonance imaging of cholangiocarcinoma[J].Semin Liver Dis,2004,24(2):155-164.
[3]Choi JY,Kim MJ,Lee JM,et al.Preoperative imaging with sonography,MDCT,MRI,and direct cholangiography[J].AJR,2008,191(5):1448-1457.
[4]Launois B,Wemyss-Holden S,Maddern GJ.Current and future trends in management and treatment of Klatskin tumour[J].Int J Clin Oncol,2002,7(2):91-102.
[5]Masselli G,Manfredi R,Vecchioli A,et al.Preoperative evaluation of hilar cholangiocarcinoma:correlation with surgical and pathologic findings[J].Eur Radiol,2008,18(10):2213-2221.
[6]Hemming AW,Reed AI,Fujita S,et al.Surgical management of hilar cholangiocarcinoma[J].Ann Surg,2005,241(5):693-702.
[7]H覿nninen EL,Pech M,Jonas S,et al.Magnetic resonance imaging including magnetic resonance cholangiopancreatography for tumor localization and therapy planning in malignant hilar obstructions[J].Acta Radiol,2005,46(5):462-470.
[8]Gleeson FC,Rajan E,Levy MJ,et al.Lymph nodes in patients with unresectable hilarcholangiocarcinoma[J].Gastrointest Endosc,2008,67(3):438-443.
[9]Hai S,Yamamoto S,Tanaka H,et al.Adenomyoma of the common hepatic duct mimicking bile duct cancer:report of a case[J].Surg Today,2007,37(7):608-611.
[10]Slattery JM,Sahani DV.What is the current state-of-the-art imaging for detection and staging of cholangiocarcinoma?[J].Oncologist,2006,11(8):913-922.
[11]Chen RF,Li ZH,Zhou JJ,et al.Preoperative evaluation with T-staging system for hilar cholangiocarcinoma[J].World J Gastroenterol,2007,13(43):5754-5759.
[12]Choi E,Byun JH,Park BJ,et al.Duplication of the extrahepatic bile duct with anomalous union of the pancreaticobiliary ductal system revealed by MR cholangiopancreatography[J].Br J Radiol,2007,80(955):e150-e154.
[13]Masselli G,Gualdi G.Hilar cholangiocarcinoma:MRI/MRCP in staging and treatment planning[J].Abdom Imaging,2008,33(4):444-451.
[14]Patel T.Cholangiocarcinoma[J].Nat Clin Pract Gastroenterol Hepatol,2006,3(1):33-42.
[15]Park KW,Lim JH,Jang KT,et al.Autoimmune cholangitis mimicking periductal-infiltrating cholangiocarcinoma[J].Abdom Imaging,2008,33(3):334-336.
[16]Miller G,Schwartz LH,D’Angelica M.The use of imaging in the diagnosis and staging of hepatobiliary malignancies[J].Surg Oncol Clin N Am,2007,16(2):343-368.
[17]Guarise A,Venturini S,Faccioli N,et al.Role of magnetic resonance in characterising extrahepatic cholangiocarcinomas[J].Radiol Med,2006,111(4):526-538.
[18]OttoG,Romaneehsen B,Hoppe-LotichiusM,etal.Hilar cholangiocarcinoma:resectability and radicality after routine diagnostic imaging[J].J Hepatobiliary Pancreat Surg,2004,11(5):310-318.

