细胞色素P450 CYP2D6*10B缺陷等位基因与利培酮治疗效应的关系
郭晓云成俊祥江开达杨 瑞杨献军
细胞色素P450 CYP2D6*10B缺陷等位基因与利培酮治疗效应的关系
郭晓云1成俊祥2江开达1杨 瑞3杨献军3
目的 探讨CYP2D6*10B缺陷等位基因与利培酮治疗效应的关系。方法 采用等位基因的特异性扩增法,根据是否含有突变型CYP2D6*10B缺陷等位基因将70例精神分裂症患者分为野生型等位基因的纯合型(w/w)组(16例),突变型等位基因的纯合型(m/m)组(16例)以及野生型和突变型等位基因的杂合型(m/w)组(38例),观察3组患者利培酮4~6 mg/d治疗6周后疗效与不良反应。采用阳性和阴性症状量表(PANSS)评价疗效,副反应量表(TESS)和锥体外系不良反应量表(RSESE)评定药物不良反应。PANSS减分率≥30%为有效。结果 治疗6周后,有效者58例。有效组w等位基因频率(0.43)明显低于无效组(0.83),有效组的m等位频率(0.57)明显高于无效组(0.17)。自第4周起,m/w,m/m型PANSS减分值明显多于w/w型。3种基因型患者组间不良反应差异无统计学意义。结论 利培酮治疗携带CYP2D6*10B缺陷等位基因患者的疗效优于治疗野生型等位基因患者的疗效。CYP2D6*10B缺陷等位基因与利培酮不良反应无关联。
精神分裂症 细胞色素P450 CYP2D6 基因型 抗精神病药 治疗结果
利培酮是第二代抗精神病药物,主要由肝脏细胞色素P4502D6酶(CYP2D6)通过羟化反应进行代谢[1]。CYP2D6的基因多态性是导致酶活性差异的重要原因,也是不同人群中利培酮的疗效及耐受性不同的重要因素[2,3]。CYP2D6*10B缺陷等位基因在中国人群中常见,本研究探讨CYP2D6*10B缺陷等位基因与利培酮疗效和耐受性之间的关系。
1 对象与方法
1.1 对象
研究对象为2003年7月至2004年1月新乡医学院第二附属医院的汉族首发或复发精神分裂症患者,符合中国精神障碍分类与诊断标准第3版中精神分裂症的诊断标准。排除酒精依赖或其他精神活性物质所致精神障碍,排除妊娠或哺乳期妇女,排除共病其他精神障碍患者。年龄15~50岁,总病程≤5年,入组前至少2周内未用过抗精神病药,入组时血尿常规、肝功能及心电图均正常。共入组70例,男性32例,女性38例。所有研究对象均为河南籍。入组对象的筛选及评定工作均由第一作者完成。
1.2 方法
1.2.1 利培酮疗效的评定 在利培酮治疗前及治疗第2、4、6周末采用阳性与阴性综合征量表(positive and negative syndrome scale,PANSS)评估病情。基线时收集其他临床资料。单一使用利培酮(商品名:维思通,杨森制药公司生产)治疗。在治疗1周内加量至治疗剂量4~6 mg/d,随访6周。研究期间不合用其他抗精神病药或电休克治疗,必要时可合用苯二氮卓艹类及抗震颤麻痹药。研究期间不吸烟,不饮酒。以PANSS减分率[(治疗前评分-治疗后评分)/(治疗前评分-30)×100%]确定疗效,≥30%为有效,<30%无效[4]。每周用副反应量表(TESS)和锥体外系不良反应量表(RSESE)评定药物不良反应。
1.2.2 基因组DNA提取 在利培酮治疗前收集患者外周血5ml(依地酸抗凝)。根据抗凝静脉血标准,用碘化钠法提取基因组DNA,-20℃备用[5]。
1.2.3 等位基因特异扩增法(allele specific-PCR)引物 公用引物:5ˊ-acc agg ccc ctc cac cgg-3ˊ,野生型引物a:5ˊ-agg ggg cct ggt gg-3ˊ,突变型引物b:5ˊ-agg ggg cct ggt ga-3ˊ,内对照引物β上:5ˊ-gaa gag cca agg aca ggt ac-3ˊ和引物β下:5ˊ-caa ctt cat cca cgt tca cc-3ˊ。PCR反应体系:双蒸水7.8 μl,10×PCR反应缓冲液2.0 μl,氯化镁(MgCl2)(25 mmol/l)1.7μl,β上(10 mmol/l)0.35 μl,β下(10 mmol/l)0.35 μl,公用引物1 μl,引物a或b 1μl,磷酸脱氧核苷酸(d NTP)3.0 μl,Taq DNA聚合酶0. 8 μl,DNA样本2.0 μl,反应体系总共20 μl。PCR循环条件:①95℃12 min;②95℃1 min;③66℃1 min;④72℃1 min;将②③④重复5个循环;⑤95℃1 min;⑥60℃1 min;⑦72℃1 min;将⑤⑥⑦重复20个循环;⑧95℃1 min;⑨55℃1 min;⑩72℃1 min;将⑧⑨⑩重复5个循环;72℃10 min;4℃冷却。
1.2.4 基因型的判读 每个样本均在2个反应体系中进行试验。在反应体系1中加入公用引物和引物a,在反应体系2中加入公用引物和引物b,若只有反应体系1中可以扩增出长度为397 bp的产物片段,则为野生型等位基因的纯合型(w/w);若只有反应体系2种可以扩增出397 bp的产物片段,则为
CYP2D6*10B缺陷突变型等位基因纯合型,简称突变型等位基因的纯和型(m/m);若两体系都能扩增出397 bp的产物片段,则为野生型和突变型等位基因的杂合型(m/w)。采用内对照引物β上和β下扩增出长度为268 bp的β珠蛋白基因。每个样本体系重复3次。扩增产物用1.5%的琼脂糖凝胶电泳并用bio图像分析系统保存图像。
1.2.5 统计学检验 采用SPSS11.5统计软件。用χ2检验比较3种基因型间患者性别、家族史构成以及有效和无效组基因型和基因频率构成,其中家族史和基因型构成采用Fisher精确法。采用单因素方差分析比较3种基因型间患者年龄、病程、基线PANSS分,以及随访过程中组间药物不良反应的差异,其中病程为偏态分布,采用秩变换后单因素方差分析比较。采用协方差分析(基线PANSS分、病程作为协变量)比较随访过程中组间药物疗效的差异。
2 结果
2.1 3种基因型精神分裂症患者的一般资料比较
3种基因型(w/w、m/w、m/m)患者分别有16
例、38例和16例。不同基因型患者的性别构成、阳性家族史比例、年龄、病程的差异无统计学意义,见表1。
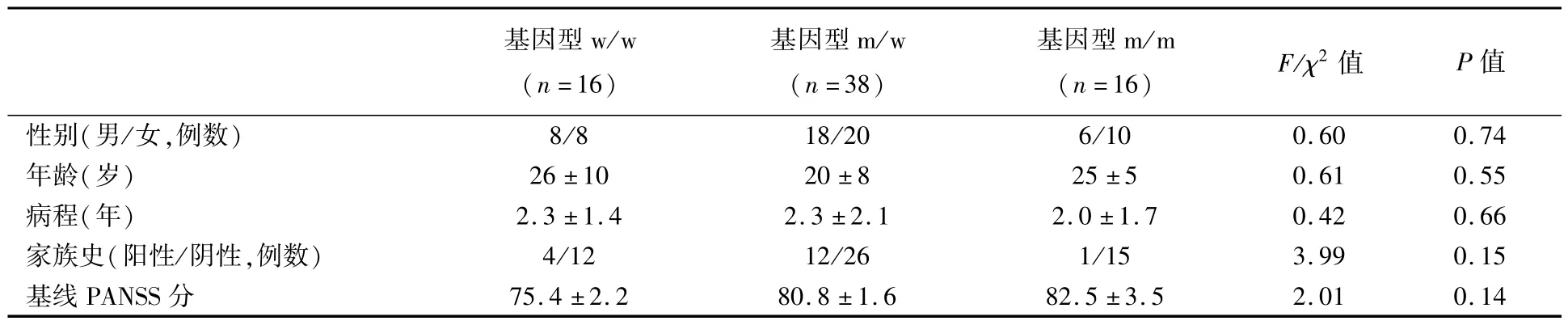
表1 70例不同基因型的精神分裂症患者的一般资料
2.2 w/w、m/w、m/m基因型患者利培酮治疗疗效的比较
利培酮治疗6周后,治疗有效58例,无效12例。有效组和无效组3种基因型的构成差别有统计学意义(Fisher精确概率计算法,P=0.001)。有效组w/w基因型频率明显低于无效组,有效组的m/m基因型频率明显高于无效组。有效组w型等位基因频率明显低于无效组,m型等位基因频率明显高于无效组。见表2。自第4周起,m/w,m/m型PANSS减分值明显多于w/w型,见表3。
2.3 w/w,m/w,m/m基因型患者间不良反应的比较
将每例患者6次TESS、RSESE量表分取均数后,比较m/m、m/w、w/w基因型患者TESS、RSESE量表分,发现三种基因型间TESS、RSESE量表分差异无统计学意义,见表4。

表2 利培酮治疗有效组和无效组的基因型构成

表3 w/w、m/w、m/m基因型患者PANSS减分值比较 ¯x±s,分
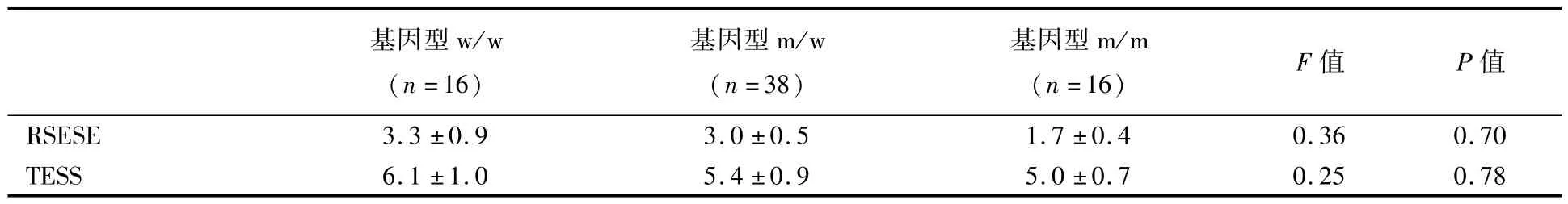
表4 w/w、m/w、m/m基因型患者TESS、RSESE评分 ¯x±s,分
3 讨论
药物代谢强度与CYP2D6基因多态性有关:快代谢型(extensive metabolizer,EM)携带2个有功能的等位基因,慢代谢型(poor metabolizers,PM)携带2个无功能的突变等位基因,中等代谢表现型(intermediate metabolizer,IM)只携带一个有功能的突变等位基因或2个使酶活性减弱的突变等位基因。CYP2D6基因位于22号常染色体上,长9 432个bp,为隐性遗传。CYP2D6基因有70余种等位基因变异型,CYP2D6*10主要分布于亚洲,CYP2D6 *10B(旧名CYP2D6Ch1)缺陷等位基因在中国人群中常见[6],该缺陷基因的外显子1第188位碱基C被T置换,造成表达的蛋白第34位的脯氨酸变成丝氨酸,从而导致所生成酶的活性下降。
利培酮在人体内主要由CYP2D6通过羟化作用代谢,代谢物9-羟利培酮与母药利培酮都具有药理活性。本结果发现,CYP2D6*10B缺陷等位基因与利培酮的治疗疗效相关,PANSS减分随T等位基因的增加而升高,对该结果的解释可能在于随利培酮代谢变慢,血药浓度维持在高水平。国内黄颐等[4]研究发现,CYP2D6*10各基因型之间的利培酮疗效存在显著性差异。Hendset等[7]发现,CYP2D6活性下降可导致血浆利培酮与9-羟利培酮浓度之和升高80%(使用利培酮长效针剂)和32%(使用利培酮口服制剂)。Llerena等[8]和Leon等[9]研究发现,CYP2D6基因型可影响口服利培酮的药代动力学特征,必要时需要根据基因型进行剂量调整。CYP2D6 *10B缺陷等位基因导致所生成酶的活性下降,而酶活性的下降导致利培酮在体内的代谢减慢,在体内滞留时间加长,因而导致含CYP2D6酶基因CYP2D6*10B缺陷等位基因的患者使用利培酮治疗疗效更好。
本研究没有发现CYP2D6*10B缺陷等位基因与利培酮不良反应之间存在关联。黄颐等[4]也没有发现CYP2D6基因多态性与利培酮不良反应之间存在关联。这些结果提示CYP2D6*10B缺陷等位基因与利培酮的不良反应之间可能没有相关性。对这一结果的另一种解释是可能利培酮不良反应发生少,确定等位基因与不良反应之间的关系,需要更大样本量、随访更长时间。
本研究采用等位基因的特异扩增法检测CYP2D6*10B缺陷等位基因,该方法是20世纪90年代发展起来的一项技术[10],它利用PCR扩增中引物3’末端碱基互配时要求最为严格的原理,设计了等位基因特异的引物、扩增后的结果有两种可能性:只有野生型等位基因特异的引物有扩增,说明检样只含野生型等位基因,为野生型纯合子;只有突变型等位基因特异的引物有扩增,说明检样只含突变型等位基因,为突变型纯合子;野生型和突变型等位基因均有扩增,说明检样是杂合子。该方法已经被多次试验验证[11],具有非常好的重复性,由于操作流程的简化,污染程度减少,从而减少假阳性结果。
本研究存在不足之处,样本量偏小,入组病例并非随机化。尽管如此,本研究结果还是支持以下结论,即携带CYP2D6*10B缺陷等位基因的中国精神分裂症患者使用利培酮治疗疗效可能优于携带野生型等位基因患者的。中国人群多携带CYP2D6* 10B缺陷等位基因,本研究结果对于优化用药模式,进一步寻找利培酮治疗疗效的指标,具有重要意义。
1 Aravagiri M,Marder SR,Wirshing D,et al.Plasma concentrations of risperidone and its 9-hydroxy metabolite and their relationship to dose in schizophrenic patients:simultaneous determination by a high performance liquid chromatography with electrochemical detection.Pharmacopsychiat,1998,31(3):102-109.
2 Mihara K,Kondo T,Yasui-Furukori N,et al.Effects of various CYP2D6 genotype on the steady-state plasma concentrations of risperidone and its active metabolite,9-hydrooxyrisperidone,in Japanese patients with schizophrenia.Ther Drug Monit,2003,25(3):287-293.
3 Berecz R,LLerena A,de la Rubia A,et al.Relationship between risperidone and 9-hydroxy-risperidone plasma concentration and CYP2D6 enzyme activity in psychiatric patients.Pharmacopsychiat,2002,35(6):231-234.
4 黄颐,刘协和,许珂,等.精神分裂症患者细胞色素P450 2D6酶基因多态性与利培酮治疗效应的关系.中华精神科杂志,2002,35(2):103-106.
5 Loparev VN,Cartas MA,Monken CE,et al.An efficient and simple method of DNA extraction from whole blood and cell lines to identify infectious agents.J Virol Methods,1991,34(1):105-112.
6 蔡卫民,陈冰,陶欣,等.细胞色素P4502D6酶基因多态性与右美沙芬氧化代谢的相关研究.中华医学遗传学杂志,2000,17(3):181-184.
7 Hendset M,Molden E,Refsum H,et al.Impact of CYP2D6 genotype on steady-state serum concentrations of risperidone and 9-hydroxyrisperidone in patients using long-acting injectable risperidone.J Clin Psychopharmacol,2009,29(6):537-541.
8 Llerena A,Berecz R,Dorado P,et al.QTc interval,CYP2D6 and CYP2C9 genotypes and risperidone plasma concentrations.J Psychopharmacol,2004,18(2):189-193.
9 Leon J,Susce MT,Pan RM,et al.A study of genetic(CYP2D6 and ABCB1)and environmental(drug inhibitors and inducers)variables that may influence plasma risperidone levels.Pharmacopsychiat,2007,40(3):93-102.
10 Heim M,Meyer UA.Genotyping of poor metabolisers of debrisoquine by allele-specific PCR amplification.Lancet,1990,336(8714):529-532.
11 Wang WP,Ni KY,Zhou GH.Multiplex single nucleotide polymorphism genotyping by adapter ligation-mediated allele-specific amplification.Analyt biochemist,2006,355(2):240-248.
Objective:To investigate relationship between CYP2D6*10B mutation genotype and therapeutic effect of risperidone.Methods:Using allele-specific PCR to separate 70 schizophrenia patients into 3 genotypes:wild type homozygosis(w/w)(16 cases),wild and mutation type heterozygosis(w/m)(38 cases),and mutation type homozygosis(m/m)(16 cases).Difference of therapeutic and side effect in patients treated with risperidone 4-6 mg/d for 4 weeks were evaluated among three genotypes.Using positive and negative symdrome scale(PANSS)to evaluate therapeutic effect every 2 weeks.Using treatment emergent symptom scale(TESS)and rating scale for extrapyramidal side effects(RSESE)to evaluate side effect every week.Response is defined as reduction of PANSS total score≥30%.Results:After 6-week therapy,58 patients were rated as responders and 12 patients non-responders.Frequency of w allele was lower in response group(0.43)than in non-response group(0.83),while frequency of m allele was higher in response group(0.57)than in non-response group(0.17).Reduction of PANSS score was superior in m/w,m/m group than in w/w group from week 4 of treatment.There was no difference in side effect among 3 genotype groups. Conclusion:Response to risperidone is superior in patients carrying defective CYP2D6*10B allele to wildtype genotype.Defective CYP2D6*10B allele does not relate to adverse reactions of risperidone.
Schizophrenia Cytochrome P450 CYP2D6 Genotype Antipsychotic agents Treatment outcome
2009-09-10)
(本文编辑:张红霞)
Relationship between cytochrome P450 CYP2D6*10B gene and therapeutic effect of risperidone Guo Xiaoyun1,Cheng Junxiang2,Jiang Kaida1,Yang Rui3,Yang Xianjun3.1.Shanghai Menyal Healyh Cenyer,Shanghai Jiaoyong Universiyy School of Medicine,Shanghai 200030;2.Second Affiliayed Hospiyal,Xin Xiang Medical College,Henan Provence,Xinxiang 453003;3.Xinxiang Medical College,Henan Provence,Xinxiang 453003
1.上海交通大学医学院附属精神卫生中心 200032;2.新乡医学院第二附属医院 453003;3.新乡医学院 453003。通信作者:成俊祥,电子信箱cheng-junxiang@163.com;江开达,电子信箱jiangkaida@yahoo.com.cn

