甜菜根际土壤AM真菌分离与分子鉴定
接伟光,蔡柏岩,2,白 莉
(1.黑龙江东方学院食品与环境工程学部,哈尔滨150086;2.黑龙江大学生命科学学院微生物学重点实验室,哈尔滨 150080)
AM真菌是自然界中普遍存在的一种寡营养活体微生物,能够侵染80%以上的陆生植物根系[1-3]。AM真菌具有能够提高植物对营养元素的吸收,促进植物生长,提高植物抗病性,增强植物对盐碱和污染物毒害的耐性,增加作物产量和改善品质等作用[4-6]。近年来,AM真菌在农作物上的应用已受到国内外广大学者的重视,有关AM真菌的接种效应已在不同农作物的研究中得到证实。
甜菜是我国重要的糖料作物之一,在我国已有上百年的栽培历史,但长期以来甜菜在产质量及抗病方面没有突破性的研究进展,使我国的甜菜科研水平整体落后于发达国家[7,8]。目前,有关菌根方面的研究报道较多,但在甜菜方面的研究却少有报道。本文将传统形态分类鉴定方法与现代分子生物学技术相结合,对甜菜根际土壤AM真菌进行鉴定及对AM真菌侵染甜菜根系情况进行分子检测,旨在为进一步开展甜菜AM真菌的基础研究及AM真菌在甜菜上的应用奠定基础。
1 材料和方法
1.1 试验材料
2008年7月30日从哈尔滨工业大学糖业研究所试验田随机选取10株长势良好的甜菜,每株作为1个样地,每个样地按东西南北4个方位,去除表层5cm厚的杂物,采集10~20cm土层土样约1kg,同时收集其中的甜菜根系。将10个样地采集的甜菜根系及根围土壤分别充分混匀,各自组成1个混合样品,土样于阴凉处自然风干后,置于阴凉处保存备用。根样带回实验室洗净后,立即提取DNA后,置于-80℃保存备用。
1.2 方法
1.2.1 AM真菌孢子形态鉴定 采用湿筛倾析-蔗糖离心法[9]分离甜菜根围土壤AM真菌孢子,于解剖镜下观察其颜色并测定孢子大小、孢壁层次和厚度等,并初步分类。
1.2.2 AM真菌单孢DNA的提取 依据蔡柏岩等[10]描述的方法稍加修改,吸取单个AM真菌孢子,至少用无菌水漂洗5次,将其放入无菌的1.5mL离心管中,加入40μL TE缓冲液(10mmol/L Tris-HCl,1mmol/L EDTA,pH 8.0),将其充分破碎后,加入 15μL 20%Chelex-100。 沸水浴 10min,冰浴 5min,15000r/min 离心 5min,吸取上清液到新的离心管中,置于-80℃保存,备用。
1.2.3 Nested-PCR 将上述AM真菌单孢DNA作为第一次PCR扩增模板,第一次PCR扩增产物100倍稀释后作为第二次PCR扩增模板,进行Nested-PCR。引物序列(表1),由上海生工生物工程有限公司合成。
第一次 PCR 扩增, 反应体系为 20μL:10×PCR 缓冲液 2μL,2.5mmol/L dNTP 1.6μL,25mmol/L MgCl22μL,1.0μmol/L 的引 物 ITS1 和 NDL22 各 2μL,5 U/μL Taq polymerase 0.2μL, 模板 DNA 2.0μL,ddH2O 8.2μL。反应程序为:95℃预变性 3min;93℃变性 1min,55℃退火 1min,72℃延伸 1min,30个循环,最后 72℃延伸5min。第二次PCR扩增,反应体系仅将引物对改为LR1-NDL22。反应程序仅将退火温度改为53℃。取两次PCR扩增产物各5μL,用1.0%琼脂糖凝胶电泳检测。

表1 Nested-PCR引物
1.2.4 目标DNA片段的测序及系统发育分析 将阳性克隆产物与pGM-T(TIANGEN公司)载体连接,转化大肠杆菌DH5α感受态细胞,检测重组子,将阳性克隆菌测序。测序结果提交至GenBank核酸序列数据库,将扩增序列与GenBank中近缘种的序列进行缺省参数的对位排列(alignment),并构建系统发育树。
1.2.5 AM真菌侵染甜菜根系检测 根据测序结果及系统发育分析结果,设计相应AM真菌种特异性引物,检测AM真菌侵染甜菜根系情况。
提取根样DNA,方法同AM真菌单孢DNA的提取。第一次PCR扩增,反应体系及程序同AM真菌单孢DNA Nested-PCR中的第二次PCR;第二次PCR扩增,反应体系仅将第一次PCR扩增中使用的真核生物通用引物对改为AM真菌种特异性引物对。反应程序仅将退火温度改为58℃。分别取两次PCR扩增产物各5μL,用1.2%琼脂糖凝胶电泳检测。将扩增产物进行测序,并进行blast分析。
2 结果与分析
2.1 AM真菌孢子形态特征
从甜菜根围土壤中分离出大量AM真菌孢子,经形态学鉴定,均为摩西球囊霉Glomus mosseae(T.H.Nicolson&Gerd.)Gerd.&Trappe,Mycologia Memoir,5:76,1974。其形态特征如下:孢子在土壤中单生、根内生或孢子果内形成;圆形,近圆形,直径180~210μm,淡黄色至黄褐色;孢壁3层,L1和L2无色透明,L3浅黄至黄褐色。连孢菌丝单根,连点漏斗状。标本号:DFAM。标本保存于黑龙江东方学院微生物学实验室。
2.2 AM真菌单孢DNA Nested-PCR
由于AM真菌DNA的含量较低,经第一次PCR扩增后,难以在琼脂糖凝胶中观察到相应AM真菌的DNA带型。经扩增序列覆盖核糖体25S rDNA中D1/D2可变区域的引物对LR1-NDL22进行第二次PCR扩增后,AM真菌相应DNA序列被特异性地扩增出来,片段大小约为750bp(图1)。可见,通过Nested-PCR的放大作用,能够很好地将含量较低的靶模板DNA特异性扩增出来。
2.3 AM真菌25S rDNA D1/D2区测序及系统发育分析
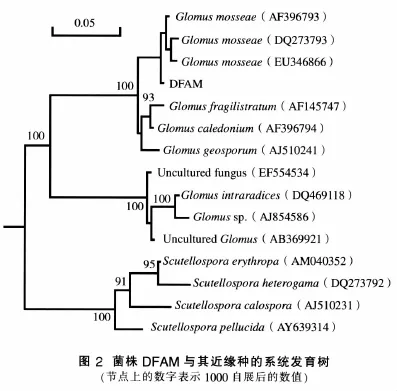
测序结果表明,扩增的DNA序列全长为787bp,在GenBank中的登录号为FJ790677。为显示供试菌株与已知AM真菌之间的亲缘关系及其系统地位,将测得序列在GenBank中进行同源序列比对,并构建系统发育进化树(图2)。菌株DFAM序列与数据库中同源性较高的14个AM真菌进行比较,其25S rDNA D1/D2区序列与球囊霉属Glomus的7个种和1个未培养真菌都有较高的序列同源性,其中与Glomus mosseae(DQ273793)的同源性最高,为98%。从系统发育树可以看出,DFAM与Glomus mosseae能聚为一簇。综合形态学特征及25S rDNA D1/D2区序列分析,将DFAM鉴定为摩西球囊霉G.mosseae。

2.4 甜菜菌根内AM真菌的分子检测
利用AM真菌种特异性引物5.25[13]:5′-ATCAACCTTTTGAGCTCG-3′与 引 物 NDL22配对,能够特异性地检测G.mosseae侵染甜菜根系情况。
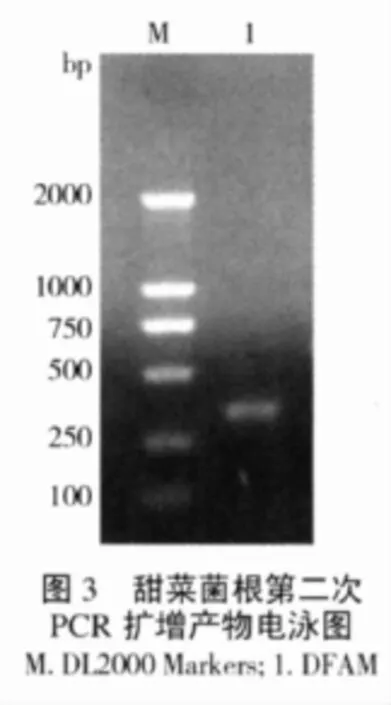
第一次PCR扩增,结果与AM真菌单孢DNA的第一次PCR扩增结果类似,难以在琼脂糖凝胶中观察到大约750bp的AM真菌25S rDNA D1/D2区带型。经第二次PCR扩增后,检测到编号为DFAM的相应目的片段,约为370bp,与预期结果一致(图3)。该目的片段经测序及blast分析,证实为AM真菌特异性条带,确定摩西球囊霉G.mosseae侵染甜菜根系。
3 讨论
对侵染植物根系的AM真菌进行准确鉴定是菌根研究的基础,对于收集、保护及利用这类微生物资源具有重要的意义。目前,AM真菌的分子鉴定工作,国外已有研究报道,国内开展得则很少[10,14]。本文应用传统AM真菌鉴定方法与现代分子生物学技术相结合对甜菜根围AM真菌进行鉴定,能够较全面、准确地对其进行鉴定,同时提高了试验结果的真实性。
由于AM真菌单孢和菌根中AM真菌DNA含量低,本试验在提取DNA时使用了能够整合多价金属离子,尤其是选择性整合二价离子的Chelex-100化学整合树脂。该树脂含有成对的亚氨基二乙酸盐离子,比普通离子交换剂具有更高的金属离子选择性和较强的结合力,能结合许多可能影响一些分析的其他外源物质。通过离心除去Chelex-100颗粒,使这些与Chelex-100结合的物质与DNA分离,防止结合到Chelex-100中的抑制剂或杂质带到PCR反应中,影响下一步的DNA分析,并通过结合金属离子,防止DNA降解,保证了提取DNA的质量。
本研究从甜菜根围土壤中分离到G.mosseae,并且采用AM真菌种特异性引物,利用具有较高灵敏性的Nested-PCR技术对甜菜根系AM真菌DNA进行特异性扩增,检测到目标带,证明G.mosseae侵染甜菜根系,为今后甜菜功能菌群及甜菜种植的进一步深入研究奠定了良好的基础。同时,再次验证了Nested-PCR技术对研究野外条件下的AM真菌生态学极为有益。
[1]Bharadwaj D P,Lundquist P O,Alstrom S,et al.Impact of plant species grown as monocultures on sporulation and root colonization by native arbuscular mycorrhizal fungi in potato[J].Applied Soil Ecology,2007,35(1):213-225.
[2]Grigera M,Rhae A,Drijber,Brian J,et al.Increased abundance of arbuscular mycorrhizal fungi in soil coincides with the reproductive stages of maize[J].Soil Biology and Biochemistry,2007,39(7):1401-1409.
[3]Violi H A,Alejandro F,Wright S F,et al.Disturbance changes arbuscular mycorrhizal fungal phenology and soil glomalin concentrations but not fungal spore composition in montane rainforests in Veracruz and Chiapas,Mexico[J].Forest Ecology and Management,2008,254:276-290.
[4]Dupré H,Joner E J,Leyval C,et al.Role and influence of mycorrhizal fungi on radiocesium accumulation by plants[J].Journal of Environmental Radioactivity,2008,99(5):785-900.
[5]Bedini S,Avio L,Argese E,et al.Effects of long-term land use on arbuscular mycorrhizal fungi and glomalin-related soil protein[J].Agriculture,Ecosystems and Environment,2007,120:463-466.
[6]于永光,赵斌.不同pH水平下两种菌根真菌对紫云英生长的影响及其相互作用[J].菌物学报,2008,7(2):209-216.
[7]吴则东,王华忠,韩英.甜菜SSR-PCR反应体系的优化[J].中国糖料,2008(1):11-17.
[8]王燕飞,陈丽君,刘华君,等.我国甜菜诱变育种方法研究进展[J].中国糖料,2008(4):66-68.
[9]刘润进,陈应龙.菌根学[M].北京:科学出版社,2007,1-404.
[10]蔡柏岩,接伟光,葛菁萍,等.黄檗根围丛枝菌根(AM)真菌的分离与分子鉴定[J].菌物学报,2008,27(6):884-893.
[11]White T J,Bruns T,Lee S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[A].PCR protocols,a guide to methods and applications[C].San Diego:Academic Press,1990,315-322.
[12]Van Tuinen D,Zhao B,Gianinazzi-Pearson V.PCR in studies of AM fungi:from primers to application[C].In Varma AK (ed.)Mycorrhiza manual.Springer Verlag,Heidelberg,1998,387-399.
[13]Van Tuinen D,Jacquot E,Zhao B,et al.Characterization of root colonization profiles by a microcosm community of arbuscular mycorrhizal fungi using 25S rDNA-targeted nested PCR[J].Molecular Ecology,1998,7(7):879-887.
[14]接伟光,蔡柏岩,葛菁萍,等.黄檗丛枝菌根真菌鉴定[J].生物技术,2007,17(6):32-35.

