甜菜EST-SSR引物的开发与应用
史树德,魏 磊,张子义,邵金旺,田自华
(1.内蒙古农业大学农学院,呼和浩特 010019;2.内蒙古农业大学生命科学院,呼和浩特 010018;3.内蒙古农业大学甜菜生理研究所,呼和浩特 010018)
甜菜是我国主要经济作物之一,其不仅是主要的制糖工业原料,也是发展畜牧业的优良饲料,更是新兴的能源作物,在农业产业结构调整和发展地方经济中占有重要地位。但由于中国不是甜菜起源国,缺少种质资源,再加之相关研究积淀较薄,使我国的甜菜研究水平整体落后,甜菜育种水平落后于发达国家。而随着基因组学研究的飞速发展,分子设计育种成为作物遗传改良的重要途径之一,新的分子标记不断被开发和广泛应用,从而加速了作物基因组辅助育种和设计育种的进程[1]。近几年,国内外在甜菜分子生物学领域的研究正在兴起,但可利用分子标记的匮乏严重制约其发展。目前,在甜菜基因组辅助育种研究中应用到的分子标记十分有限,仅有关于 RAPD[2-6]、AFLP 和 SNP[7]以及少数 SSR[8-11]、ISSR[12]标记的初步报道,其中可利用的甜菜SSR标记很少。
简单序列重复(simple sequence repeats,SSRs)或微卫星(microsatellites)是以 1~6个碱基为基元的串联重复序列,它们普遍存在和均匀分布于大多数真核生物的基因组中,重复数高度变异[13-15]。SSR标记具有多态性高、容易用PCR检测、重复性高等特点,作为理想的分子标记已广泛应用到许多植物的遗传学研究中[16-18]。SSR标记的开发有几种[19-22]。EST-SSR是近年发展起来的新型分子标记,作为表达基因部分序列的EST和cDNA数据近年来高速增加。截至2011年3月1日,GenBank(http://www.ncbi.nlm.nih.gov/dbEST)中的甜菜EST数据已有29830条。EST-SSR反映了基因的编码部分,可以直接获得基因表达的信息,为功能基因提供“绝对”的标记,使得有可能对决定重要表型或农艺性状的等位基因进行直接鉴定,省去了SSR引物开发过程中的克隆和测序步骤,充分利用了现有测序数据,降低了开发成本,EST-SSR的开发在多种作物中已有报道[23-27]。
为此,本研究目的是利用GenBank中已有的EST序列,开发基于EST序列的SSR标记,并用其进行甜菜种质资源的遗传多样性验证,以筛选多态性高、重复性好的EST-SSR标记;评价收集的甜菜种质资源遗传多样性,为建立甜菜高密度遗传图谱、功能性分子标记发掘、重要农艺性状QTLs克隆等研究奠定基础。
1 材料与方法
1.1 供试材料
本试验所用甜菜品种为甜研309和KWS9412,KWS9419,KWS5416,农大甜研4号和包育302,种植于温室,采用CTAB法[28]提取甜菜苗期新鲜叶片基因组DNA。
1.2 EST-SSR的引物开发
首先计算机安装PC版perl程序,然后从GenBank/dbEST(http://www.ncbi.nlm.nih/entrez)中以FASTA格式下载sugar beet和Beta vulgaris L.中所有的EST序列,共29830条。 利用Blastclust(v.2.2.10;http://www.ncbi.nih.gov/web/newsltr/spring04/blastlab.htm)软件,对这些EST序列进行冗余性查找,利用CD_HIT(http://www.bioinformatics.org/cd-hit/)快速批量去冗余序列;利用 est_timmer(http://pgrc.ipk-gatersleben.de/misa/)去除EST 序列中过短的序列(<100bp)和过长的序列(>700bp)以及 mRNA 的“帽子”和“尾巴”,利用 misa.pl(http://pgrc.ipk-gatersleben.de/misa/)识别和定位SSR,其中配置文件misa.ini用来设置识别SSR标记的标准;利用primer3模块批量设计SSR引物,引物设计的主要参数是,引物长度20~26bp;退火温度Tm值48℃~65℃;(G+C)含量30%~70%;PCR扩增产物长度大于150bp;利用MacVector7.0软件对所设计的引物进行验证,引物由上海生工生物技术有限公司合成。
1.3 EST-SSR的扩增与检测
PCR反应在25μL的体积中进行,含PCR缓冲液、50~80 ng的模板DNA、1.5 U Taq聚合酶,上、下游引物各0.5μmol/L、200μmol/L dNTP和2.0 mmol/L MgCl2。整个反应过程在PE 9700上进行,循环条件是:94℃预变性3min;然后35个循环,每个循环包括94℃变性45s,复性的合适温度通过温度梯度实验确定,并尽可能提高复性温度以增加特异性,复性时间60s,72℃延伸1min 20s;最后于72℃延伸8min。复性温度低于50℃仍无产物出现,则认为该引物不能扩增。PCR产物经2.5%琼脂糖凝胶电泳检测。
1.4 多态信息含量和遗传相似系数分析
多态信息含量常被用来评估所设计引物的潜在利用率。本实验的每个EST-SSR引物的多态信息含量按Park等[29]提供的公式计算,即其中Pi为i位点的基因频率,n为等位基因数。遗传相似系数分析利用NTSYS-pc软件[30]的SIMQUAL模块计算6个甜菜品种间的遗传相似系数。然后基于遗传相似系数矩阵,依据UPGMA算法并利用NTSYS-pc软件的SHAN聚类程序对6个材料进行聚类分析。
2 结果和分析
2.1 甜菜EST-SSR的特征
从NCBI网站下载的29830条主要来源于sugar beet和Beta vulgaris L.的EST序列(截止2011年3月1日)。经过除去ploy A或T“尾巴”和载体等序列后共获得20109条无冗余EST序列,序列总长度为11287687bp。按照上述查找标准,共发现6951条至少含有1个SSR的EST序列,占无冗余EST总数的34.6%,表明甜菜EST-SSR含量比较丰富。按照SSR具体实验引物设计要求,从4338个SSR重复中设计得到2845对EST-SSR引物。这些引物对中有1052个含有1个SSR重复,其余1793对含有2个或2个以上的SSR重复。在鉴定的SSR中A/T单碱基重复最多,其最少重复9次,最大重复28次;AAG/CTT三核苷酸重复次之,最少重复5次;AG/CT二核苷酸重复居第三,最少重复6次;四、五和六核苷酸重复数量最少,其最少重复5次(见表1);在同一条EST序列中所含2个SSR位点之间最小相距2个核苷酸,最大相距100个核苷酸。其中除单核苷酸重复外,AAG/CTT三核苷酸重复基元是出现频率最高的EST-SSR类型,占总SSR的12.7%,AG/CT次之,占10.4%,ACCTCC/AGGTGG等六核苷酸重复最少,约占1%。

表1 在20109条甜菜EST序列中发掘的不同基元的SSR数量及百分率统计
2.2 EST-SSR引物的扩增效率
在所得的2845对SSR引物中随机挑选并合成了100个SSR引物对,在前述给定的条件下对6个品种甜菜基因组DNA进行PCR扩增,有47对(47%)引物扩增出了SSR特征条带,共产生621个位点,平均每对引物产生13.2个位点。表2为47个具有功能性引物对的相关信息。在47个功能性引物对中,有14个引物对(29.7%)扩增出1条产物带,有25个引物对(31.9%)扩增出2条条带,8个引物对(17.2%)扩增出2条以上条带;有38个引物对的扩增产物在预期片段大小范围之内,占功能性引物对的80.8%,9个引物对的扩增产物小于预期片段大小;此外,在33个扩增出2条或2条以上条带的引物对中,有9个引物对扩增出比预期片段大的条带,在47个功能性引物对中,有25个引物对在6个甜菜品种间扩增出多态性,多态性引物对占53.2%。25个引物对在6个品种中共扩增出138个多态性标记。
2.3 EST-SSR引物的多态性分析
每对引物的多态性信息含量用PIC值表示,并用量估计等位基因的变异情况。依据47对引物在6个甜菜品种中扩增得到的等位基因的变异信息来计算各引物的PIC值。它们的PIC值变化在0.13~0.71之间,平均为0.47,引物S9的PIC值最大,达0.71;而引物S10的最小,只有0.13。
2.4 遗传相似系数分析
基于这 25个多态性EST-SSR标记,依据UPGMA算法利用NTSYS-pc2.1软件将本研究所用6个甜菜品种进行聚类分析,可将6个品种划分为不同的两组(图1):第一组为国内品种,其中甜研309与农大甜研4号和包育302亲缘关系较远,第二组为亲缘关系较近的德国KWS系列3个品种,系统发育分析表明国内外两组材料亲缘关系较远,遗传相似度较低,相似系数为0.31。

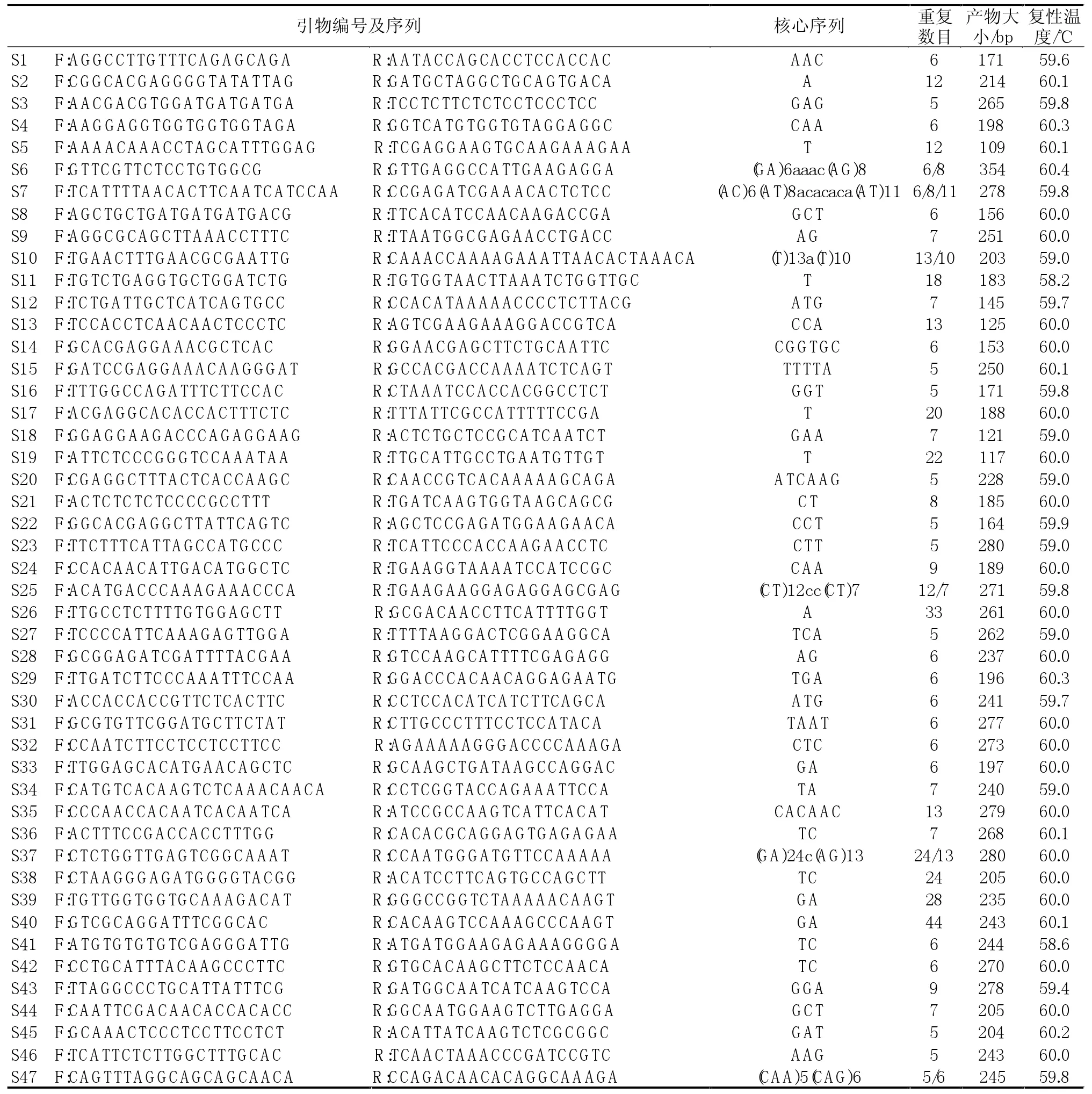
表2 甜菜ESTs中分离到的部分微卫星引物
3 讨论
与其他分子标记相比,EST-SSR标记来自表达基因的全部或部分序列,其多态性可能直接与该基因功能相联系。研究发现,水稻的蜡质基因5'端非编码区中的SSR序列(CT)n长度变化不仅与直链淀粉的含量有关[31],而且还决定了糯稻淀粉的理化特性[32]。因此根据EST包含的SSR位点开发的分子标记,是直接与功能相关的功能标记[33],EST-SSR标记的这一特点决定了其在功能基因标记方面应用前景广阔。
本研究中,多态信息位点PIC值变化在0.13~0.71之间,较已知甜菜SSR标记PIC值低[34],可能是由于EST标记来源于基因编码区,具有很高的保守性,因此它们在品种之间的多态性要低于来源其它基因组区域分子标记[35],但是通过根据EST 5'端或3'端的UTR区开发的SSR标记多态性要稍好些[33]。因此,在设计引物时,可设定软件条件,应尽量使引物靠近3'或5'端非编翻译区。本研究中较低的PIC值与张艳欣和Taliercio等人的研究结果一致[36,18],表明基于表达基因的EST-SSR标记的多态性确实低于基因组SSR[37]。在100对引物中有47对成功扩增出了SSR特征条带,其它未获得扩增产物的引物可能的原因是正向引物或反向引物或二者都恰好跨过了mRNA的剪切位点,也可能是由于在相应的基因组DNA中存在较大的内含子,这两个原因都会导致引物无法与模板DNA结合而不能扩增,从而导致扩增效率较低。基于遗传相似系数的聚类分析表明,国内和国外品种间遗传差异度较大,可能是其亲本来源不同所致。本研究中,三核苷酸重复数量高于二核苷酸重复,此结果与EST中三核苷酸比二核苷酸更为丰富的结论相符[32]。
综上,EST-SSR标记易于开发、成本较低,其功能可以通过序列同源性比对获得。而且由于来自于转录谱,能够反映出转录区的差异,使得EST-SSR标记在遗传多样性分析、比较作图和分子标记辅助选择育种的研究中具有更高的应用价值。
[1]Peleman J D,van der Voort J R.Breeding by design[J].Trends Plant Sci.,2003,8(7):330-334.
[2]张福顺.叶用甜菜种质资源遗传多样性及亲缘关系的研究[D].哈尔滨:中国农业科学院甜菜研究所,1999.
[3]UphoffH,WrickeG.Ageneticmapofsugarbeet(BetaVulgarisL.) basedonRAPDmarkers[J].PlantBreeding,1995,114(4):355-357.
[4]路运才.甜菜多倍体品种和亲本的生物学特性及其系统发育关系的研究[D].哈尔滨:中国农业科学院甜菜研究所,2001.
[5]Askar,N.A.,Reza,A.,Ali,H.N.,Jalal,S.,Mahmood,M.Use of Molecular Marker for Assay Gene Dosage Resistant Gene to Rhizomania Disease (Rz1) in Sugar beet(Beta vulgaris L.) [J].Asian J.of Biotech., 2009,1(1):7-41.
[6]Amiri R.,Mesbah M.,Moghaddam M.,Bihamta M.R.,Mohammadi S.A.and Norouzi P.A new RAPD marker for beet necrotic yellow vein virus resistance gene in Beta vulgaris[J].Biologia Plantarum,2009,53(1):112-119.
[7]Grimmer M.K.,Trybush S.,Hanley S.,Francis S.A.,Karp A.and Asher M.J.C.An anchored linkage map for sugar beet based on AFLP,SNP and RAPD markers and QTL mapping of a new source of resistance to Beet necrotic yellow vein virus[J].Theoretical and Applied Genetics.,2007,114(7):1151-1160.
[8]Annika Hjerdin Panagopoulos.Application of Molecular Markers in Sugar Beet Breeding[D].Lund:Lund University,2003.
[9]Schneider K,Sch?fer-Pregl R,Borchardt C and Salamini F.Mapping QTLs for sucrose content,yield and quality in a sugar beet population fingerprinted by EST-related markers[J].Theor.Appl.Genet.,2002,104(6-7):1107-1113.
[10]赵尚敏,白晨,张惠忠,等.适于甜菜遗传多样性分析的SSR引物筛选[J].中国糖料,2009(4):6-8.
[11]王华忠,吴则东,王晓武,等.利用SRAP与SSR标记分析不同类型甜菜的遗传多样性[J].作物学报,2008,34(1):37-46.
[12]付增娟,史树德,张少英,等.甜菜ISSR-PCR反应体系的优化[J].中国糖料,2008(4):7-9.
[13]Powell W,Machray G C,Provan J.Polymorphism revealed by simple sequence repeats[J].Trends Plant Sci.,1996,1(7):215-222.
[14]TóthG,GáspáriZ,JurkaJ.Microsatellitesindifferenteukaryoticgenomes:surveyandanalysis[J].GenomeResearch,2000,10(7):967-981.
[15]Tautz D,Renz M.Simple sequences are ubiquitous repetitive components of eukaryotic genomes[J].Nucleic Acids Research,1984,12(10):4127-4138.
[16]朱振东,贾继增.小麦 SSR 标记的发展及应用[J].遗传,2003,25(3):355-360.
[17]Blair M W,Giraldo M C,Buendía H F,et al.Microsatellite marker diversity in common bean (Phaseolus vulgaris L)[J].Theor.Appl.Genet.,2006,113(1):100-109.
[18]Rongwen J,Akkaya M S,Bhagwat A A,et al.The use of microsatellite DNA markers for soybean genotype identification[J].Theor.Appl.Genet.,1995,90(1):43-48.
[19]张亚平,王文,宿兵,等.大熊猫微卫星DNA的筛选及其应用[J].动物学研究,1995,16(4):301-306.
[20]Rassmann K,Sehlotterer C,Tautz D.Isolation of simple sequence loci for use in Polymerase chain Reaction-based DNA finger printing[J].Electrophoresis,1991,12(2-3):113-118.
[21]Karagyozov L,Kalcheva I D,Chapman V M.Construction of random small-insert genomic libraries highly enriched for simple sequence repeats[J].Nucleic Acids Research,1993,21(16):3911-3912.
[22]Lian C L,Zhou Z H,Hogetsu T.A simple method for developing microsatellite markers using amplified fragments of intersimple sequence repeat[J].Journal of Plant Research,2001,114(3):381-385.
[23]Taliercio E,Allen R D,Essenberg M,et al.Analysis of ESTs from multiple Gossypium hirsutum tissues and identification of SSRs[J].Genome,2006,49(4):306-319.
[24]Scott K D,Eggler P,Seaton G,et al.Analysis of SSRs derived from grapes EST[J].Theor.Appl.Genet.,2000,100(5):723-726.
[25]Eujayl I,Sorrells M E,Wolters P,et al.Isolation of EST-derived microsatellite markers for genotyping the A and B genomes of wheat[J].Theor.Appl.Genet.,2002,104(2-3):399-407.
[26]Rungis D,Berube Y,Zhang J,et al.Robust simple sequences repeat markers for spruce (Picea spp.) from expressed sequence tags[J].Theor.Appl.Genet.,2004,109:1283-1294.
[27]魏利斌,张海洋,郑永战,等.芝麻EST-SSR标记的开发和初步研究[J].作物学报,2008,34(12):2077-2084.
[28]Doyle J J,Doyle J L.A rapid DNA isolation procedure for small quantities of fresh leaf tissue.Phytochemical Bulletin,1987,19:11-15.
[29]Park Y H,Alabady M S,Ulloa M,et al.Genetic mapping of new cotton fiber loci using EST-derived microsatellites in an interspecific recombinant inbred (RIL) cotton population[J].Mol Genet Genom,2005,274(4):428-441.
[30]Rohlf F J.NTSYS-pc:Numerical Taxonomy and Multivariate Analysis System,Version 2.1,User Guide[CP].Exeter Software,New York,2000.
[31]Ayers,N.M,McClung,A.M,Larkin,P.D,et al.Microsatellites and a single nucleotide polymorphism differentiate apparent amylose classes in an extended pedigree of US rice germplasm[J].Theor.Appl.Genet.,1997,94:773-781.
[32]Bao J S,Corke H,Sun M.Microsatellites in starch synthesizing genes in relation to starch Physiochemical Properties in waxy rice(Oryza sativa L.).Theor.Appl.Genet.,2002,105(6-7):898-905.
[33]Thiel T,Michalek W,Varshney R K,et al.Exploiting EST databases for the development and characterization of gene-derived SSR-markers in barley (Hordeum vulgare L.) [J].Theor.Appl.Genet.,2003,106:411-422.
[34]Christopher M.R,Mary B,Sharon e.M,et al.Polymorphic microsatellite markers for inferring diversity in wild and domesticated sugar beet(Beta vulgaris L.) [J].Molecular Ecology Notes,2004,4:243-245.
[35]Eujayl l,Sorrells M E,Baum M,wolters et al.Assessment of genotypic variation among cultivated durum wheat based on ESTSSRs and genomic SSRs[J].EuPhytica,2001,119(1):39-43
[36]张艳欣,林忠旭,李武,等.海岛棉EST-SSR引物的开发与应用研究 [J].2007,52(15):1779-1787.
[37]Zhang L Y,Bemard M,Uroy P,Feuillet C.High transferability of bread wheat EST-derived SSRs to other cereals[J].Theor.Appl.Genet.,2005,111:677-687.

