分子标记在甜菜离子注入诱变育种中的初步应用
高文伟 ,马 林,沙 红,曲延英,于月华,刘 珊 ,李玉娇,王燕飞
(1.新疆农业大学农学院/新疆农业大学生物技术重点实验室,乌鲁木齐 830052;2.新疆农业科学院经济作物研究所,乌鲁木齐 830091)
分子标记辅助育种是利用与目标性状紧密连锁的DNA来对目标性状进行间接性选择,早代就能够对目标基因的转移进行准确、稳定的选择,而且克服隐性基因再度利用识别的困难,从而加速育种进程,提高育种效率,选育抗病、优质、高产的品种[1-13]。我国的农作物分子标记辅助育种的研究始于90年代初,在过去的近十年时间里,取得了重要的研究进展:(1)构建了水稻等作物的染色体遗传图谱;(2)构建了水稻染色体物理图谱;(3)利用分子标记对我国作物种质资源遗传多样性进行了初步研究;(4)对一些重要的农艺性状进行了定位、作图与标记,相应的基因克隆已在进行[8]。就甜菜而言,在国外RFLP、RAPD、SSR和AFLP分子标记已先后用于遗传图谱构建、遗传多样性检测、品种(系)鉴别及重要农艺性状的分子标记等方面的研究。然而开展甜菜高糖性、早熟性分子标记在国内还未发现有相关报道,尤其是本次利用离子注入诱变产生的高糖、早熟突变体做亲本进行分子标记研究尚属首次。
本实验以离子注入诱变获得的高糖突变体、早熟突变体和未经诱变处理的对照为材料,构建RAPD分子标记相关指纹图谱,为定位高糖、早熟性状相关的基因或QTL和利用甜菜的高糖性、早熟性指导育种实践,加快育种进程奠定基础。
1 材料与方法
1.1 材料
甜菜优良亲本材料7208、离子注入诱变高糖体S10、早熟体W11。
1.2 方法
1.2.1 改良的SDS法 取甜菜叶片0.2g,同时把SDS提取液在65℃下预热,然后进行甜菜叶片的研磨。在研样中加500μL SDS提取液,之后装入离心管中并在65℃水浴锅下加热30min,在加热过程中,轻摇2~3次。取出,冷却后加氯仿异戊醇500μL轻摇至匀,离心(12000r/min,15min)。取上清液,加氯仿异戊醇离心(8000r/min,10 min)。再取上清液,用无水乙醇沉淀静置、离心(8000r/min,6min)。最后用70%乙醇洗2次,晾干,超纯无菌水溶解放置(4℃)冰箱中备用。
1.2.2 PCR反应 ⑴RAPD反应体系中的试剂及用量:Buffer 2.5μL,10M dNTPs 0.5μL,超纯无菌水 14.1μL,Taq 酶 0.4μL,Mg2+2.5μL, 模板 DNA 4μL, 引物 1μL。 ⑵PCR 扩增条件:95℃预变性 5min,94℃变性 1min,37℃复性 1min,72℃延伸 2min循环 44次,72℃再延伸 5min,4℃保存。
1.2.3 电泳及染色 采用琼脂糖凝胶电泳,电压100V,时间25 min。最后在Bio-Rad自动凝胶成像仪上观察PCR结果。
1.2.4 带型分析 以0、1为标记,建立EXCEL分子标记数据库,0代表无条带,1代表有条带。
2 结果与分析
大量田间试验表明:通过离子注入后所获得的早熟性状和含糖率高的性状是稳定遗传的。因此本研究对其进行分子检测,以期获得与这些性状紧密连锁的标记,并利用分子标记来进行辅助选择育种或研究种质资源。
2.1 DNA的琼脂糖电泳检测
在已有工作基础上总结出一种简单,成本低廉,提取DNA效果又好的SDS方法。采用此方法提取效率较高,主带明亮,整齐一致,降解现象不明显。
2.2 RAPD体系的建立
甜菜优良亲本7208、离子注入高糖突变体S10和早熟突变体W11为材料,以离子注入诱变早熟体的RAPD分子标记筛选为技术基础[8],根据其他作物的标记体系进行整合后,建立了适于甜菜的RAPD分子标记体系。

图1 DNA检测

图2 RAPD检测
此图证实了用改良的SDS法提取DNA可以应用到RAPD-PCR的扩增体系。在C1、T20、AE20、U15、C2、C11引物下离子注入诱变体与非离子注入诱变体的DNA条带有差异,同时两个离子注入诱变体S10、W11之间也存在差异。
2.2.1 多态性引物的确定 以 7208、S10、W11为材料,采用实验室建立起来的RAPD分子标记技术体系,从800条RAPD引物中筛选出扩增带型有差异且带型清晰稳定的引物。

表1 鉴定材料间差异的DNA多态性引物
从表1中看出有18个引物可以鉴别S10、7208之间的差异,也有18个引物可以鉴别W11、7208之间的差异。它们之间的引物并不是完全不同,V3、W5、C2、U15、AE20是它们共有的,占总引物的0.625%。有5个引物可以鉴别S10、W11之间的差异,占总引物的0.625%。由此可以证明虽然离子注入产生了高糖和早熟两个变异体,但是它们之间的差异比较小,这主要是因为它们大部分遗传物质和亲本7208相似。
2.2.2 带型统计分析 以0、1为标记,建立EXCEL分子标记数据库,0代表无条带,1代表有条带。
通过 7208、S10、W11的 RAPD 引物的筛选和特异性引物对应的DNA指纹(见表2、3、4)统计,可以建立相应的RAPD分子标记指纹图谱库,同时也可以看出:用一个引物很难确定是哪种变异,因此确定某一种变异应用多个引物的组合或指纹组合。
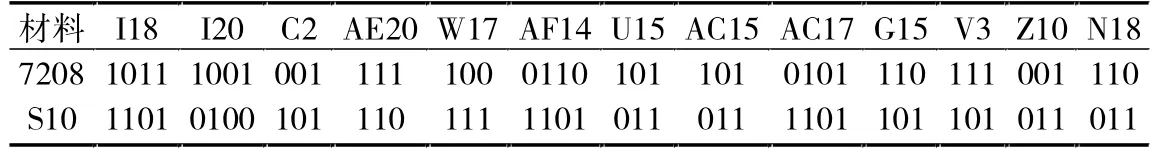
表2 引物所对应的S10、7208的DNA指纹

表3 引物所对应的W11、7208的DNA指纹
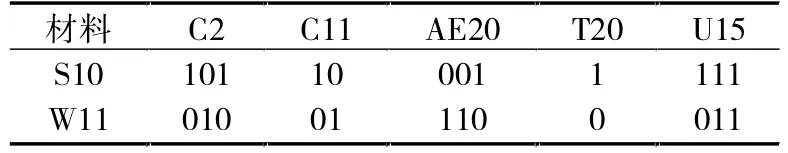
表4 引物所对应的S10、W11的DNA指纹
3 讨论
甜菜是两年生作物,通过常规杂交转育产生新的基因源,一则周期太长,二则在没有基因来源的情况下,很难获得新的创新材料。在甜菜理化诱变中,曾先后应用航天、钴60等诱变方法,但效果均不明显。离子注入技术具有定向性、多样性及安全性,有较高的突变谱。新疆在甜菜上利用离子注入技术获得了创新早熟亲本材料一份W11,含糖率增加的高糖亲本一份S10,而且此种变异可以稳定遗传[8]。
随机引物多态性DNA片断可作为分子标记。这种方法即为RAPD。尽管RAPD技术诞生的时间很短,但由于其独特的检测DNA多态性的方式具有快速、简便的特点,使这个技术已渗透于基因组研究的各个方面。该RAPD技术建立于PCR技术基础上,它是利用一系列不同的随机排列碱基顺序的寡聚核苷酸单链为引物,对所研究基因组DNA进行PCR扩增[13]。聚丙烯酰胺或琼脂糖电泳分离,经EB染色或放射性自显影来检测扩增产物DNA片断的多态性,这些扩增产物DNA片断的多态性反映了基因组相应区域的DNA多态性。RAPD所用的一系列引物DNA序列各不相同,但对于任一特异的引物,它同基因组DNA序列有其特异的结合位点。这些特异的结合位点在基因组某些区域内的分布如符合PCR扩增反应的条件,即引物在模板的两条链上有互补位置,且引物3’端相距在一定的长度范围内,就可以扩增出DNA片断。因此如果基因组在这些区域发生DNA片断插入、缺失或碱基突变就可能导致这些特定结合位点分布发生相应的变化,而使PCR产物增加、缺少或发生分子量的改变。通过对PCR产物检测即可检出基因组DNA的多态性。分析时可用的引物数量很大,虽然对每一个引物而言其检测基因组DNA多态性的区域是有限的,但是利用一系列引物则可以使检测区域几乎覆盖整个基因组。因此RAPD可以对整个基因组DNA进行多态性检测。另外,RAPD片断克隆后可作为RFLP的分子标记进行作图分析。
由本实验可知:利用RAPD检测可以区分7208、W11、S10三者的差异并且通过分析也验证了突变的低频性。利用RAPD检测可以区分7208、W11、S10三者的差异,正好和大田上三者之间存在有差异的结果是一致的,表明三者之间可能存在遗传物质上的差异。同时RAPD检测可以较早地对甜菜的种子进行室内检测,从而更早地对诱变体进行选择。但是用RAPD进行分子标记,存在重复性差等局限性,因此为了弥补RAPD和大田检测的局限性,还需要转换一种SCAR的特异性的分子标记技术来,更加准确地鉴定出离子注入诱变产生的变异。
4 结论
本文通过RAPD分析得到了7208、W11、S10之间有差异的引物;通过带型分析建立了7208、W11和S10的指纹图谱库。由实验可知:利用RAPD分子标记技术检测了甜菜突变体,检测差异的大小和大田检测进行比对,发现检测结果是基本一致的,从而也证明了RAPD分子标记技术是可以用于检测生物的突变体的,因此用RAPD分子标记对7208、W11、S10之间的差异进行监测,在早代进行选择,可以指导大田育种。再通过大田育种的结果来验证分子育种的可行性,以确认标记的准确性。
[1]刘勋甲,郑用琏,石勇刚,等.玉米RAPD研究影响因素的探讨[J].华中农业大学学报,1996,15(5):405-409.
[2]Staub JE,Serquen FC.Genetic markers,map constrution,and their applicationg in plant breeding.HortScience,1996,31(5):729-741.
[3]廖江雄.复杂多倍体植物甘蔗分子标记的研究现状及展望[J].甘蔗,1998,5(2):10-15.
[4]史永忠,郭文武,邓学新.柑橘RAPD技术体系建立与体系胞杂种鉴定[J].园艺学报,1998,25(2):105-110.
[5]李富生,何丽莲,杨清辉,等.蔗茅的特异性状及其与甘蔗杂交F1代的染色体和RAPD鉴定研究[J].分子植物育种,2003,1(5):775-781.
[6]曾华宗,郑成木,朱稳,等.甘蔗种质间亲缘关系及特异性标记的RAPD分析[J].植物遗传资源学报,2003,4(2):99-103.
[7]肖关丽,李富生,杨清辉,等.RAPD分子标记在甘蔗杂种鉴定中的应用研究[J].西南农大学学报,2003,25(3):207-209.
[8]王燕飞,陈丽君,刘华君,等.我国甜菜诱变育种方法研究进展[J].中国糖料,2008(4):66-68.
[9]许莉萍,陈如凯.与甘蔗抗黑穗病基因连锁的RAPD标记筛选[J].应用与环境生物学报,2004,10(3):263-267.
[10]陈平华,张辉,陈如凯.利用RAPD技术进行甘蔗育种亲本辅助选择[J].分子植物育种,2004,2(5):675-681.
[11]曲延英,王燕飞,高文伟,等.甜菜离子注入诱变早熟突变体的RAPD分子标记筛选[J].新疆农业科学,2005,42(4):287-289.
[12]张玉,李伟,魏育明,等.小麦抗赤霉病地方品种的RAPD分析[J].西南农业学报,2005,18(3):240-243.
[13]苗玉新,刘丽艳,包春莲.PCR和RAPD技术在农业研究中的应用[J].农业系统科学与综合研究,2005,21(3):84-89.

