肝X受体抑制乳鼠心肌细胞缺氧/复氧损伤*
殷 然, 王梦洪, 郑泽琪, 彭锦添, 夏 莺
(1南昌大学第一附属医院心内科,江西省高血压病研究所,2江西省人民医院干部病房,江西 南昌 330006)
肝 X受体(liver X receptors,LXPs)包括 LXRα和LXRβ,属于核受体超家族。结合了配体的LXRs构象发生变化,使得辅阻遏复合物与辅激活因子之间发生交换,目的基因被转录。近年来的研究证实,LXRs在脂代谢、糖代谢、炎症、凋亡信号中起着关键的调节作用[1-6],并且有研究显示LXRs对某些脏器如脑、肠等的缺血/再灌注损伤起保护作用[7,8]。我们的前期研究证实,在正常小鼠心肌组织中有LXRs的低水平表达;LXRs同样对心肌细胞应激,例如:由血管紧张素II(angiotensin II,Ang II)及脂多糖(lipopolysaccharide,LPS)诱导的心肌细胞肥大性生长起抑制作用[9,10]。鉴于心肌缺血/再灌注损伤与其它脏器缺血/再灌注损伤病理生理机制的相似性,并结合我们前期的工作基础,我们设想:LXRs通过抑制心肌细胞炎症反应,从而对缺血/再灌注心肌起保护作用,是机体抗心肌缺血/再灌注损伤的重要防御因子。本研究以体外培养的乳鼠心肌细胞为研究对象,复制心肌细胞缺氧/复氧(anoxia/reoxygenation,A/R)模型,观察外源性激活LXRs对心肌细胞A/R损伤的影响,探讨其抗心肌缺血/再灌注损伤的机制及相应的细胞信号通路。
材料和方法
1 材料
原代心肌细胞分离试剂盒购自Worthington。大鼠胚胎心肌细胞株H9c2为本实验室贮存。DEME/F12培养基、标准胎牛血清购自HyClone。LXRs特异性激动剂T0901317购自Sigma。总RNA提取及逆转录试剂盒购自Applied Biosystems。Real-time PCR仪及绿色荧光SYBP试剂盒购自Roche。PCR引物由Invitrogen合成。乳酸脱氢酶(lactate dehydrogenase,LDH)及肌酸激酶(creatine kinase,CK)活性试剂盒购自南京建成生物工程研究所。荧光素酶报告基因检测试剂盒及 pNF-κB-Luc购自Stratagene。Effectene转染试剂盒购自Qiagen。
2 方法
2.1 乳鼠心肌细胞分离、培养及A/R模型建立选用出生后1-2 d的SD大鼠,参照文献[8]的方法分离心肌细胞,接种、培养于24孔培养板中。A/R模型的建立:用氩气饱和后更换使用无糖无血清培养基,再灌入高纯度氩气封口,在培养箱中孵育2 h,再拆开封口在培养箱中孵育24 h。
2.2 实验分组 乳鼠心肌细胞分离成功后,随机分为 5组:正常对照组(control)、A/R组、A/R+T0901317(1 μmol/L)、A/R+T0901317(5μmol/L)组和 A/R+T0901317(10 μmol/L)组。Control组:不进行A/R处理,正常情况下连续培养26 h;A/R组:在高纯度氩气,无糖无血清培养基条件下培养2 h,复氧开始时加入生理盐水,再复氧培养24 h;A/R+T0901317(1 μmol/L)组、A/R+T0901317(5 μmol/L)组和 A/R+T0901317(10 μmol/L)组:预先给予终浓度为1、5、10μmol/L T0901317 孵育60 min,再在无血清低糖DMEM培养基缺氧孵育2 h,然后继续复氧培养24 h,检测各组在复氧24 h后的LDH、CK活性及肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白细胞介素 -6(interleukin-6,IL-6)、单核细胞趋化因子-1(monocyte chemoattractant protein-1,MCP-1)mRNA的水平。在荧光素酶报告基因检测核因子 -κB(nuclear factor-κB,NF-κB)转录活性实验中,H9c2细胞随机分为3组:ad-LacZ组、ad-VP16-LXRα组和ad-VP16-LXRβ组。3组均参照文献[8]转染 pNF-κB-Luc 24 h后,换为无血清培养基继续培养12 h,分别转染 Ad-LacZ、Ad-VP16-LXRα、Ad-VP16-LXRβ,12 h后进行 A/R或对照实验。
2.3 LDH、CK活性测定 取复氧24 h心肌细胞,常规消化。调整细胞密度为3×109cells/L,加入预冷的RIPA细胞裂解液,重新悬浮细胞。冰浴15 min,4℃、13000×g离心30 min,取上清,采用常规比色法,按试剂盒说明书测定LDH、CK的活性。
2.4 Real-time PCR Trizol法提取总 RNA,在逆转录酶MML-V的作用下,将mRNA逆转录成cDNA分子。应用SYBR Green荧光染料技术行实时定量PCR反应。PCR引物如下:TNF-α上游引物5'-TGAACTTCGGGGTGATCGGTC-3',下游引物 5'-AGCCTTGTCCCTTGAAGAGGAAC-3';IL-6上游引物5'-CACGAAGGCTGTGCTGTTT-3',下游引物 5'-ACTTGCTTCCCACACTGTTTG-3';MCP-1上游引物 5'-TTAACGCCCCACTCACCTGCTG -3',下游引物 5'-CAATGTAGGCCGAGAGTGCTG-3';βactin上游引物 5'-AGATTACTGCTCTGGCTCCTA-3',下游引物 5'-CAAAGAAAGGGTGTAAAACG-3'。反应条件:94 ℃ 3 min,94 ℃ 30 s,53 ℃ 30 s,72℃ 30 s,50个循环。
2.5 转染及荧光素酶报告基因检测 H9c2细胞接种于24孔板,在完全培养基(DMEM/F12)中培养至汇合度为60%。用Effectene转染试剂盒中的缓冲液EC 溶解 0.4 μg pNF - κB - Luc,终体积 100 μL,加入3.2 μL试剂盒中的 Enhancer,轻轻混匀;15-25℃放置2-5 min,加入10 μL Effectene转染试剂,轻轻混匀,15-25℃放置5-10 min;用PBS清洗细胞,加入1.6 mL培养液;向转染混合物中加入0.6 mL培养液,混匀,迅速加入细胞中,37℃、5%CO2孵育箱孵育24 h。参照说明书,采用荧光素酶报告基因法测定NF-κB活性。
3 统计学处理
数据采用SPSS 12.0进行统计分析。计数资料以均数±标准差()表示,采用随机区组设计的单因素方差分析(ANOVA),组间多重比较采用最小显著差异法,检验显著性水平定于α=0.05。
结 果
1 LXRs激动剂T0901317对心肌细胞A/R损伤的保护作用
各实验组在缺氧后心肌细胞受到损伤,复氧24 h后,上清液中LDH和CK均较对照组明显增高(P<0.05),而经T0901317预处理后显著减轻A/R损伤,表现 为 A/R+T0901317(5 μmol/L)组、A/R+T0901317(10 μmol/L)组的LDH和CK较单纯A/R组显著降低(P<0.05),见图 1。以上结果显示,T0901317对LXRs的激活明显减轻A/R造成的心肌细胞损伤。

Figure1.The protective effect of LXRs agonist T0901317 on A/R injury in cultured neonatal rat cardiomyocytes..n=6.*P <0.05 vs control;#P <0.05 vs A/R.图1 LXRs激动剂T0901317对乳鼠心肌细胞A/R损伤的保护作用
2 LXRs激动剂T0901317对心肌细胞A/R损伤炎症因子表达的影响
TNF-α、IL-6和MCP-1 mRNA均较对照组显著升高(P<0.05)。经T0901317预处理的A/R+T0901317(5 μmol/L)组、A/R+T0901317(10 μmol/L)组炎症因子表达水平较单纯A/R组显著降低(P<0.05),见图2。这说明A/R可以引起心肌细胞炎症因子的大量释放,而通过T0901317激活LXRs则可起到抑制由A/R介导的TNF-α、IL-6和MCP-1 mRNA水平增高。
3 腺病毒介导的LXRs过表达对心肌细胞A/R损伤NF-κB活性的影响
各实验组NF-κB活性水平均较对照组显著升高(P<0.05)。经Ad-VP16-LXRα感染的Ad-VP16-LXRα组NF-κB活性水平较Ad-LacZ感染的Ad-LacZ组显著降低(P<0.05);而经 Ad-VP16-LXRβ感染的Ad-VP16-LXRβ组NF-κB活性水平与Ad-LacZ感染的Ad-LacZ组无显著差别(P>0.05),见图3。这说明A/R可以引起NF-κB活性水平增高,而LXRα过表达则抑制由A/R介导的NF-κB活性水平增高。
讨 论
心肌梗死严重危害人类健康,是影响生存率和死亡率的主要原因之一。目前针对心肌梗死的主要治疗手段,包括溶栓、腔内介入治疗、冠状动脉搭桥手术等,均是对缺血心肌实施再灌注,而在心肌缺血后实行再灌注的过程中,在挽救存活细胞的同时,也会带来细胞的损伤,表现为电活动异常、心肌收缩性能降低、心肌细胞线粒体肿胀等,使再灌注心肌功能急剧降低,部分可逆性心肌损伤转变为不可逆性损伤。心肌缺血/再灌注损伤是阻碍缺血心肌从再灌注疗法中获得最佳疗效的主要难题。炎症反应、凋亡是心肌缺血/再灌注损伤发病机制中的重要环节,抑制炎症反应及凋亡,已成为治疗心肌缺血/再灌注损伤研究的热点[11]。
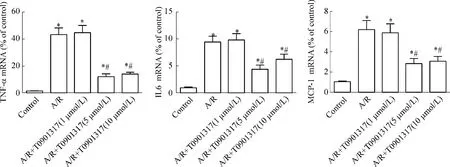
Figure2.The effect of LXRs agonist T0901317 on proinflammatory factor expression induced by A/R in cultured neonatal rat cardiomyocytes..n=6.*P<0.05 vs control;#P<0.05 vs A/R.图2 LXRs激动剂T0901317对乳鼠心肌细胞A/R诱导的炎症因子的作用
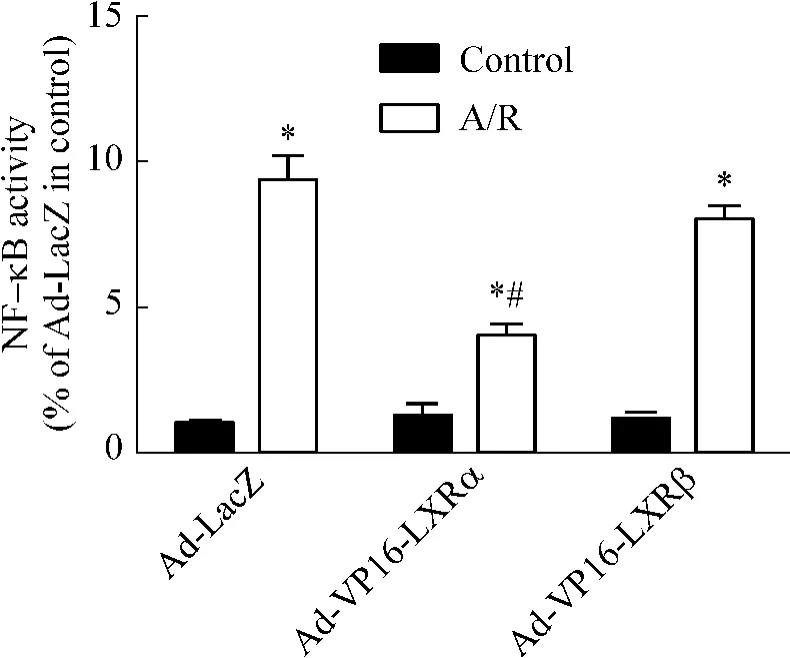
Figure3.The effect of adenoviral vectors containing constitutively-active forms of LXRα and LXRβ on NF-κB activity induced by A/R injury in cultured neonatal rat cardiomyocytes..n=6.*P<0.05 vs control;#P<0.05 vs Ad-LacZ in A/R.图3 腺病毒介导的LXRs过表达对乳鼠心肌细胞A/R损伤NF-κB活性的影响
最初在巨噬细胞中的研究表明LXRs调控了一系列参与胆固醇逆向转运的基因,主要是调控膜转运体三磷酸腺苷结合子超家族成员的表达[1]。此外,LXRs还能抑制细菌、LPS、TNF-α和IL-1β刺激所产生的炎症因子,这些炎症因子包括:诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、环氧合酶2(cyclooxygenase 2,COX-2)、IL-6和IL-1β、MCP-1、MCP-3和人基质金属蛋白酶 -9(matrix metalloproteinase - 9,MMP - 9)[2-4]。在得到功能和失去功能研究中都发现,激活LXRs途径具有抗动脉粥样硬化作用。LXRs抗动脉粥样硬化与其调控炎症、凋亡反应、脂代谢有关[5]。此前,我们的研究首次证实,在正常小鼠心肌组织中有LXRs的表达,LXRα基因缺失的C57/B6小鼠在主动脉缩窄术后左室肥厚较对照组明显加重;肥厚刺激明显增加心肌LXRs含量,LXRs激动剂-T0901317通过抑制NF-κB而减轻由Ang II及LPS诱导的心肌细胞肥大性生长。此外我们构建了心肌特异性表达LXRα及 LXRβ的腺病毒载体:Ad-VP16-LXRα和Ad-VP16-LXRβ,并发现心肌细胞过表达LXRα及LXRβ能抑制由Ang II及LPS诱导的NF-κB活化,从而证实LXRs在心肌细胞炎症反应中发挥重要作用[9,10]。
虽然LXRs对心肌缺血/再灌注损伤有何影响及相应的作用靶点尚未见报道,但有研究者已经注意到LXRs在其它脏器缺血/再灌注损伤中的作用。一项研究显示,LXRs激动剂GW3695可减轻大鼠脑缺血/再灌注损伤,这一效应与LXRs抑制神经细胞NF-κB活性、降低其靶基因COX-2表达有关[7]。另一项小鼠内脏动脉阻断性休克的研究发现,LXRs激动剂T0901317通过抑制MAPKs、NF-κB信号通路,调控凋亡相关基因fas、bax、bcl-2的表达,从而减轻内脏器官的再灌注损伤[8]。本研究发现,LXRs激动剂T0901317抑制由A/R损伤造成的乳鼠心肌细胞炎症因子TNF-α、IL-6和MCP-1 mRNA表达,从而减轻乳鼠心肌细胞A/R损伤。进一步应用腺病毒介导LXRα/LXRβ在心肌细胞中过表达的实验表明,LXRs对心肌细胞A/R损伤起保护作用,这一保护作用与LXRs,尤其是LXRα抑制NF-κB转录活性有关。核转录因子NF-κB是参与调节缺血再灌注心肌细胞炎症反应与凋亡的重要环节,转录产生的细胞因子和黏附分子如TNF-α、IL-6、MCP-1、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、IL-8、选择素等,直接或间接通过活性氧增加引起血管内皮细胞和心肌细胞的损伤[12]。缺血预处理及NF-κB特异性抑制剂PDTC可能通过抑制NF-κB激活,减少炎症介质的表达,抑制中性粒细胞的激活,减少心肌细胞的凋亡,进而减轻心肌缺血再灌注损伤[13];NF-κB亚基p50的靶向断裂能减轻心肌梗死后的心室破裂,改善心脏功能和生存时间[14]。本研究在体外培养的乳鼠心肌细胞中复制A/R模型,观察到外源性激活LXRs通过抑制NF-κB活化、减轻心肌细胞炎症反应而改善心肌细胞A/R造成的损伤,证实了LXRs是机体抗心肌缺血/再灌注损伤的重要防御因子。我们下一步计划进行在体动物实验,进一步验证此假设,以期为遏制心肌缺血/再灌注损伤的发生发展和寻找新的治疗方法提供一个新的方向。
[1]Tontonoz P,Mangelsdorf DJ.Liver X receptor signaling pathways in cardiovascular disease[J].Mol Endocrinol,2003,17(6):985-993.
[2]Tangirala RK,Bischoff ED,Joseph SB,et al.Identification of macrophage liver X receptors as inhibitors of atherosclerosis[J].Proc Natl Acad Sci U S A,2002,99(18):11896-11901.
[3]Morello F,Saglio E,Noghero A,et al.LXR -activating oxysterols induce the expression of inflammatory markers in endothelial cells through LXR-independent mechanisms[J].Atherosclerosis,2009,207(1):38 -44.
[4]Fntaine C,Rigamonti E,Pourcet B,et al.The nuclear receptor Rev-erbalpha is a liver X receptor(LXR)target gene driving a negative feedback loop on select LXR-induced pathways in human macrophages[J].Mol Endocrinol,2008,22(8):1797 -1811.
[5]Buono C,Li Y,Waldo SW,et al.Liver X receptors inhibit human monocyte-derived macrophage foam cell formation by inhibiting fluid - phase pinocytosis of LDL[J].J Lipid Res,2007,48(11):2411-2418.
[6]殷 然,董吁钢,李红良,等.AMPK通过增强心肌脂肪酸氧化抑制大鼠心肌肥厚[J].中国病理生理杂志,2007,23(7):1258 - 1262.
[7]Morales JR,Ballesteros I,Deniz JM,et al.Activation of liver X receptors promotes neuroprotection and reduces brain inflammation in experimental stroke[J].Circulation,2008,118(14):1450-1459.
[8]Crisafulli C,Di Paola R,Mazzon E,et al.Liver X receptor agonist treatment reduced splanchnic ischemia and reperfusion injury[J].J Leukoc Biol,2009,87(2):309-321.
[9]Wu S,Yin R,Ernest R,et al.Liver X receptors are negative regulators of cardiac hypertrophy via suppressing NF-κB signalling[J].Cardiovasc Res,2009,84(1):119 -126.
[10]殷 然,李玉泉,王梦洪,等.肝脏X受体调控小鼠心肌细胞肥大性生长[J].中华心血管病杂志,2009,37(12):1119-1123.
[11]Baines CP.The mitochondrial permeability transition pore and ischemia - reperfusion injury[J].Basic Res Cardiol,2009,104(2):181-188.
[12]Gu Q,Yang XP,Bonde P,et al.Inhibition of TNF-alpha reduces myocardial injury and proinflammatory pathways following ischemia - reperfusion in the dog[J].Cardiovasc Pharmacol,2006,48(6):320 -328.
[13]Fischer UM,Radhakrishnan RS,Uray KS,et al.Myocardial function after gut ischemia/reperfusion:does NF κB play a role?[J].J Surg Res,2009,152(2):264 -270.
[14]Gutierrez SH,Kuri MR,del Castillo ER.Cardiac role of the transcription factor NF - κB[J].Cardiovasc Hematol Disord Drug Targets,2008,8(2):153-160.

