小胶质细胞体外吞噬模型的建立及相关炎症因子的研究*
聂 盼, 刘 勇, 杨学森, 肖明春, 刘 堰△
(1西南大学生命科学学院,重庆 400715;第三军医大学2西南医院眼科,3军事预防医学院劳动卫生学教研室,重庆 400038)
小胶质细胞作为脑内常驻的免疫细胞,主要参与中枢神经系统的免疫和炎症反应。当脑内微环境发生变化(如脑损伤或免疫刺激)时,小胶质细胞可迅速应激成为具有变形和吞噬能力的激活状态。活化的小胶质细胞能在不同环境下分泌神经营养因子或神经毒性因子,这些神经因子在脑缺血、帕金森氏病、阿尔茨海默病等多种神经系统病变中发挥着损伤和修复的双重作用[1]。要对小胶质细胞的吞噬功能和炎症作用进行系统的研究,首先需要一个小胶质细胞体外吞噬体系。目前尚无有效、可靠的小胶质细胞体外吞噬体系,且没有对小胶质细胞吞噬功能与炎症作用之间相关性的研究报道。Fuller等[2]建立了小胶质细胞吞噬凋亡神经元的体外吞噬体系,但其吞噬率却非常低。在巨噬细胞吞噬体系中发现,通过脂质体将氧化磷脂酰丝氨酸(phosphatidylserine,PS)整合到细胞膜上可明显促进巨噬细胞对PS外翻细胞的吞噬[3]。本文借鉴巨噬细胞中PS介导的吞噬途径,制备氧化PS脂质体整合到红细胞膜上,建立红细胞PS外翻的凋亡模型,并由此建立小胶质细胞对凋亡红细胞的吞噬模型,观察小胶质细胞对整合氧化PS脂质体红细胞的吞噬率,检测吞噬后小胶质细胞中炎症因子白细胞介素-1β(interleukin-1β,IL -1β)和肿瘤坏死因子 α(tumor necrosis factorα,TNF -α)mRNA表达变化,为进一步研究小胶质细胞活化及吞噬机制,并利用小胶质细胞来治疗神经系统性疾病奠定基础。
材料和方法
1 材料
1.1 材料 小胶质细胞株N9为本实验室所保存;健康人外周静脉血取自于自愿供血者,EDTA抗凝,于4℃可保存2周。
1.2 试剂 PS[1-palmitoyl(C16:0)-2-arachidonyl(C20:4)-3-phosphatidylserine]购自 Avanti-Polar Lipids。Trizol购自Invitrogen。N-乙基马来酰胺(N-ethylmaleimide,NEM)和PKH26 Red Fluorescent Cell Linker Kit均购自Sigma。Annexin V凋亡检测试剂盒购自Biovision。反转录试剂盒购自 TaKaRa。SYBR Green real-time PCR Master Mix-Plus试剂盒购自Toyobo。实验所用引物均由上海生物工程公司合成。
2 方法
2.1 氧化磷脂和脂质体的制备
①氧化磷脂的制备 将2000 nmol溶解于氯仿中的PS用氮气吹干,加入200 μL PBS使磷脂终浓度为10 mmol/L,然后与200 μL水溶性过氧自由基引发剂AAPH(2,2'-azobis[2-amidinopropane]- dihydrochloride,100 mmol/L)一起于37 ℃温育4 h。氯仿/甲醇(V/V=2∶1)萃取得到氧化磷脂。磷脂的氧化程度通过测定磷脂氧化形成的过氧化物中共轭二烯在240 nm下的光吸收来定量。通过上述方法制备的氧化磷脂中含有30%氧化磷脂,70%为未氧化磷脂,这种氧化与未氧化的混合物称为氧化磷脂(oxidized PS,PSox)[4]。
②脂质体的制备 将溶于氯仿的PSox用氮气吹干,加入PBS(1000 nmol总磷脂加入1 mL PBS)。漩涡仪上混匀,然后在冰浴中超声3 min(输出功率60 W,脉冲时间6 s,间歇4 s)。用此种方法制备含PS和PSox(30%氧化PS,70%未氧化PS)的脂质体。脂质体现用现配。
2.2 磷脂信号整合到红细胞
①红细胞的分离 2-3 mL健康人外周静脉血取自自愿供血者,EDTA抗凝,1500 r/min离心10min,分离红细胞,用PBS洗3次后(PBS∶全血=10∶1),重悬于含0.1%葡萄糖的PBS中,制成20%红细胞悬液(1 mL红细胞沉淀加入9mL含0.1%葡萄糖的PBS中),放置于4℃待用。
② NEM预处理 50 μL 20%红细胞悬液用10 mL PBS稀释至0.1%,加入 NEM使其终浓度分别为20 μmol/L和30 μmol/L,置37℃温育30 min,用10 mL PBS洗3次以除去未结合的NEM,此为NEM处理的红细胞[5]。
③磷脂信号的整合 经②处理的红细胞用10 mL PBS稀释为0.1%,加入含磷脂信号-PS或PSox的脂质体(200 nmol)混合,磷脂总浓度为20 μmol/L。置37℃温育30 min,用10 mL PBS洗去未整合的脂质体(红细胞∶PBS=1∶100-200),1500 r/min离心10 min。
2.3 红细胞PS外翻的测定 经NEM处理和整合磷脂信号的红细胞PS外翻采用流式细胞仪测定annexin V-FITC阳性细胞百分率,按试剂盒说明书操作。
2.4 小胶质细胞对整合PSox红细胞的吞噬测定 小胶质细胞N9分别接种于24孔板和6孔板中(6孔板中2×105/well接种,24孔板中5×104/well接种),培养过夜。将正常和整合PSox的红细胞重悬于DMEM培养基,制成0.1%红细胞悬液。加入培养于24孔和6孔培养板的小胶质细胞(红细胞∶小胶质细胞=1∶50~100),置于37℃、5%CO2培养箱内分别孵育1 h和2 h,用1 mL 37℃预热PBS洗3遍去除未结合的红细胞,于倒置荧光显微镜下计数小胶质细胞吞噬红细胞的百分率,重复4次。2 h后,用37℃预热PBS洗3遍去除未结合的红细胞,收集细胞并提取RNA,重复3次。经过处理的红细胞用PKH试剂盒染为红色荧光,具体操作参照产品说明书。
2.5 Real-time PCR检测炎症因子IL-1β和TNF-α的转录表达
①总RNA的提取 将小胶质细胞与红细胞于37℃、5%CO2共培养2 h后,37℃ 预热PBS洗去未结合的红细胞,每孔加入300 μL(6孔板)Trizol裂解液吹打并将细胞裂解液收集于离心管中。室温静置5 min,加入200 μL氯仿剧烈摇晃15 s,室温静置10 min。12000 r/min、4 ℃ 离心 10 min,取上清加入200 μL异丙醇混匀,室温静置10 min,12000 r/min、4℃离心10min。用500 μL无水乙醇洗涤沉淀,12000 r/min离心5 min,空气中干燥10 min左右。将沉淀RNA溶于15 μL无RNase水中,分光光度计测定核酸浓度。
② 逆转录 以总RNA 1 μg作为模板,分别加入2 μL 5×PrimeScriptTMbuffer,0.5 μL PrimeScriptTMRT enzyme mix I,0.5 μL oligo dT primer(50 umol/L),2 μL random 6 primers(100 umol/L),最后加入无RNase水至总体积10 μL。37℃反应15 min,85℃反应5 s得到cDNA。
③ Real-time PCR检测 根据 SYBR Green real-time PCR Master Mix-Plus试剂盒的步骤进行操作,反应体系中加入SYBR Green real- time PCR Master Mix 10 μL,Master Plus 2 μL,上、下游引物各 0.4 nmol/L,模板 cDNA 2 μL,加 DDW至20 μL。引物序列如下:β-actin(270 bp)上游引物5'-GCGTGACATCAAAGAGAAGC-3',下游引物 5'-AGCACTGTGTTGGCATAGAG-3';IL-1β(249 bp)上游引物 5'-TGGGAAACAACAGTGGTCAGG -3',下游引物 5'-CCATCAGAGGCAAGGAGGAA-3';TNF-α(164 bp)上游引物5'-CCCCTCAGCAAACCACCA-3',下游引物 5'-GGCAGCCTTGTCCCTTGA-3'。cDNA的扩增在real-time PCR仪中进行,反应程序如下:首先95℃下加热15 s,扩增40个循环(95℃15 s,60℃ 15 s,72℃ 45 s),扩增结束后增加熔解曲线。
3 统计学处理
用统计软件SPSS 13.0对实验数据进行显著性分析,数据用均数±标准差()表示,Origin 7.5软件绘图。
结 果
1 红细胞PS外翻检测
整合不同磷脂的红细胞均有显著的PS外翻。PS外翻阳性细胞的百分率由对照的0.06%增加到7.40%-47.50%,见图1A-F。其中,经20 μmol/L NEM预处理10 min后再整合PS脂质体的红细胞凋亡率与直接经PSox脂质体处理的红细胞凋亡率分别为7.40%(图1B)和15.80%(图1C);而经20 μmol/L NEM预处理10 min后整合PSox脂质体的红细胞PS外翻率上升为35.70%(图1D);分别用经30 μmol/L NEM预处理30 min后红细胞凋亡率与经30 μmol/L NEM预处理30 min后再整合PSox脂质体的红细胞凋亡率则分别为8.71%(图1E)和47.50%(图1F)。说明磷脂整合到了红细胞膜上或者PSox的整合导致了红细胞PS外翻。
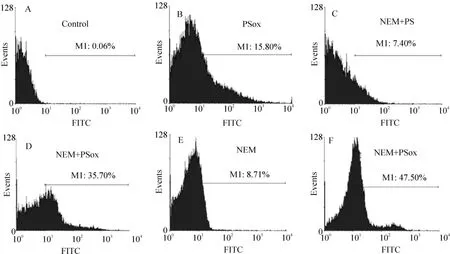
Figure 1.Phosphatidylserine externalization of RBC integrated with phospholipids or pre-treated with N-ethylmaleimide(NEM)measured by flow cytometry.A:the rate of RBC with auto-fluorescence;B:the rate of annexin V-positive RBC that incubated with PSox liposomes;C:after incubated with NEM(20 μmol/L)for 10 min,RBC were incubated with PS liposomes;D:after incubated with NEM(20 μmol/L)for 10 min,RBC were incubated with PSox liposomes;E:the rate of annexin V - positove RBC that incubated with NEM(30 μmol/L)for 30 min;F:after incubated with NEM(30 μmol/L)for 30 min,RBC were incubated with PSox liposomes.图1 流式细胞仪测定经过NEM和磷脂处理的红细胞PS外翻
2 小胶质细胞对整合氧化PS信号红细胞的吞噬检测
将正常红细胞加入到小胶质细胞(融合度45% -55%)中共培养发现,正常培养的小胶质细胞具有一定的吞噬能力,但吞噬能力不明显,见图2A。而将经PSox脂质体处理的红细胞加入到小胶质细胞N9(融合度45% -55%)中共培养,则发现小胶质细胞被凋亡红细胞激活而具有较强的吞噬能力,见图2B。小胶质细胞对凋亡红细胞的吞噬率为27.5%±5.4%,明显高于对照组吞噬率(3.8% ±1.0%),差异显著,见图2B,P <0.01。
3 检测小胶质细胞吞噬凋亡红细胞后炎症因子的表达变化
本实验将经PSox脂质体处理后的红细胞加入到培养的小胶质细胞(融合度45% -55%)中共培养,2 h后提取mRNA做real-time PCR检测,重复3次,以正常培养的小胶质细胞为对照。结果表明小胶质细胞在吞噬凋亡红细胞的同时,炎症因子IL-1β(图3A)与TNF-α(图3B)mRNA表达水平明显低于正常培养的小胶质细胞(P<0.01)。
讨 论
本研究通过脂质体整合将磷脂整合到红细胞膜上,成功制备了红细胞PS外翻的凋亡模型。流式细胞术结果显示整合磷脂可导致红细胞PS明显外翻(从对照组的0.06%增加到47.50%)(图1),可能原因是磷脂整合到了红细胞膜上或者磷脂的整合导致红细胞PS外翻,说明磷脂的整合能够使细胞中PS增加。在PS外翻率为47.50%(图1F)的处理组中,红细胞脆性较弱极易溶解,不适于吞噬实验;故最终选用PS外翻阳性率为35.70%(图1D)的凋亡红细胞进行吞噬实验。小胶质细胞-红细胞共培养结果显示(图2),整合PSox可显著增加小胶质细胞对凋亡红细胞的吞噬,说明红细胞表面PSox的整合能够促进小胶质细胞的吞噬。研究中,小胶质细胞对红细胞的吞噬能力大大高于文献中小胶质细胞对凋亡神经元的吞噬[2];而与相应文献中巨噬细胞对整合PSox红细胞的吞噬能力相当(25% -27%)[6]。说明在小胶质细胞-凋亡红细胞共培养体系中,氧化PS的增加触发了小胶质细胞吞噬效应的产生,使小胶质细胞表现出较强的吞噬能力。这与氧化PS促进巨噬细胞对凋亡细胞的吞噬作用相一致,故推测,在外周神经系统和中枢神经系统中,吞噬细胞对凋亡细胞的清除有着由PS或氧化PS介导的共同机制。

Figure 2.Phagocytosis of microglia to RBC integrated with phospholipids(×200).A:the N9 cells phagocytosed normal RBC after 1-hour culture;B:the N9 cells phagocytosed RBC integrated with PSox after 1-hour culture;C:quantitation of phagocytosis..n=4.**P<0.01 vs control.图2 小胶质细胞对整合磷脂红细胞的吞噬

Figure 3.Expression of IL-1β and TNF-α mRNA in microglia after cocultured with RBCs.Control:the N9 cells;PSox:the N9 cells phagocytosed RBC integrated with PSox after 2-hour culture..n=3.*P<0.05,**P<0.01 vs control.图3 N9细胞与红细胞共培养后炎症因子IL-1β和TNF-α mRNA表达
小胶质细胞受到外界刺激后便会活化为具有吞噬能力的巨噬细胞,同时释放各种前列腺素类分子、自由基及细胞因子,被认为是主导炎症过程的主要细胞成分。但小胶质细胞是否在有凋亡细胞存在的条件下就产生炎症因子,或小胶质细胞发挥吞噬功能与炎症因子表达之间有何关系却无文献报道。小胶质细胞-凋亡红细胞共培养实验中,小胶质细胞具有较强的吞噬能力(图2),而real-time PCR检测发现,与正常培养的小胶质细胞相比,共培养后的小胶质细胞中炎症因子IL-1β及TNF-α mRNA表达水平显著降低,故推测,小胶质细胞在活化初期具有强大的吞噬能力,且吞噬作用强于炎症反应。此时,凋亡细胞的存在,促进小胶质细胞的吞噬功能并抑制炎症因子的表达。本研究中,IL-1β mRNA表达水平低于TNF-α,说明IL-1β表达调节快于TNF-α,推测前者的表达变化可能对后者具有诱导作用。由于致炎性因子具有抑制小胶质细胞吞噬功能的作用,所以从理论上讲,抑制炎症因子的表达则可能保持小胶质细胞的吞噬功能,而目前研究较多的环氧合酶的抑制剂,如布洛芬等可恢复小胶质细胞的吞噬能力。
[1]Napoli I,Neumann H.Microglial clearance function in health and disease[J].Neuroscience,2009,158(3):1030-1038.
[2]Fuller AD,Van Eldik LJ.MFG - E8 regulates microglial phagocytosis of apoptotic neurons[J].J Neuroimmune Pharmacol,2008,3(4):246 -256.
[3]Fadok VA,Voelker DR,Campbell PA,et al.Exposure of phosphatidylserine on the surface of apoptotic lymphocytes triggers specific recognition and removal by macrophages[J].J Immunol,1992,148(7):2207 -2216.
[4]Tyurina YY,Sernkan FB,Tyurin VA,et al.Lipid antioxidant,etoposide,inhibits phosphatidylserine externalization and macrophage clearance of apoptotic cells by prevention phoaphatidylserine oxidation[J].J Biol Chem,2004,279(7):6056-6064.
[5]Kagan VE,Gleiss B,Tyurina YY,et al.A role for oxidative stress in apoptosis:Oxidation and externalization of phosphatidylserine is required for macrophage clearance of cells undergoing Fas- mediated apoptosis[J].J Immunol,2002,169(1):487 -499.
[6]王燕群,刘尚喜.磷脂酰丝氨酸在凋亡细胞被吞噬细胞清除中的作用[J].实用医学杂志,2006,22(13):1485-1487.

