组合法废稀盐酸浓缩工艺
吴振玉,高瑞昶,白 鹏,刘伟明,肖 颖,李 莹
(天津大学化工学院,天津 300072)
应用技术
组合法废稀盐酸浓缩工艺
吴振玉,高瑞昶,白 鹏,刘伟明,肖 颖,李 莹
(天津大学化工学院,天津 300072)
进行了加盐解吸-气体吸收-加盐精馏组合法提浓稀盐酸的实验研究。分别研究了盐浓度、吸收剂流量、塔釜加料量对该过程的影响。小试实验装置中采用解吸釜与吸收塔相连,分别以20%盐酸作为解吸液和吸收液。结果表明:解吸液中加盐浓度为0.3g/mL MgCl2时,高浓度HCl解吸气经吸收液吸收可获得浓度为32.80%的浓盐酸;将解吸釜内解吸至6.5%盐酸釜残液继续进行间歇加盐精馏,其中首先从塔顶采出的20%稀盐酸可作为解吸液或吸收液循环使用。该方法适用于间歇法小规模稀盐酸提浓处理。
废稀盐酸;加盐解吸;气体吸收;加盐精馏
盐酸是化工和制药领域常用的酸洗剂及原料,同时在这些生产过程中也会排放大量的低浓度废盐酸。由于盐酸通常会形成最高共沸物,共沸组成含氯化氢20.24%(质量分数),用普通精馏的方法无法得到浓度较高的盐酸溶液。而目前国内外应用比较成熟的大规模稀盐酸处理工艺主要有常规解吸法、压差法和催化剂法等。常规解吸法只适用于浓度高于20.24%的盐酸的解吸过程;压差法[1]对设备的要求较高;催化剂法又分为硫酸法[2]和氯化钙法[3]。而Hála等[4-5]的研究成果表明,加盐对溶液气液平衡具有十分显著的影响。因此在该理论的支持下,加盐精馏过程正成为许多学者研究的热点[6-8]。盐酸加盐精馏过程会产生大量的氯化氢不凝气,降低了氯化氢的回收率,同时也很难在塔顶得到较高浓度的盐酸溶液。针对这一情况,本文作者提出了吸收与加盐解吸过程耦合的方法进行间歇小规模稀盐酸的提浓,避免了单纯加盐精馏存在的缺陷。
1 工艺原理
根据盐效应理论[9],在稀盐酸溶液中加入盐可以改变组分的相对挥发度,破坏盐酸与水的恒沸组成。但由于在加盐精馏过程会产生大量HCl不凝气,使得塔顶无法得到浓度较高的盐酸产品。因此,本研究采用向塔釜加入20%盐酸进行加热解吸,同时以一定量20%盐酸作为吸收剂对解吸出的HCl进行吸收,吸收结束后可以得到浓度大于30%的盐酸溶液。之后,再对解吸所产生的稀盐酸釜残液进行加盐精馏,最后在塔顶可以得到浓度大于20%的盐酸,而在塔釜溶液的浓度接近于纯水。实验原理见图 1所示。
2 吸收与加盐解吸耦合提浓盐酸
2.1 工艺概述
本实验主要研究了塔釜加盐量、塔釜解吸液加料量、吸收剂流率对耦合过程的影响,评价参数包括:达到平衡时吸收液中HCl浓度、塔釜解吸液中HCl浓度、HCl的吸收率以及达到平衡所用的时间等。具体流程见图2所示。
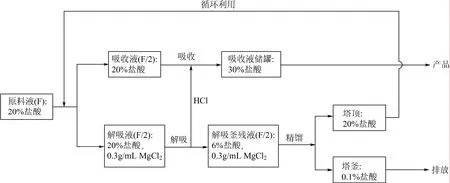
图1 组合法稀盐酸提浓工艺原理示意图

图2 解吸-吸收组合法实验装置示意图
向塔釜加入一定浓度的盐溶液MgCl2,当塔釜加热到一定温度后加入20%的盐酸溶液,同时在塔顶也加入一定量的20%盐酸作为吸收剂。塔釜加盐解吸出的HCl和水蒸气进入冷凝器,水蒸气冷凝后回到塔釜增加HCl的分压有利于解吸,而冷却后的HCl在吸收塔中被塔顶喷淋而下的20%盐酸进行充分地吸收。吸收之后的盐酸溶液又重新回到塔顶作为吸收剂,循环操作直至解吸与吸收过程达到平衡。最后在吸收液储槽中得到质量分数高于30%的盐酸溶液。
2.2 实验结果与分析
2.2.1 塔釜加盐量对耦合过程产生的影响
本实验配制质量分数为20%的盐酸1000 mL,其中500 mL用于塔釜解吸,另外500 mL作为吸收剂加入塔顶储罐。塔釜加入氯化镁质量浓度分别取0.1 g/mL、0.2 g/mL、0.3 g/mL,考察不同盐浓度下对平衡时吸收液中HCl浓度、塔釜解HCl浓度、HCl的吸收率及平衡时间这4个参数的影响。不同盐浓度下吸收液盐酸浓度随时间变化见图3。
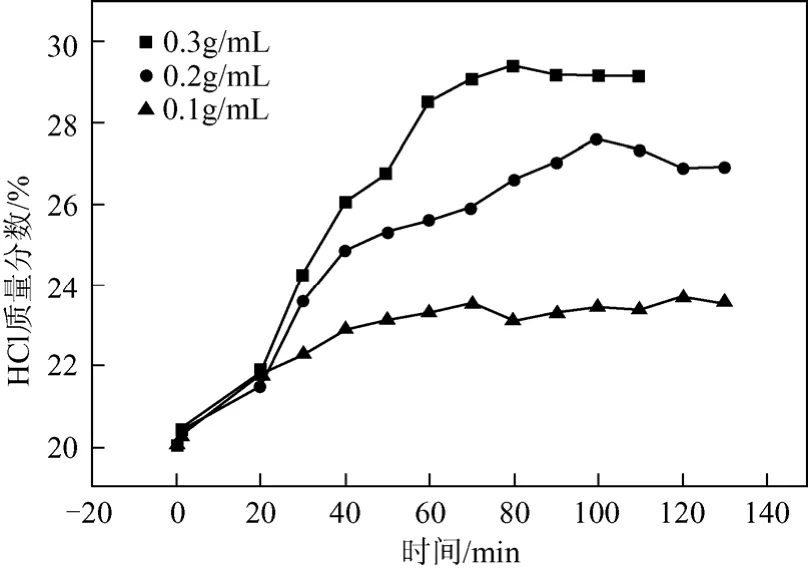
图3 不同盐浓度下吸收液盐酸浓度随时间变化图
从图3对比分析可以看出,实验的初始阶段由于温度较低,塔釜盐浓度对吸收液平均组成没有明显影响。随着塔釜温度升高,HCl解吸量加大,盐浓度对吸收液浓度的影响开始显现。当实验进行到20 min后,塔釜盐浓度0.3 g/mL时吸收液浓度 > 0.2 g/mL时吸收液浓度 > 0.1 g/mL时吸收液浓度。这是因为,当塔釜盐浓度增加后,由于同离子效应的作用,HCl的解吸量和解吸速率增加,使得气相氯化氢分压增大,进而增大了吸收液的平衡浓度。
本实验中,HCl的吸收率和操作时间也是比较重要的考察指标。由于塔高和吸收液流率的限制,吸收液不能将解吸出的HCl气体完全吸收。HCl的吸收率是指吸收剂吸收的HCl量占解吸出HCl 量的百分比。
从表1中可以看出,塔釜氯化镁的加入量越大,操作时间越短, HCl吸收率越低。这是由于当塔釜氯化镁浓度增加时,HCl气体的解吸速率和解吸量都会增加,从而使操作时间缩短,HCl吸收率降低。
2.2.2 塔釜加料量对耦合过程产生的影响
当塔釜加料量发生变化时,盐酸解吸速率与解吸量都会发生变化,从而影响吸收液和塔釜解吸液的平衡浓度。本实验中,在塔顶吸收液加入量(500 mL)、加入速率(15 mL/min)及塔釜盐浓度(0.3 g/mL)保持不变的前提下,研究了塔釜加料量分别为500 mL、600 mL、700 mL时对吸收液和解吸液的平衡浓度、操作时间以及HCl吸收率的影响。不同塔釜加料量对吸收液盐酸浓度的影响见图4。

表1 塔釜加盐量对操作时间、HCl吸收率的影响
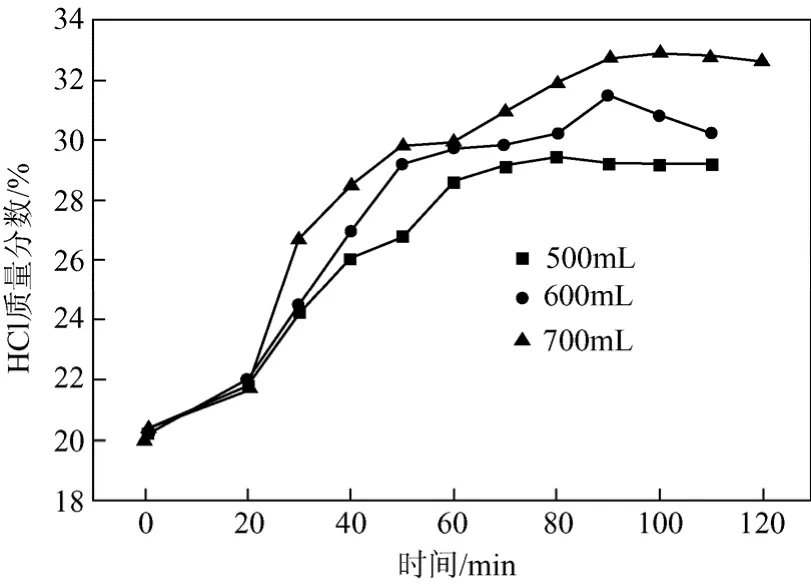
图4 不同塔釜加料量时吸收液浓度随时间变化图
从图 4对比分析可以看出,当实验进行到 20 min后,塔釜加料700 mL时吸收液浓度 > 600 mL时吸收液浓度 > 500 mL时吸收液浓度。这是因为,在盐浓度保持相同的情况下,塔釜加料量增加后解吸出更多的氯化氢气体再进一步被充分吸收,从而增大了吸收液浓度。塔釜加料量的增加对操作时间和HCl吸收率也会产生一定的影响,塔釜加料量对操作时间和HCl吸收率的影响见表2。
从表2中可以看出,操作时间随塔釜加料量的增加而增加,这是由于在相同盐浓度条件下,增加塔釜进料量会使HCl的解吸量增加,相应的操作时间也会增长。HCl的吸收率随塔釜进料量的增加而降低,这是由于加料量的增加使解吸的HCl量增加,在吸收剂加入量和流率保持不变的情况下,HCl的吸收效率相对降低。
2.2.3 吸收剂流率对耦合过程产生的影响
吸收剂用量L或液气比L/V在吸收塔的设计计算和塔的操作调节中是一个很重要的参数。当V值一定时,吸收剂用量L增大,相应的传质推动力会增大,结果就会使吸收剂的出塔浓度降低。但是由于本实验中吸收剂是循环使用的,在传质推动力增大的情况下,吸收剂的出塔浓度并不会降低。本实验中,在塔顶吸收剂加入量(500 mL)、塔釜进料量(600 mL)、进料塔釜温度(50 ℃)及塔釜盐浓度(0.3 g/mL)保持不变的前提下,研究了吸收剂流率分别为10 mL/min、15 mL/min、20 mL/min时对各评价参数产生的影响。不同吸收剂流率对吸收液浓度的变化如图5所示。

表2 塔釜加料量对操作时间、HCl吸收率的影响

图5 不同吸收剂流率下吸收液浓度随时间变化图
从图5可以看出,实验开始阶段吸收剂流率越小吸收液盐酸浓度越高。其中吸收剂流量为10mL/min时吸收液浓度最高升至34.11%,随后浓度开始下降。随着实验的进行,当吸收达到平衡时,吸收液流量为20 mL/min时吸收液浓度 >15 mL/min时吸收液浓度 > 10 mL/min时吸收液浓度。这是由于塔釜加料量一定,当吸收剂流率增大时,液气比增大,吸收效率提高,进而增大了吸收液的平衡浓度。
吸收剂流率增加对HCl吸收率也会产生一定的影响,不同吸收剂流率下HCl吸收率如表3所示。
由表3可以看出,HCl的吸收率随吸收剂流率的增加而增大,这是由于当吸收剂流率较小时,达到平衡所需的HCl量越小,从而使HCl的损失量增加。
3 间歇精馏处理盐酸釜残液
3.1 流程简述
以盐酸釜残液为原料进行间歇加盐精馏,分别研究了塔釜盐浓度、回流比对塔顶、塔釜盐酸浓度的影响,以便找出合适的操作条件,实现盐酸的深度脱吸。具体流程见图6。

表3 吸收剂流率对HCl吸收率的影响

图6 间歇加盐精馏实验装置示意图
在实验开始之前,首先要对釜残液的盐酸浓度进行调整,将盐酸浓度统一调整到 6%,以便于对实验结果进行对照分析。盐酸浓度调整之后,再向釜残液中加入一定量的氯化镁,进行60 min的全回流操作,使全塔处于稳定状态。全回流操作结束后,控制回流比在一定值,采出馏分。最后,用标准氢氧化钠溶液对釜残液以及采出样品的盐酸浓度进行标定。
3.2 结果讨论与分析
3.2.1 塔釜盐浓度对间歇精馏过程产生的影响
本实验在回流比(全采出)及其它实验条件不变的前提下,研究了塔釜盐浓度(氯化镁)分别为0.1 g/mL、0.2 g/mL、0.3 g/mL时塔顶、塔釜产品盐酸浓度随时间变化的情况。塔顶盐酸浓度随时间变化曲线如图7所示。

图7 不同加盐量时塔顶盐酸浓度随时间变化曲线
从图7对比分析可以看出,塔釜盐浓度不同时,塔顶产品盐酸浓度变化过程存在很大差别。当氯化镁浓度为0.3 g/mL时,塔顶一开始就可以采出浓度较高的产品,随后浓度逐渐降低;而当氯化镁浓度为0.2 g/mL和0.1 g/mL时,塔顶开始阶段采出液几乎为纯水,随后浓度逐渐升高;氯化镁浓度为 0.3 g/mL时,可以采出浓度为 20%的盐酸;而氯化镁浓度为0.2 g/mL、0.1 g/mL时,塔顶馏出液盐酸浓度都达不到20%。塔釜盐浓度不同时,操作时间也不同,氯化镁浓度为0.3 g/mL时,实验需70 min达到终点;而当氯化镁浓度为0.1 g/mL时,实验需120 min达到终点。综合各因素,可以看出氯化镁浓度为0.3 g/mL时,实验结果较为理想。
3.2.2 回流比对间歇精馏过程产生的影响
回流比的大小对精馏过程的分离效果和经济性有着重要的影响。在常规物系的分离中增大回流比,可以提高产品纯度,但也会增加能耗。盐酸-水物系属于特殊物系,HCl为挥发性电解质,在塔顶会形成不凝气不能被冷凝器冷却,因此回流比对盐酸-水物系的影响不同于常规物系。本实验在塔釜盐浓度为0.3 g/mL的前提下,研究了无回流及回流比为0.5、1时塔顶盐酸浓度随时间的变化情况见图8。
从图8对比分析可以看出,当回流比不同时,塔顶馏出液盐酸浓度变化趋势基本相同,但塔顶产品的初始浓度不同,回流比越大盐酸浓度越低。这主要是因为,当回流比增大时,塔顶HCl不凝气增多,不被吸收的HCl气体将从塔顶逸出,使得塔顶产品浓度降低。当实验进行到第30 min时,塔顶产品盐酸浓度均接近20%,但由于回流比不同,浓度为20%的盐酸采出量也不同,回流比越大,采出量越小。综合各因素考虑,回流比为0时实验结果较为理想。

图8 不同回流比下塔顶浓度随时间变化曲线
本实验20%盐酸原料液经加盐解吸-气体吸收-加盐精馏组合法提浓后,最后在吸收剂储罐中得到了质量分数大于30%的盐酸,在精馏塔顶得到质量分数接近20%的盐酸,而在塔釜浓度近乎为纯水。不同浓度的盐酸收率见表4。

表4 不同盐酸浓度的产品收率
4 结 语
(1)在本实验中,当 20%盐酸解吸液的盐MgCl2浓度达到 0.3 g/mL时,可解吸降低浓度至6.50%,与此同时,20%盐酸吸收液可增大浓度达到32.80%。
(2)增大吸收剂流量可以明显提高吸收效率,当吸收剂流量为20 mL/min时,HCl的吸收率可以达到75.12%。
(3)对于釜残液间歇加盐精馏而言,当釜残液加入 0.3 g/mL MgCl2盐溶液时,塔顶可以采出20%盐酸74 mL,盐酸的平均浓度为17.25%,而釜液HCl浓度低于0.1%。
相对于目前工业大规模稀盐酸的处理工艺,本文所提出并研究的加盐解吸-气体吸收-加盐精馏组合法提浓盐酸的过程,是适用于间歇小规模废稀盐酸的处理。其主要针对在化工制药领域中产生的废稀盐酸,是出于环保和资源循环利用的角度来考虑的。但本研究只是验证该处理工艺在技术上是基本可行的,还处于研究的初步阶段。今后还需要进一步研究塔釜加入固体盐的控制方法以及塔釜加压量对盐酸解吸过程的影响;同时可以建立合适的模型对实验过程进行模拟,从模拟的角度对实验条件进行优化。
[1]仇晓丰,吴春森,伍明霞,等. 浅谈氯化氢吸收与盐酸脱吸技术[J].氯碱工业,2004(1):32-36.
[2]唐涌濂. 稀废盐酸半连续萃取蒸馏制取浓盐酸的方法:中国,200410017364.7[P]. 2004-04-01.
[3]佐佐木正和,冨田知道,大池东久雄,等. 氯化氢的生产方法:中国,00105343.4[P]. 2000-03-31.
[4]Hála E. Excess free energy of dilution and the mean rational activity coefficients of ions[J].Collection Czech. Chem. Commun.,1963,28:1780.
[5]Hála E,Boublik T. Correlation of equilibrium data in three- and more component systems[J].Collection Czech. Chem. Commun.,1964,29:2412.
[6]赵林秀,王小燕,崔建兰,等. 加盐萃取精馏分离乙酸甲酯-甲醇二元恒沸物[J]. 石油化工,2005,34(2):144-147.
[7]许新乐. 杂醇油加盐萃取精馏提取低水乙醇的研究[J]. 青海大学学报,2001,19(4):26-28.
[8]陈小平,张珠. 加盐萃取精馏分离乙酮-水恒沸物的研究[J]. 烟台大学学报,2002,15(2):128-132.
[9]Furter W F. Salt distillation review[J].Can. J. Chem. Eng.,1978,25(5):33-38.
Concentrating dilute hydrochloric acid by combined method
WU Zhenyu,GAO Ruichang,BAI Peng,LIU Weiming,XIAO Ying,LI Ying
(School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China)
In this work,the combination of salt desorption,gas absorption and salt-added distillation was used to conduct experimental research of concentrating dilute hydrochloric acid. The influence of salt concentration,absorbent flow rate,still capacity on the process was investigated. For the lab experiment,the desorption still was connected directly with the absorption tower,and hydrochloric acid(20%) was used as both desorption solution and absorbent. It was shown that when 0.3 g/mL MgCl2was added in the desorption solution,hydrochloric acid enriched gas from the solution could be absorbed by the absorbent,whose concentration then increased to 32.80%. After that,salt-added distillation was carried out to deal with the residue hydrochloric acid(6.5%)in the desorption still. Hydrochloric acid(20%),which was recycled in the experiment as both desorption solution and absorbent,could be wihdrawn from the top of the distillation tower. The method mentioned in this work is suitable for small scale batch operation of concentrating dilute hydrochloric acid.
dilute hydrochloric acid;salt desorption;gas absorption;salt distillation
TQ 028.1+7
A
1000-6613(2011)08-1862-06
2010-12-23;修改稿日期2011-01-29。
吴振玉(1986—),女,硕士研究生,研究方向为制药化工分离过程。E-mail wuzhenyu0723@163.com。联系人:白鹏,教授。E-mail baipengtju@gmail.com。

