3,6-二氨基-N-异丁基邻苯二甲酰亚胺的合成
陈碧琼, 杨心师, 袁立华, 冯 文
(四川大学 化学学院 教育部辐射物理与技术重点实验室 原子核科学技术研究所,四川 成都 610064)
结构稳定、孔径可调控及功能多样化的刚性大环是近年来超分子研究领域所关注的焦点[1,2]。利用三中心氢键导向一步缩合高效成环,是除模板、分子内环化、可逆共价等方法之外的一种新型的大环合成法。邻位二取代间苯二酰卤与间或对苯二胺在三中心氢键和远程位阻效应作用下,可使分子骨架呈刚性诱导寡聚芳酰胺有不同的弯曲程度,合成空腔尺寸可调控的环芳酰胺[3~7],且环状结构产物的羰基氧指向环内部,形成富电子亲水空腔,环状结构还可通过自组装形成不同类型的纳米分子结构,如纳米管、球等特性[8~10],使其在离子选择性识别[11,12]、模拟离子通道[13],药物输送和缓释、液晶[14~16]等方面具有潜在应用价值。合成这类大环的关键之一是采用含分子内氢键的适当的二胺单体。但目前导致成环过程中分子内氢键形成的二胺类构筑单元仅局限于如邻位烷氧基取代的间或对苯二胺。
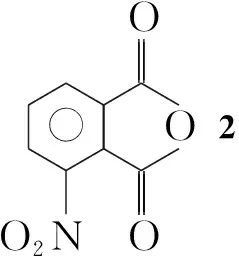
为了合成一种空腔孔径较大的新型大环芳酰胺,本文设计并合成了一种新型的含酰亚胺结构的对苯二胺衍生物——3,6-二氨基-N-异丁基邻苯二甲酰亚胺(1): 3-硝基邻苯二甲酸经成酐得到3-硝基邻苯二甲酸酐(2);2与异丁胺作用生成N-异丁基-3-硝基邻苯二甲酰亚胺(3);3经Pd/C催化氢化并醋酸酐酰化得3-乙酰氨基-N-异丁基邻苯二甲酰亚胺(4); 4经硝化制得3-乙酰氨基-N-异丁基-6-硝基邻苯二甲酰亚胺(5); 5用浓硫酸除去乙酰基得6; 6经催化氢化合成了1(Scheme 1),总收率16.4%,其结构经1H NMR,13C NMR和ESI-MS表征。

Scheme1
该方法具有操作方法简单、产率较高等优点,是合成该对苯二胺衍生物的一种较好方法。
1 实验部分
1.1 仪器与试剂
Bruker AVⅡ-500 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);ThermoFisher Scientifitic 的FinniganTMTSQ Quantum UltraTM型质谱仪。
按文献[17]方法合成2,黄色固体,产率95%;1H NMRδ: 8.34(t,J=7.9 Hz, 1H), 8.44(d,J=7.6 Hz, 1H), 8.53(d,J=8.0 Hz, 1H); ESI-MSm/z: Calcd for C8H3NO5{[M+H]+}193.00, found 194.1[M+H+]}。其余所用试剂均为分析纯。
1.2 合成
(1) 3的合成[18]
在反应瓶中加入无水DMF 80 mL和2 15.0 g(77.7 mmol),搅拌下回流15 min;用注射法滴加异丁胺5.63 g(77.1 mmol)(1 h);回流反应2 h;加入乙酸酐20 mL,回流反应3 h。减压蒸除乙酸酐和DMF,剩余物用乙醚(200 mL)溶解,依次用饱和NaHCO3溶液(3×100 mL)和水(3×100 mL)洗涤,无水MgSO4干燥,蒸除溶剂后用乙醇重结晶得黄色固体310.13 g,产率53%;1H NMRδ: 8.76(d,J=8.5 Hz, 1H), 7.71(t,J=8.5 Hz, 1H), 7.53(d,J=7.1 Hz, 1H), 2.29(d,J=1.5 Hz, 2H), 2.10(m, 1H), 1.02(d,J=6.5 Hz, 6H); ESI-MSm/z: Calcd for C12H12N2O4[M+] 248.2, found 249.2{[M+H]+}。
(2) 4的合成
将3 3.09 g(12.4 mmol)溶于乙酐30 mL和冰醋酸40 mL中,加入Pd/C 0.60 g,于95 ℃/4 Pa加氢振荡4 h。过滤,滤饼用乙醚(70 mL)溶解后,依次用饱和NaHCO3溶液(3×30 mL)和水洗涤,无水MgSO4干燥,蒸除溶剂后用冷乙醇重结晶得白色固体4 2.67 g,产率82.4%;1H NMRδ: 9.56(s, 1H), 8.77(d,J=8.5 Hz, 1H), 7.66(t,J=8.0 Hz, 1H), 7.51(d,J=7.0 Hz, 1H), 3.47(d,J=7.0 Hz, 2H), 2.27(s, 3H), 2.11(m, 1H), 0.95(d,J=7.0 Hz, 6H);13C NMRδ: 170.64, 169.36, 168.15, 137.40, 135.90, 131.52, 124.73, 118.04, 115.64, 45.38, 28.00, 25.07, 20.23; ESI-MSm/z: Calcd for C14H16N2O3[M+] 260.1, found 261.0{[M+H]+}。
(3) 5的合成
在反应瓶中加入40.50 g(1.92 mmol),冰水浴冷却,于0 ℃加入CH2Cl26 mL,搅拌使其溶解;于10 min内滴加浓H2SO41 mL和发烟HNO31 mL;搅拌10 min,加入碎冰,用乙醚(3×100 mL)萃取,合并醚层,依次用饱和NaHCO3溶液(3×10 mL)和水(3×100 mL)洗涤,无水MgSO4干燥,蒸除溶剂后用乙醚/正己烷重结晶得黄色固体5 0.33 g,产率56.3%;1H NMRδ: 10.04(s, 1H), 8.96(d,J=9.2 Hz, 1H), 8.15(d,J=9.2 Hz, 1H), 3.52(d,J=7.6 Hz, 2H), 2.33(s, 3H), 2.11(m, 1H), 0.96(d,J=6.8 Hz, 6H);13C NMRδ: 169.63, 168.86, 162.58, 140.85, 131.41, 125.10, 124.28, 116.42, 46.09, 27.86, 25.20, 20.23; ESI-MSm/z: Calcd for C14H15N3O5[M+] 305.1, found 305.9{[M+H]+}。
(4) 6的合成
将5 0.32 g(1.05 mmol)溶于30 mL混合溶剂[V(甲醇) ∶V(CH2Cl2)=2 ∶1]中,搅拌下于5 ℃滴加浓硫酸4 mL,滴毕,于室温反应1.5 h左右。用6 mol·L-1NaOH溶液中和至pH≈7,依次用CH2Cl2和水洗涤,用正己烷萃取,合并萃取液,浓缩有机液得黄色固体6 0.22 g,产率79.6%;1H NMRδ: 8.02(d,J=8.5 Hz, 1H), 6.87(d,J=9.0 Hz, 1H), 5.90(s, 2H), 3.47(d,J=7.5 Hz, 2H), 2.12(m, 1H), 0.94(d,J=6.5 Hz, 6H);13C NMRδ: 168.96, 163.42, 148.57, 131.59, 126.56, 120.06, 111.59, 81.35, 45.75, 27.86, 20.27; ESI-MSm/z: Calcd for C12H13N3O4[M+] 263.1, found 264.2{[M+H]+}。
(5) 1的合成
将60.5 g(1.90 mmol)溶于CH2Cl2(30 mL)中,加入Pd/C 75 mg,于23 ℃/2 Pa加氢振荡2.5 h。后处理同1.2(2)得红色固体10.39 g,产率88.1%;1H NMRδ: 6.75(s, 2H), 4.80(s, 4H), 3.41(d,J=7.0 Hz, 2H), 2.09(m, 1H), 2.12(m, 1H), 0.93(d,J=6.5 Hz, 6H);13C NMRδ: 170.03, 137.97, 124.86, 110.26, 44.76, 28.04, 20.28; ESI-MSm/z: Calcd for C12H15N3O2[M+] 233.1, found 234.0{[M+H]+}。
[1] 胡晋川,冯文,李向晖,等. 芳酰胺类大环一步高效合成及其成环机理研究进展[J].物理化学学报,2010,26(7):1811-1822.
[2] 钟凯,朱槿,邓金根. 折叠物的超分子行为研究进展[J].合成化学,2007,15(6):667-676.
[3] Yuan L H, Feng W, Yamato K,etal. Highly efficient,one-step macrocyclizations assisted by the folding and preorganization of precursor oligomers[J].J Am Chem Soc,2004,126:11120-11121.
[4] Feng W, Yamato K, Yang L Q,etal. Efficient kinetic macrocyclization[J].J Am Chem Soc,2009,131:2629-2637.
[5] Zou S L, He Y Z, Yang Y A,etal. Improving the efficiency of forming ‘Unfavorable’ products:Eight-residue macrocycles from folded aromatic oligoamide precursors[J].Synlett,2009,9:1437-1440.
[6] Yang L Q, Zhong L J, Yamato K,etal. Aromatic oligoamide macrocycles from the bimolecular coupling of folded oligomeric precursors[J].New J Chem,2009,33:729-733.
[7] Yuan L H, Sanford A R, Feng W,etal. Synthesis of crescent aromatic oligoamides[J].J Org Chem,2005,70:10660-10669.
[8] Zhang Y F, Yamato K, Zhong K,etal. Aggregation and columnar assembly of crescent oligoamides[J].Org Lett,2008,10:4339-4342.
[9] 张云峰,钟凯,朱槿,等. 芳香寡聚酰胺类化合物的合成[J].合成化学,2009,17(5):574-576.
[10] 杨永安,袁立华,胡晋川,等. 带极性侧链的环[6]芳酰胺的球形自组装[J].物理化学学报,2010,26:1557-1564.
[11] Sanford A R, Yuan L H, Feng W,etal. Cyclic aromatic oligoamides as highly selective receptors for the guanidinium ion[J].Chem Commun,2005,37:4720-4722.
[12] Yamato K, Yuan L H, Feng W,etal. Crescent oligoamides as hosts:Conformation-dependent binding specificity[J].Org & Biomol Chem,2009,7:3643-3647.
[13] Helsel A J, Brown A L, Yamato K,etal. Highly conducting transmembrane pores formed by aromatic oligoamide macrocycles[J].J Am Chem Soc,2008,130:15784-15785.
[14] Höger S, Cheng X H, Ramminger A D,etal. Discotic liquid crystals with an inverted structure[J].Angew Chem Int Edit,2005,44:2801-2805.
[15] Seo S H, Jones T V, Seyler H,etal. Liquid crystalline order from ortho-phenylene ethynylene macrocycles[J].J Am Chem Soc,2006,128:9264-9265.
[16] 谢政,张炜,黄鹏程. 芳炔类共轭大环化合物[J].有机化学,2002,22(8):543-554.
[17] Tanaka F S, Wien R G, Suttle J C. Synthesis and bioactivity of photoaffinity labels of the plant growth regulator 1-(3-chlorophthalimido)cyclohexanecarboxamide[J].J Agric Food Chem,1991,39:554-559.
[18] Fearn J E, DeWitt J B. Rodent repellency of some substituted phthalimides[J].J Pharm Sci,1964,53:1269-1270.

