阿佐昔芬的合成
刘爱霞, 禹艳坤, 王 超, 冀亚飞
(华东理工大学 药学院,上海 200237)
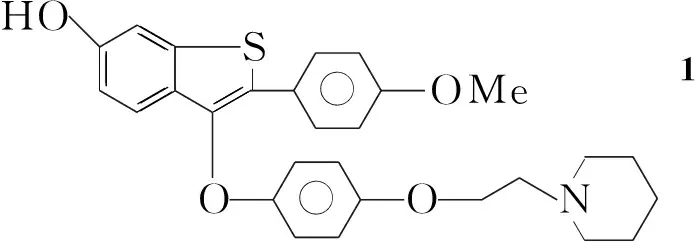
阿佐昔芬(1)是美国礼来公司继雷洛昔芬之后开发的第三代选择性雌激素受体调节剂,对乳腺、卵巢和子宫内膜的雌激素受体具有强拮抗活性[1];也可以使正常或低骨量的绝经后女性的腰椎和全髋骨矿物质密度增加,主要用于防治骨质疏松症和预防乳腺癌。
目前,合成1的路线主要有三条:(1)礼来公司[2]以6-甲氧基苯并[b]噻吩为起始原料,经11步反应制得1,总收率21.7%。该路线应用了繁琐的羟基保护策略,硼酸化反应温度-60 ℃,条件苛刻,Suzuki偶联反应使用较昂贵的试剂四(三苯基膦)钯,甲醚化反应使用昂贵试剂碘甲烷,使得原料成本高,难有规模化应用价值。(2)Dean等[3]以4-碘苯酚为起始原料,经9步反应制得1。该路线使用昂贵的碘试剂和剧毒的氰化钾试剂,其目的主要用于合成2H,3H和13C标记化合物,以便进行药理方面的研究。(3)Qin等[4]以2-溴-1-(4-溴苯基)乙酮(3)和3-甲氧基苯硫酚(9)为原料,经8步反应制得1,总收率9.2%。该路线所用原料相对易得,反应条件温和,操作简便。
本文对路线(3)进行工艺改进:以4-溴苯乙酮(2)为起始原料,经溴化、与9缩合、分子内环合得6-甲氧基-2-(4-溴苯基)苯并[b]噻吩(5);5经溴化、氧化反应后,与4-[2-(1-哌啶基)乙氧基]苯酚(10)缩合制得关键中间体3-{4-[2-(1-哌啶基)乙氧基]苯氧基}-6-甲氧基-2-(4-溴苯基)苯并[b]噻吩亚砜(7); 7再经还原、脱甲基、甲氧基化反应合成了1(Scheme 1),总收率24.3%,其结构经1H NMR和EI-MS确证。



Scheme1
改进后的合成路线和工艺避免使用苛刻的反应条件和昂贵试剂,减少了实验步骤,降低了原料成本,使总收率从9.2%提高至24.3%,具有经济、简便、安全、高效等特点。
1 实验部分
1.1 仪器与试剂
XT4A型显微熔点仪(温度计未校正);Bruker AVANCE 500型核磁共振仪(DMSO-d6为溶剂,TMS为内标);LC/TOP MS型质谱仪。
10参考文献[5,6]方法合成;其余所用试剂均为化学纯或分析纯,其中CH2Cl2和DMF经无水处理。
1.2 合成
(1) 3的合成
在反应瓶中依次加入2 23.9 g(120 mmol),甲醇120 mL和48%氢溴酸0.5 mL,搅拌下于室温缓慢滴加溴素6.7 mL(130 mmol)的甲醇(30 mL)溶液(4.5 h);继续反应30 min。倒入水(300 mL)中,静置,过滤,滤饼用乙醇重结晶得白色针状晶体3 32.2 g,收率96.5%, m.p.109 ℃~110 ℃;1H NMR(CDCl3)δ: 4.41(s, 2H, CH2), 7.65(d,J=8.6 Hz, 2H, ArH), 7.86(d,J=8.6 Hz, 2H, ArH); EI-MSm/z(%): 276(M+, 4), 183(100), 155(14)。
(2) 1-(4-溴苯基)-2-(3-甲氧基苯硫基)乙酮(4)的合成
在反应瓶中依次加入氢氧化钾6.7 g(120 mmol),水15 mL,乙醇100 mL和913.6 mL(110 mmol),于室温搅拌30 min;缓慢滴加3 27.8 g(100 mmol)的乙醇(160 mL)溶液(6 h);反应30 min。减压蒸除溶剂,残余液用乙酸乙酯(100 mL)萃取,合并有机层,用饱和食盐水(2×30 mL)洗涤,无水硫酸钠干燥,脱溶得白色固体4 32.8 g,收率97.3%, m.p.75 ℃~76 ℃;1H NMR(CDCl3)δ: 3.78(s, 3H, CH3), 4.23(s, 2H, CH2), 6.78(dd,J= 8.0 Hz, 2.0 Hz, 1H, ArH), 6.92(s, 1H, ArH), 6.95(d,J=8.0 Hz, 1H, ArH), 7.20(t,J=8.0 Hz, 1H, ArH), 7.61(d,J=8.4 Hz, 2H, ArH), 7.80(d,J=8.4 Hz, 2H, ArH); EI-MSm/z(%): 336(M+, 58), 183(100), 155(9), 138(9)。
(3)5的合成
在反应瓶中加入多聚磷酸(PPA)100 mL,搅拌下于80 ℃分四批加入4 30.0 g(89 mmol)(1 h)。升温至95 ℃剧烈搅拌反应2 h。倾入冰水(300 mL)中,搅拌30 min;用乙酸乙酯(3×100 mL)萃取,合并有机相,依次用饱和食盐水(150 mL),饱和碳酸氢钠溶液(100 mL),饱和食盐水(150 mL)洗涤,无水硫酸钠干燥,脱溶得白色固体518.2 g,收率64.1%, m.p.103 ℃~104 ℃;1H NMRδ: 3.85(s, 3H, CH3), 7.07(dd,J=8.9 Hz, 2.1 Hz, 1H, ArH), 7.56(d,J=8.3 Hz, 2H, ArH), 7.66(d,J=2.1 Hz, 1H, ArH), 7.67(s, 1H, thiophene-H), 7.70(d,J=8.3 Hz, 2H, ArH), 7.74(d,J=8.9 Hz, 1H, ArH); EI-MSm/z(%): 318(M+, 100), 303(34), 275(14), 195(16)。
(4) 3-溴-6-甲氧基-2-(4-溴苯基)苯并[b]噻吩亚砜(6)的合成
在反应瓶中依次加入5 16.0 g(50 mmol)和CH2Cl2160 mL,搅拌下于室温缓慢滴加溴素2.6 mL(51 mmol)的CH2Cl2(30 mL)溶液(1.5 h);滴毕,反应30 min。用CH2Cl2(50 mL)稀释,依次用蒸馏水(100 mL),饱和食盐水(100 mL)洗涤,无水硫酸钠干燥,浓缩后用乙酸乙酯重结晶得白色固体溴化产物(Ⅰ)19.1 g,收率96.0%, m.p.150 ℃~151 ℃。
将Ⅰ直接加入CH2Cl2(200 mL)和CF3CO2H(100 mL)中,搅拌下于室温缓慢滴加30%H2O210.3 mL(100 mmol),滴毕,反应2 h。加入10%NaHSO3溶液(25 mL),搅拌15 min;减压蒸除溶剂,加入CH2Cl2(150 mL)与饱和碳酸氢钠溶液(100 mL),分出有机相,依次用水(50 mL),饱和食盐水(50 mL)洗涤,无水硫酸钠干燥,浓缩后用乙酸乙酯重结晶得黄色固体6 13.1 g,收率63.3%(以5计),m.p.208 ℃~209 ℃;1H NMRδ: 3.89(s, 3H, CH3), 6.98(dd,J=8.5 Hz, 2.3 Hz, 1H, ArH), 7.16(d,J=8.5 Hz, 1H, ArH), 7.37(d,J=8.4 Hz, 2H, ArH), 7.51(d,J=2.3 Hz, 1H, ArH), 7.68(d,J=8.4 Hz, 2H, ArH); EI-MSm/z(%): 412(M+, 7), 396(12), 381(8), 353(3), 333(66), 305(100)。
(5) 7的合成
在反应瓶中依次加入10 4.9 g(22 mmol)和DMF 75 mL,搅拌下分四批加入氢化钠0.6 g(24 mmol)(1 h内);加入6 8.3 g(20 mmol),于室温反应3 h。用乙酸乙酯(100 mL)稀释后依次用水(3×50 mL),饱和食盐水(50 mL)洗涤,无水硫酸钠干燥,旋蒸除溶得黄色固体7 10.4 g,收率93.8%, m.p.48 ℃~53 ℃;1H NMRδ: 1.37~1.38(m, 2H, CH2) , 1.48~1.50(m, 4H, CH2), 2.42(bs, 4H, CH2), 2.63(t,J=5.6 Hz, 2H, CH2), 3.85(s, 3H, CH3), 4.02(t,J=5.6 Hz, 2H, CH2), 6.91(d,J=9.0 Hz, 2H, ArH), 7.13~7.16(m, 3H, ArH), 7.28(d,J=8.5 Hz, 2H, ArH), 7.48(d,J=8.4 Hz, 2H, ArH), 7.66(d,J=2.2 Hz, 1H, ArH), 7.71(d,J=8.4 Hz, 2H, ArH); EI-MSm/z(%): 537(3), 98(100)。
(6) 3-{4-[2-(1-哌啶基)乙氧基]苯氧基}-6-羟基-2-(4-溴苯基)苯并[b]噻吩(8)的合成
在反应瓶中依次加入7 10.0 g(18 mmol), CH2Cl260 mL和1 mol·L-1HCl-Et2O溶液(36 mL),搅拌下于室温反应1 h。减压蒸除溶剂,剩余物用THF(100 mL)溶解;加入三甲基氯硅烷(TMSCl)23.0 mL(180 mmol)和三苯基磷15.0 g(57.2 mmol),回流反应8 h。减压蒸除溶剂,残余物加入乙酸乙酯(100 mL)后,用饱和碳酸氢钠溶液洗涤,浓缩,粗品经硅胶柱层析[洗脱剂:V(氯仿) ∶V(甲醇)=11 ∶1]纯化得黄色油状物。直接用CH2Cl2(30 mL)溶解后加入1 mol·L-1HCl-Et2O溶液(32.0 mL),搅拌1 h;减压蒸除溶剂,残余物用CH2Cl2(150 mL)溶解,冷却至0 ℃,缓慢滴加三溴化硼5.7 mL(60 mmol)的CH2Cl2(30 mL)溶液(1 h内);于0 ℃反应3 h。加入饱和碳酸氢钠溶液(50 mL),分出有机相,水相用二氯甲烷(50 mL)萃取,合并有机相,依次用水(40 mL),饱和食盐水(40 mL)洗涤,无水硫酸钠干燥,浓缩得黄色固体8 6.8 g,收率72.0%, m.p.80 ℃~83 ℃;1H NMRδ: 1.38(bs, 2H, CH2) , 1.50(bs, 4H, CH2), 2.37~2.38(m, 4H, CH2), 2.64(t,J=5.6 Hz, 2H, CH2), 4.02(t,J=5.6 Hz, 2H, CH2), 6.88(d,J=8.7 Hz, 1H, ArH), 6.93(d,J=8.7 Hz, 2H, ArH), 7.09(d,J=8.7 Hz, 2H, ArH), 7.22(s, 1H, ArH), 7.41(d,J=8.7 Hz, 1H, ArH), 7.48(d,J=8.2Hz, 2H, ArH), 7.67(d,J=8.2Hz, 2H, ArH), 9.64(s, 1H, OH); EI-MSm/z(%): 523(M+, 5), 98(100)。
(7)1的合成
在压力釜中依次加入10%的甲醇钠/甲醇溶液19.5 g(36 mmol), 8 6.3 g(12 mmol),碘化亚铜0.23 g(1.2 mmol)及甲酸甲酯0.4 mL(6 mmol),密闭压力釜,搅拌下于110 ℃反应3 h。冷却至室温,蒸馏回收甲醇后加入乙酸乙酯(80 mL),以5 mol·L-1醋酸调至pH 7;分出有机相,依次用水(40 mL),饱和食盐水(40 mL)洗涤,无水硫酸钠干燥,浓缩得白色固体15.4 g,收率94.6%, m.p.120 ℃~122 ℃;1H NMRδ: 1.46(bs, 2H, CH2) , 1.66(bs, 4H, CH2), 2.37~2.39(m, 4H, CH2), 2.64(bs, 2H, CH2), 3.78(s, 3H, CH3), 4.22(bs, 2H, CH2), 6.89(bs, 1H, ArH), 6.97(bs, 2H, ArH), 7.04(bs, 2H, ArH), 7.07(bs, 2H, ArH), 7.22(s, 1H, ArH), 7.42(bs, 3H, ArH), 9.68(s, 1H, OH); EI-MSm/z(%): 475(M+, 20), 98(100)。
2 结果与讨论
在6的合成中,文献[2]方法用的溴化试剂为N-溴代乙酰胺,收率95.0%;我们改用廉价的溴素作为溴化试剂,室温反应2 h后5完全转化,且无苯环溴代杂质的生成,收率96.0%。
8是由7经还原和脱甲基两步反应制得,文献[2]方法使用三氟化硼二甲硫醚络合物作为脱甲基化试剂;本文改用三溴化硼作为脱甲基试剂,亦可降低原料成本,另外,用三溴化硼脱甲基还具有操作平稳、副反应少等优点。
8经甲氧基化反应合成1时,文献[4]方法使用经典的碘化亚铜-DMF反应催化体系,收率为85%。结合该反应特点,本文采用最新的甲氧基化反应工艺[7],以甲醇钠-甲醇溶液为反应试剂和溶剂,碘化亚铜-甲酸甲酯为协同催化剂制备1,该体系可以使甲氧基化反应彻底,减少脱溴还原反应的发生,从而提高1的收率(94.6%)。但过量的还原剂三苯基磷和反应生成的三苯基氧磷仍需柱层析除去,这是该路线有待进一步改进和完善的地方。
[1] Downs R W, Moffett A M, Ghosh, A,etal. Effects of arzoxifene on bone,lipid markers,and safety parameters in postmenopausal women with low bone mass[J].Osteoporosis International,2010,21(7):1215-1226.
[2] Palkowitz A D, Carmel I, Thrasher K J,etal. Benzothiophene compounds,intermediates,compositions,and methods[P].EP 0729 956,1996.
[3] Dean D C, Filer C N, McCarthy K E. Proceedings of the eighth international symposium on the synthesis and applications of isotopically labelled compounds[J].Boston,Massachusetts,2003[C],2004:401-404.
[4] Qin Z H, Kastrati I, Pavel A,etal. Benzothiophene selective estrogen receptor modulators with modulated oxidative activity and receptor affinity[J].J Med Chem,2007,50(11):2682-2692.
[5] Butler C R, Edwards J P, Fourie A M,etal. Preparation of phenyl and pyridyl leukotriene A4 hydrolase(LTA4H) modulators[P].WO 105 304,2006.
[6] Grice C A, Tays K L, Savall B M,etal. Identification of a potent,selective,and orally active leukotriene A4 hydrolase inhibitor with anti-inflammatory activity[J].Journal of Medicinal Chemistry,2008,51(14):4150-4169.
[7] 冀亚飞,金文虎,万欢,等. 一种芳香族甲醚化合物的制备方法[P].CN 10 1575 269,2009.

