火麻仁粕酶解产物的抗氧化活性研究
林金莺 安 琪 曾庆祝
(广州大学化学化工学院,广东 广州 510006)
火麻仁粕酶解产物的抗氧化活性研究
林金莺 安 琪 曾庆祝
(广州大学化学化工学院,广东 广州 510006)
采用Alcalase 2.4L FG酶解火麻仁粕,研究不同酶解条件下酶解物的抗氧化活性。结果表明,酶解5 h的产物抗氧化效果最好:酶解物对DPPH·、HO·的清除以及对二价铁离子螯合的EC50分别为1.36,0.62,1.15 mg/m L,虽然比传统抗氧化剂差,但发现在抑制油酸过氧化体系中从第5天开始酶解物对油酸的抑制效果优于α-生育酚,并且酶解物中游离抗氧化氨基酸高。
火麻仁粕;酶解;抗氧化
火麻仁(cannabis sativa L.)一直以来作为重要的食物和医药原料在中国已经使用了数千年。它含20%~25%蛋白质、25%~30%油脂、20%~30%膳食纤维及一系列丰富的维生素和矿物质[1]。火麻仁蛋白主要是球蛋白和白蛋白,能满足人体所需的各种必需氨基酸,其中精氨酸、赖氨酸和谷氨酸的含量较高。研究[2]表明,火麻仁蛋白所含必需氨基酸足以满足2~5岁儿童生长发育需要,是一种十分优异的植物蛋白新来源。
近年来,全世界对蛋白资源做了较多深入的研究。到目前为止,大豆蛋白[3]、小麦蛋白[4]、玉米蛋白[5]等酶解产物中相继被发现含有功能肽,其中大豆多肽、玉米多肽等成功进行了产业化。但火麻仁蛋白目前尚未得到较好的开发利用。据报道[6],Alcalase 2.4 L FG的酶解产物比其它酶的酶解产物具有更强的抗氧化性。故本试验拟利用Alcalase 2.4 L FG酶解火麻仁粕,研究不同酶解条件下酶解物的抗氧化活性,旨为火麻仁粕的综合利用提供参考。
1 材料与方法
1.1 材料与试剂
火麻仁种子:广州市清平批发市场。除去杂质、去皮,在通风干燥箱中干燥,粉碎后过0.3~0.425 mm筛,用乙醚抽提油脂后密封,4℃放置备用。
Alcalase 2.4L FG:丹麦诺维信公司;
菲咯嗪、α-生育酚、2,2-二苯基-1-苦基苯肼(DPPH)、油酸:美国凯莱德公司;
水杨酸、三氯乙酸、甲醇:均为分析纯,广州化学试剂厂;
BHA:郑州天龙食品添加剂有限公司;
VC:东北制药厂。
1.2 主要设备与仪器
冷冻离心机:ALLEGRA-64R,梅特勒-托利多仪器(上海)有限公司;
真空冷冻干燥机:ALPHA 1-2/LD-Plus,德国克莱斯特公司;
高速药物粉碎机:WK-400B,山东青州市精诚机械有限公司;
集热式恒温加热磁力搅拌器:DF-101SDF-101S,巩义市予华仪器有限责任公司;
紫外分光光度计:UV2300,上海天美科学仪器有限公司;
高效液相色谱:510型,美国沃特斯公司;
氨基酸分析专用柱:PICO-TAG,美国沃特斯公司。
1.3 试验方法
1.3.1 火麻仁粕酶解方法 研究火麻仁粕不同酶解时间的酶解产物对各种自由基的清除能力,以找出最佳的酶解时间。底物浓度5%、Alcalase 2.4LFG浓度为底物浓度的2%、酶解温度60℃,定容后测定酶解0~6 h后酶解物的各种抗氧化活力,筛选出较合适的酶解时间。然后将最佳酶解时间酶解物冷冻干燥,并测定其EC50值。
1.3.2 测定方法
(1)多肽含量的测定:采用双缩脲法并作一定的修改。加入等量的三氯乙酸沉淀蛋白后,用0.3 m L样液并加入2.7 m L显色剂进行测定。
(2)DPPH·清除能力的测定:在Pérez-Jiménez等的方法[7]的基础上进行适当修改。0.3 m L的发酵液添加到2.7 m L0.000 1 mol/L DPPH 新鲜配制的甲醇溶液中,用力摇匀10 s,在黑暗中放置30 min后,用紫外-可见分光光度计在517 nm测定的吸光度,用没有加样品的DPPH甲醇溶液作为空白对照,抑制率按式(1)计算:
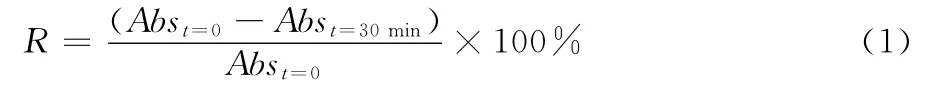
式中:
R—— 抑制率,%;
Abst=0—— 空白的吸光度;
Abst=30min—— 加入水解液后保温30 min的吸光度。
(3)酶解物与二价铁离子(Fe2+)螯合能力的测定:参照Decker等的测定方法[8]。
(4)羟基自由基HO·的清除能力的测定:参照贾之慎等的测定方法[9]。
(5)总还原力的测定:参照Oyaizu等的方法[10]。
(6)酶解物对油酸模型过氧化体系抑制的测定:在Xu等的方法[11]的基础上进行适当修改。分别加入1.3 mg酶解物、BHA和α-生育酚于4.7 m L乙醇溶液75%,0.1 m L硫氰酸胺30%,0.1 m L 2×10-2M(用3.5% 盐酸作溶剂)的FeCl2溶液。3 min后,在500 nm测定吸光度。记下0 min的测定值,然后分别在0~11天每天测定其吸光度。
(7)氨基酸分析:参照Tang等的方法[8]。将样品酸解后采用HPLC测定。氨基酸检测条件:PICO-TAG氨基酸分析专用柱,长度150 mm;柱温38℃,检测波长254 nm,流速1 m L/min,二元梯度洗脱测定氨基酸。
2 结果与讨论
2.1 酶解时间对酶解物抗氧化活性的影响
Alcalase 2.4L FG酶是碱性蛋白酶,水解能力强,价格较为便宜,是制备生物活性肽的重要酶种。Alcalase酶解火麻仁粕的酶解液在不同时间对自由基的清除能力见表1。
由表1可知,随着水解时间(1~6 h)的延长,酶解液清除DPPH·的能力越大,但从第4小时起变化不大;酶解物对Fe2+有很强的螯合力,各时间段的产物对其螯合率都很高,但随着酶解时间的延长,螯合率增加的趋势变缓;酶解液清除HO·的能力也是随着酶解时间的延长而增强,但酶解1 h的酶解液对HO·已经有较强的清除能力,在酶解5 h时已经达到最大值,酶解6 h稍微下降,其清除率与其螯合Fe2+的能力有相同趋势,这是因为抗氧化剂清除HO·主要是通过螯合过渡金属离子来产生作用的[12]。从表1还可以得出,酶解物的总还原力随着酶解时间的延长而增大,但在酶解5 h后增幅变小。

表1 Alcalase酶解火麻仁粕与自由基清除能力的关系Table 1 Relationship between hempseed hydrolysate by alcalase and radical scavenging activity
综合上述的结果,本试验选择Alcalase 2.4L FG对火麻仁粕酶解5 h,灭酶后120目过滤,用磁力搅拌机在95℃蒸发水分约2 h,然后在-38℃冷冻干燥约5 h,制成粉末,再做进一步的比较研究。
2.2 不同浓度酶解物的抗氧化活性
由图1~4可知,火麻仁粕酶解物的抗氧化活性与剂量正相关;酶解产物对各种自由基的清除效果比较好,但与传统的抗氧化剂相比较,有一定的差距。经计算得出,酶解物对DPPH·、HO·的清除以及对二价铁离子螯合的EC50分别为1.36,0.62,1.15 mg/mL。

图1 不同浓度酶解物对DPPH清除率的影响Figure 1 Effect on DPPH scavenging activity of different hydrolysates concentration
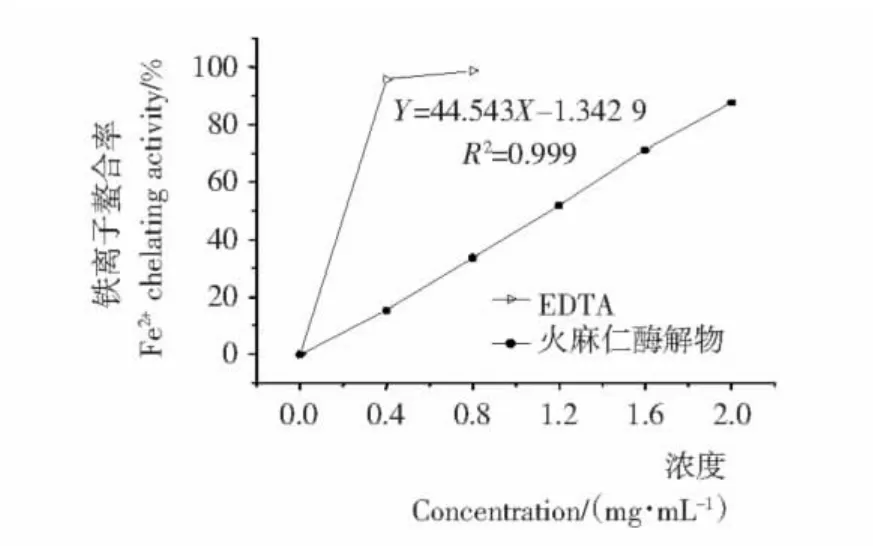
图2 不同浓度酶解物对铁离子螯合率的影响Figure 2 Effect on Fe2+chelating activity of different hydrolysates concentration
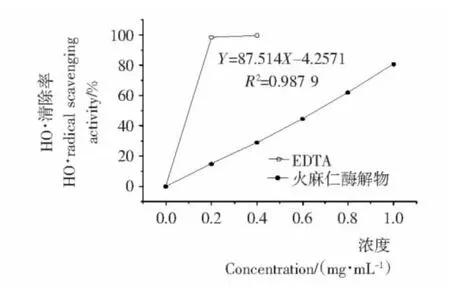
图3 不同浓度酶解物对HO·清除率的影响Figure 3 Effect on HO·radical scavenging activity of different hydrolysates concentration

图4 不同浓度酶解物对总还原力的影响Figure 4 Effect on reducing power of different hydrolysates concentration
2.3 酶解物对油酸过氧化体系的抑制作用
火麻仁粕酶解物、BHA和α-生育酚对油酸过氧化体系的抑制作用如图5所示,吸光度值越大,表明研究对象对过氧化体系的抑制作用越差。
由图5可知,在恒温试验的11 d中,火麻仁粕酶解物对油酸过氧化体系的抑制作用随着时间的延长是比较稳定的。前4 d,酶解物、BHA和α-生育酚对油酸的氧化抑制能力很接近,但从第5天起,酶解物比α-生育酚表现出较强的抗氧化作用;因此,火麻仁粕酶解物作为天然抗氧化剂是具有潜在的应用价值。

图5 酶解物对油酸过氧化体系抑制的研究Figure 5 Peroxidation inhibition activity in linoleic acid system of hydrolysate
2.4 酶解物的氨基酸分析
有研究[13]指出,半胱氨酸、组氨酸、色氨酸、赖氨酸、精氨酸、亮氨酸、缬氨酸以及它们的衍生物具有抗氧化性,苯丙氨酸也有抗氧化能力。火麻仁粕酶解物的氨基酸组成分析见表2。由表2可知,游离抗氧化氨基酸占总游离氨基酸的53.4%,而多肽中的抗氧化氨基酸占总多肽的35.85%,抗氧化氨基酸总量达到5 751.63 mg/100 mL。
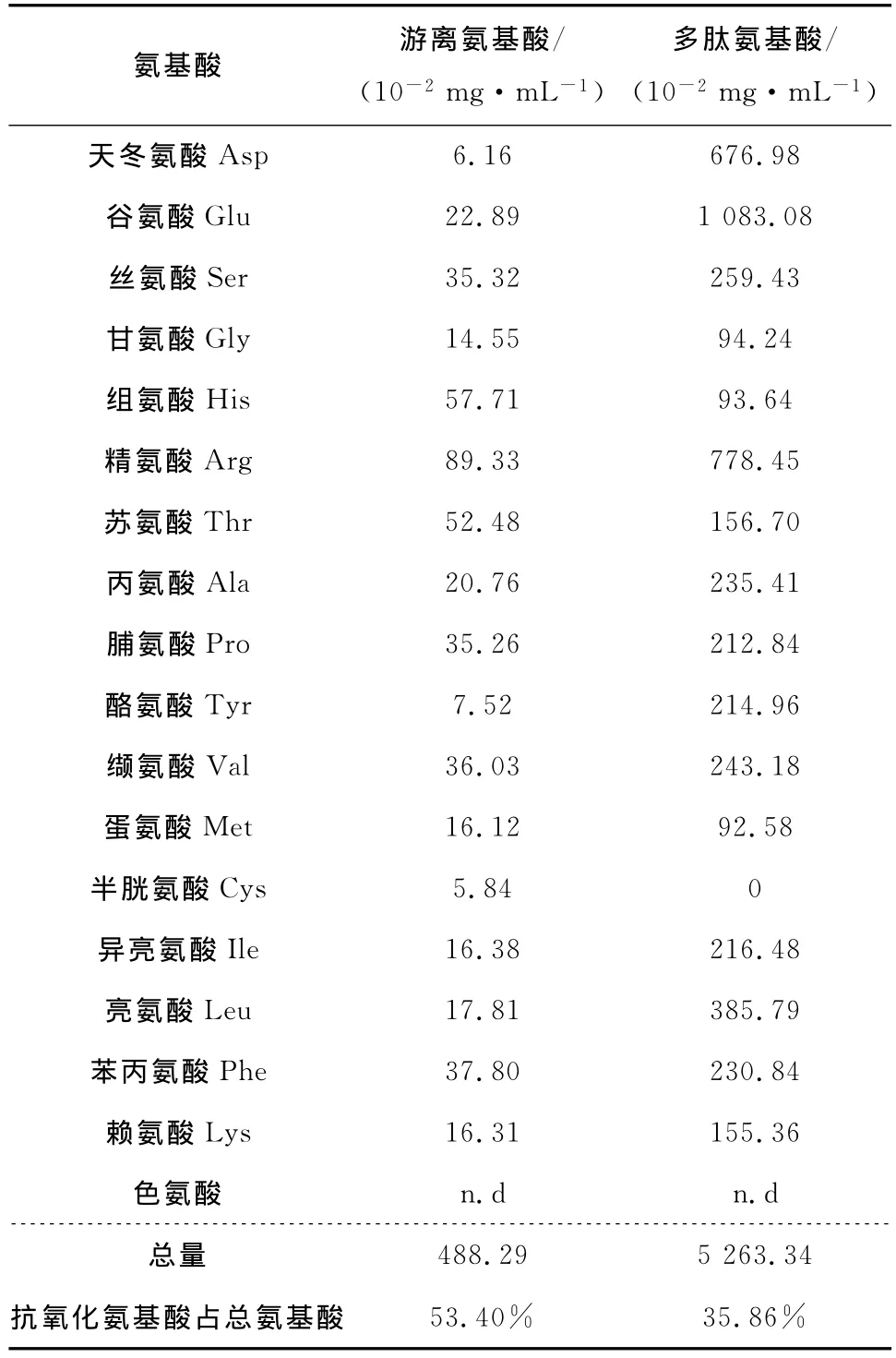
表2 酶解物的氨基酸组成分析+Table 2 Amino acid composition of hydrolysate
3 结论
虽然火麻仁粕酶解物抗氧化性比传统抗氧化剂差,但具有更为安全良好和稳定持久的抗氧化能力,酶解物中游离抗氧化氨基酸比多肽中抗氧化氨基酸含量高,因此,可能在食品特别是功能性食品及化妆品等领域具有潜在的应用价值。
1 Callway J C.Hempseed as a nutritional resource:An overview[J].Euphytica,2004,140(1-2):65~72.
2 Wang X S,Tang C H,Yang X Q,et al.Characterization,amino acid composition and in vitro digestibility of hemp(Cannabis sativa L.)[J].proteins,2008,107(1):11~18.
3 Wu J,Ding X.Hypertensive and physiological effect of angiotensin converting enzyme inhibitory pepyides derived from soy protein on spontaneeously hypertensive rats [J].J.Agri.Food Chem.,2001,49(1):501~506.
4 Zhu K X,Zhou H W,Qian H F.Antioxidant and free radicalscavenging activities of wheat germ protein hydrolysates(WGPH)prepared with alcalase[J].Process Biochem,2006,41(6):1 296~1 302.
5 Yamaguchi M,Nishikori F,Ito M,et al.Effect of corn peptide on alcohol metabolism and plasma free amino acid concentration healthy men[J].Eur.J.Clin.Nutr.,1996,50(10):682~688.
6 Je Jae-Young,Lee Ka-Hwa,Lee Mi Hyun,et al.Antioxidant and antihypertensive protein hydrolysates produced from tuna liver by enzymatic hydrolysis[J].Food Research International,2009,42(9):1 266~1 272.
7 Péréz-Jiménez J,Saura-Calixto F.Effect of solvent and certain food constituents on different antioxidant capacity assay [J].Food Research International,2006,39(7):791~800.
8 Tang C H,Wang X S,Yang X Q.Enzymatic hydrolysis of hemp(Cannabis sativa L.)protein isolate by various proteases and antioxidant properties of the resulting hydrolysates[J].Food Chemistry,2009,114(2):1 484~1 490.
9 Singh N,Rajini P S.Free radical scavenging activity of an aqueous extractof potato peel[J].Food Chemistry,2004,85(4):611~616.
10 Oyaizu M.Studies on products of browning reaction:Antioxidative activities of products reaction prepared from glucosamine[J].Japanese Journal of Nutrition,1986,44(6):307~315.
11 Xu L,Li H,Huang Y B,et al.A study on anti-oxidative activity of soybean peptides with linoleic acid peroxidation systems[J].Chemical Research in Chinese Universities,2006,22(2):205~208.
12 Bagchi D,Hassoun E A,Bagchi M D,et al.Muldoon and Oxidative stress induced by chronic administration of sodium dichromate[Cr(VI)]to rats[J].Camp.Biochem.Physiol.,1995,110(3):281~287.
13 Pena-Ramos E A,Xiong Y L.Antioxidant activity of soy protein hydrolysates in a liposomal system [J].J.Food Sci.,2002,67(8):2 952~2 956.
Research on the antioxidant activity of hydrolysate of hempseed meal
LIN Jin-ying AN QiZENG Qing-zhu
(College of chemistry and chemicals,Guangzhou University,Guangzhou,Guangdong510006,China)
In order to evaluation the radical scavenging activity of hydrolysate of hempseed meal in different hydrolysis period with Alcalase 2.4L FG.The optimal results were as folloued:hydrolysis by Alcalase 2.4L FG for 5 h,EC50value of DPPH·,HO·scavenging activity and Fe2+chelating ability of hydrolysate were 1.36 mg/m L,0.62 mg/m L,1.15 mg/m L respectively.Although inferior radical scavenging activity than traditional antioxidants,hydrolysate had a better lipid peroxidation inhibition activity thanα-tocopherol from the fifth day.Also,hydrolysate contains higher antioxidant amino acids.
hempseed meal;hydrolysis;antioxidation
10.3969/j.issn.1003-5788.2011.03.015
林金莺(1963-),女,广州大学副教授,博士。E-mail:8604 69013@qq.com
2011-02-20

