表达红色荧光蛋白重组柯萨奇病毒B组3型基因组稳定性分析
赵文然,钟学宽,张淑娟,沃晓嫚,张中海,王博,钟照华
1. 哈尔滨医科大学细胞生物学教研室,哈尔滨 150086; 2. 哈尔滨医科大学地方病防治研究中心,哈尔滨 150086; 3. 哈尔滨医科大学微生物学教研室,哈尔滨 150086
柯萨奇病毒B组(coxsackie virus B,CVB)是引起病毒性心肌炎的主要病原体,在一部分患者CVB感染可发展为扩张型心肌病[1-3]。在研究CVB感染时,通常要对细胞或实验动物的病毒感染情况进行定性或定量分析,或需要明确病毒在体内复制的部位及强度。对病毒感染的定性分析方法通常为观察细胞病变(cytopathic effect, CPE),而定量分析常用方法包括测定半数组织培养感染量(50% tissue culture infective dose, TCID50)、噬斑形成单位(plaque forming unit, PFU),或通过反转录-聚合酶链反应(reverse transcriptase-polymerase chain reaction, RT-PCR)测定感染细胞内的病毒核酸含量[4-7]。以上几种方法虽然很可靠,但除了对病毒感染细胞进行形态观察以外,其他方法均很耗时,且操作复杂。近年来,广泛应用的生物标记技术既可对病毒感染进行定性、定量分析,又可对病毒在体内感染过程进行示踪[8-11]。荧光报告基因标记是目前常用的生物标记方法之一,其中编码红色荧光蛋白(red fluorescent protein,RFP)的报告基因mCherry可用于研究多种病原体感染。mCherry的波长相对较长,可避免体内自发绿荧光的干扰[10,11]。对RNA病毒而言,由于RNA聚合酶缺乏纠错功能,病毒在复制过程中易产生基因突变[12-14]。这一特点可能影响重组RNA病毒基因组的稳定性[15]。因此,如果要通过红色荧光蛋白的表达对柯萨奇病毒B组3型(coxsackie virus B3,CVB3)的复制进行定性和定量分析,则有必要了解含mCherry报告基因的重组CVB3基因组的稳定性。
1 材料和方法
1.1 材料
1.1.1 质粒、细胞及主要试剂 pMKS1由J. Lindsay Whitton教授(The Scripps Research Institute,California)惠赠。质粒peGFP-N1购自Clontech公司。重组质粒pCVB3-mCherry(图1)携带嗜心肌的CVB3 H3毒株基因组全长cDNA及红色荧光蛋白mCherry基因编码序列由哈尔滨医科大学微生物学教研室构建。该重组质粒的构建方法见文献[14],即以pMKS1为基础,将序列两端含内切酶SfiI识别序列的mCherry基因插入CVB3基因组5′端。mCherry的激发波长为580 nm,发射波长为610 nm。HeLa细胞由哈尔滨医科大学微生物学教研室保存。质粒小量提取试剂盒、DNA小量胶回收试剂盒购自Axygen公司。DL2000 DNA Ladder、DL15000 DNA Ladder、pMD19-T Simple Vector、LATaq聚合酶和dNTP购自TaKaRa公司。真核转染试剂Lipofectamine 2000购自Invitrogen公司。胎牛血清(fetal calf serum,FCS)购自以色列Biological Industries公司(Cat: 04-001-1A;Lot: 215356)。中性红细胞染色液购自Sigma公司。细胞核染料Hoechst 33342购自Invitrogen公司,激发波长为350 nm,发射波长为480 nm。

图1 CVB3-mCherry的结构Fig.1 The structure of CVB3-mCherry
1.1.2 主要仪器 主要仪器包括Mastercycler gradient PCR仪(Eppendorf)和Axiovert 200相差倒置荧光显微镜(Carl Zeiss)。
1.1.3 主要软件及网站 Gene runner用于引物设计及多重序列比对;数据库http://www.ncbi.nlm.nih.gov/BLAST用于基因组结构查询及序列比对。
1.2 方法
1.2.1 重组质粒pCVB3-mCherry的扩增与纯化 取保存于-80 ℃含重组质粒pCVB3-mCherry的菌液适量,接种于5 ml含氨苄西林的LB培养基中,于37 ℃摇床振摇12~16 h(180 r/min),可见液体浑浊。取1.5 ml菌液加入离心管中,122 000g离心1 min,弃上清液。用质粒小量提取试剂盒提取质粒,检测浓度及纯度,-20 ℃保存备用。
1.2.2 pCVB3-mCherry在HeLa细胞中的瞬时表达 于24孔细胞培养板中培养HeLa细胞,24 h后选取生长状态良好且生长至70%~90%单层细胞,用OPTI-MEMI培养基稀释脂质体和质粒pCVB3-mCherry。转染细胞时,脂质体与质粒的比为2 μl∶0.8 μg;转染时设阳性对照(peGFP-N1转染细胞)、阴性对照及未经任何处理的HeLa细胞对照;置培养板于37 ℃、 5% CO2培养箱中培养,24 h后观察荧光表达及细胞病变情况。
1.2.3 病毒的收获及传代 用pCVB3-mCherry转染HeLa细胞,当70%~90%细胞出现病变时,收获细胞,反复冻融3次,于2 000g、4 ℃离心10 min,收集上清液,称为第1代病毒,储存于-80 ℃。用第1代病毒感染HeLa细胞,待70%~90%细胞出现病变时,收获细胞,反复冻融3次,离心后收集上清液,称为第2代病毒。以此类推,将病毒连续传至第6代。
1.2.4 噬斑形成实验及病毒毒力测定 将HeLa细胞以2.5×105个/孔接种于6孔细胞培养板中,于37 ℃、5% CO2培养箱中培养18~24 h。当细胞长至单层无缝隙时,用DMEM倍比稀释 (10倍稀释) 的病毒接种。每孔加入病毒稀释液650 μl,置37 ℃、5% CO2培养箱中培养1 h,弃病毒稀释液;每孔加入2 ml固体培养基(含5% FCS的2×DMEM和1.6% 琼脂糖,1∶1配制),放入湿盒,置37 ℃、5% CO2培养箱,30 min后倒置培养72 h。镜下观察荧光表达及CPE,根据CPE情况进行染色。于细胞培养板中加入0.05%中性红染色液,室温作用1 h,弃染液。挑选培养板中噬斑未融合且噬斑个数适中的培养孔,镜下计数噬斑个数,按以下公式计算病毒毒力:PFU/ml=每个稀释浓度噬斑的平均值/(病毒的稀释浓度×每孔病毒接种量)。
1.2.5 重组毒株的纯化及稳定性评价 取第1代病毒用于噬斑形成实验。挑取单个噬斑,接种于HeLa细胞进行扩增(100 ml规格培养瓶),于37 ℃、5% CO2培养箱中静置培养;当90%细胞出现CPE时,将细胞反复冻融3次,收获病毒,此为纯化后的CVB3-mCherry第1代病毒。以同样方法纯化第2~6代病毒。分别提取每代病毒总RNA,用RT-PCR扩增重组毒株中的mCherry报告基因及CVB3基因组部分序列,经0.7%琼脂糖电泳观察扩增产物片段大小。
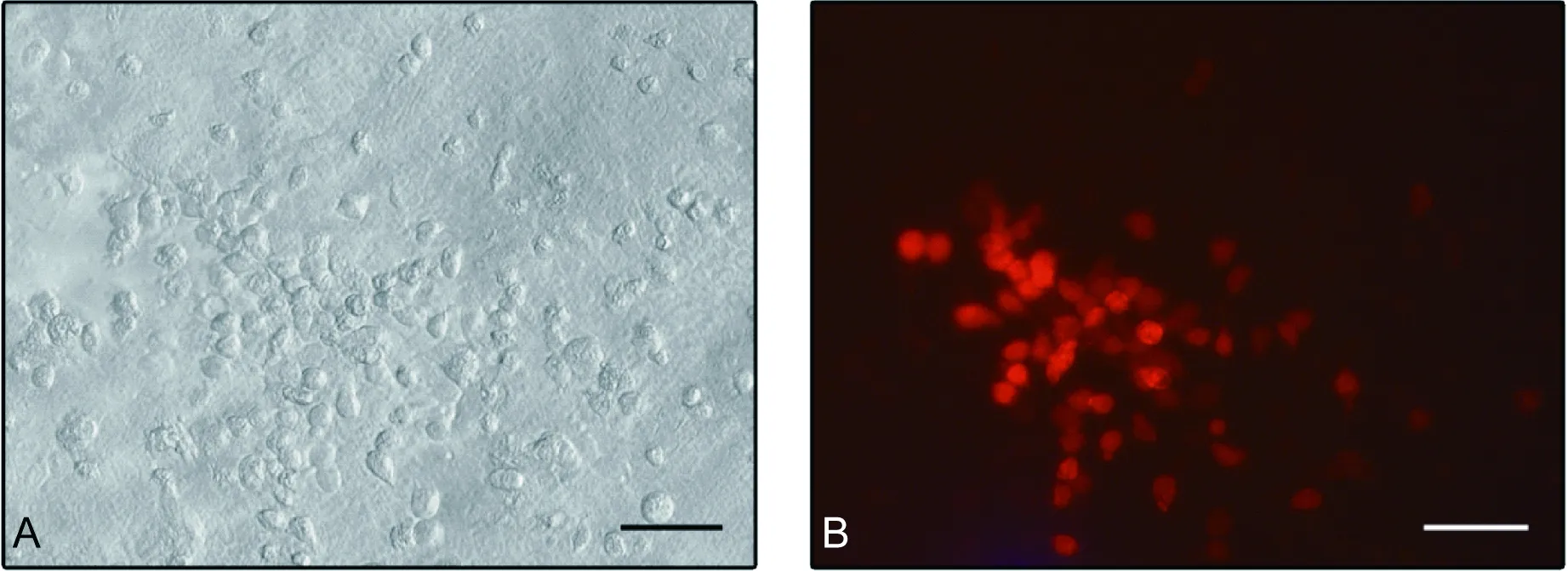
HeLa cells transfected with pCVB3-mCherry in light microscopy (A) and fluorescence microscopy (B). Scale bar, 100 μm.
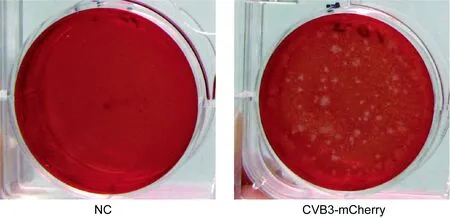
NC:HeLa cells without CVB3-mCherry infection; CVB3-mCherry: HeLa cells infected with the first passage of CVB3-mCherry.

A: RT-PCR strategy to analyze the stability of CVB3-mCherry. B: RT-PCR results. C : Cytopathic effect of CVB3-mCherry in HeLa cells in light and fluorescence microscopy. Panel 0 represents HeLa cells without virus infection. Panel 2-6 represent HeLa cells infected with the 2-6 passages of CVB3-mCherry.
PCR引物序列如下:上游引物(P1)5′-GGCGGCAGTGTGTCGTAACGGGC- AAC-3′(CVB3的5′ UTR区),下游引物(P2)5′-GCGTGGTTCTGTGAACTTGCCCGGG-3′(CVB3的VP4区)。如果重组病毒基因组携带mCherry基因,扩增片段预期为1 160 bp;如果重组病毒基因组丢失报告基因mCherry,扩增片段应为455 bp。用pCVB3-mCherry、pMKS-1作为扩增模板的阳性对照,ddH2O为阴性对照。将扩增产物各片段用凝胶回收法纯化,进行TA克隆,测序(北京英骏公司)后分析目的片段丢失规律。测序引物为PMD19T载体通用引物,引物序列为M13F-47(CGCCAGG-GTTTTCCCAGTCACGAC)和M13R-48(AGCG-GATAACAATTTCACACAGGA)。
2 结果
2.1 pCVB3-mCherry在HeLa细胞中的瞬时表达
用pCVB3-mCherry转染HeLa细胞,培养60 h 后,光学显微镜下可见CPE,荧光显微镜下可见细胞内红色荧光(图2),表明CVB3-mCherry可感染细胞并在细胞内复制,可用于CVB感染的体外研究。
2.2 CVB3-mCherry的毒力
用重组质粒pCVB3-mCherry转染HeLa细胞,转染60 h后检测到红色荧光,收获第1代重组病毒,用噬斑形成实验测得病毒毒力为9.3×106PFU/ml(图3)。
2.3 CVB3-mCherry的稳定性
提取各代CVB3-mCherry基因组RNA,用于RT-PCR扩增。结果(图4B)显示,第2代和第3代重组病毒的扩增产物于1 160 bp处有较亮的条带,455 bp处未见到条带,但可见长度<455 bp的片段。随着传代次数递增,扩增产物中的1 160 bp片段显示的条带逐渐模糊;同时,长度<455 bp的未知片段则随病毒传代次数的增加而变得清晰。此结果表明,报告基因mCherry的丢失开始于重组病毒的第2代;在mCherry基因片段丢失的同时,部分CVB3基因片段也随之丢失。然而,第2~6代重组病毒所致的CPE没有显著区别(图4C)。
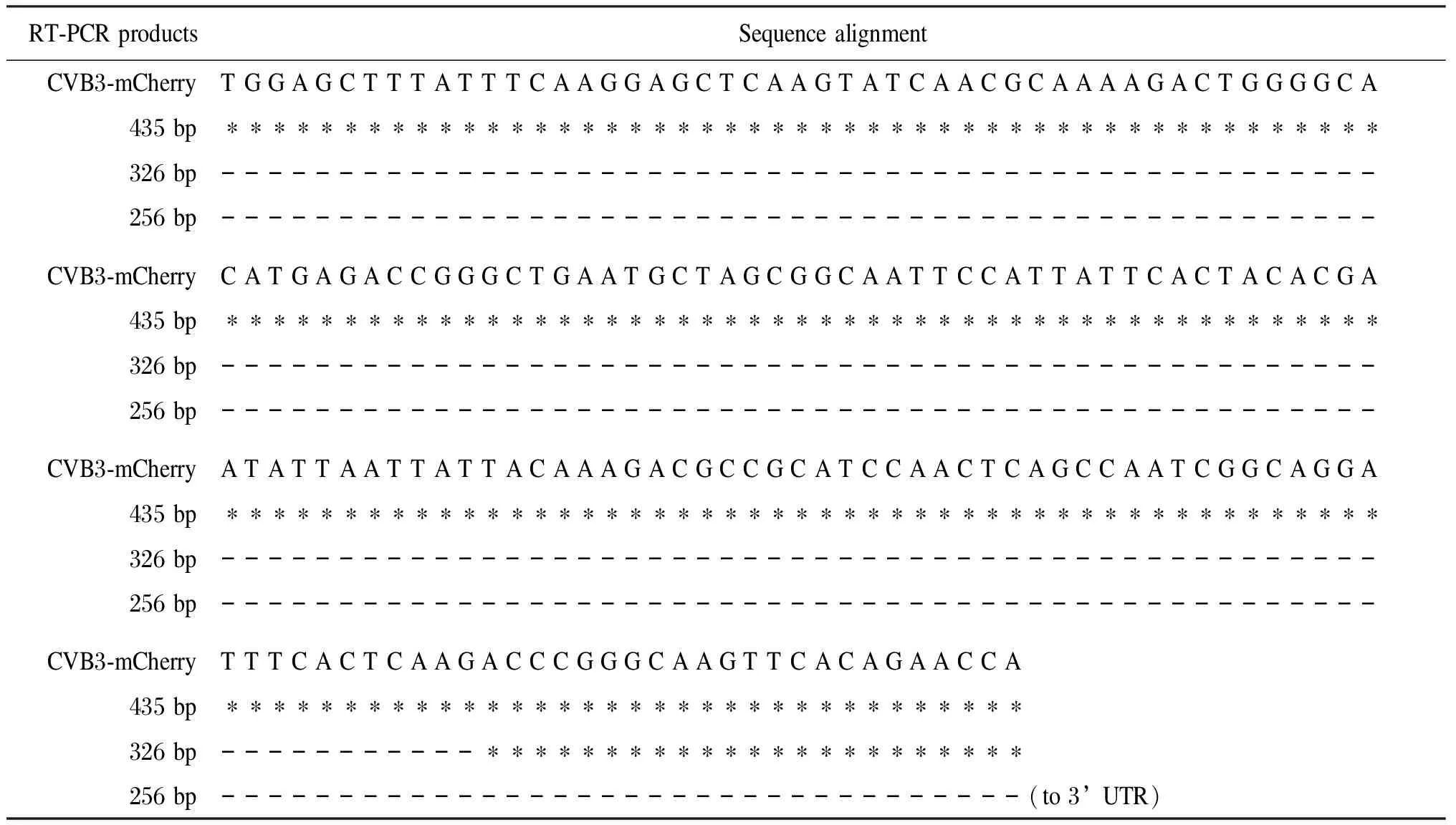
将RT-PCR扩增产物中3个长度<455 bp的小片段回收纯化,经TA克隆后测序,与重组质粒pCVB3-mCherry进行序列比对。其中RT-PCR获得的3个小片段长度分别为435 bp、326 bp和256 bp。435 bp片段的产生是由于重组病毒丢失了包括插入的SfiI酶切位点及mCherry全序列,并因此导致病毒开放读码框架(open reading frame,ORF)移位,但无病毒基因序列丢失;326 bp片段的产生是由于丢失了mCherry及病毒的VP4区部分序列;而256 bp片段的产生则是mCherry和CVB3 ORF全部丢失的结果(表1、图5)。
3 讨论
CVB为单股正链RNA病毒,能引起人类多种疾病,可侵犯心脏、脊髓、胰腺、肾脏、脑等多个重要器官,是病毒性心肌炎的主要病原体[1-3]。目前,对CVB感染进行定性和定量的诊断方法仍以形态学观察、测定PFU及RT-PCR为主。近年来荧光报告基因标记也广泛用于病毒检测。该方法更便捷,可用于病毒感染的定量分析及动态观察,但目前对于携带荧光报告基因的重组CVB基因组的稳定性仍缺乏了解。
本研究结果表明,重组体CVB3-mCherry能在HeLa细胞内复制并产生明显的CPE,可通过观察红色荧光蛋白表达情况来评价CVB的感染情况。此方法快速、简便。与其他普通的红色荧光蛋白相比,mCherry的优点在于有较长的发射波长、单体形式、在细胞内荧光转换效率高,因而具有较高的信噪比,更易被检测到;其次,检测时无需底物,只需激发光,既方便又节约成本[10,11]。

Red thin lines represent the locations of the fragments obtained from the 2-6 passages of CVB3-mCherry.

表1 重组病毒CVB3-mCherry与其突变体基因序列分析结果比对Fig.1 Sequence alignment between the recombinant CVB3-mCherry and its mutated progenies

(续表)
(续表)
* represents the nucleotide that is retained in CVB3-mCherry; - represents the nucleotide that has been lost from CVB3-mCherry.
基因组不稳定是小RNA病毒的共同特征[12-14]。有研究报道,与报告基因增强型绿色荧光蛋白(enhanced green fluorescent protein, eGFP)重组后,CVB基因组变得不稳定,在传代过程中会丢失报告基因及部分CVB基因序列[15]。因此推测,随着传代次数的增加,CVB3-mCherry毒株的稳定性也可能有所变化。本研究表明,从第2代开始,重组病毒中就发生了报告基因丢失。丢失的序列包括插入的报告基因mCherry、CVB的5′ UTR区及部分VP4区。而第4~6代的重组病毒更不稳定,其中未发生基因片段丢失的病毒数量逐渐减少,表现为PCR产物中1 160 bp处的条带越来越模糊,而发生基因丢失的病毒数量逐渐增加。序列分析表明,由于核酸序列丢失导致病毒ORF移位,因此会产生致死性突变株,使病毒失去原有的感染性。
本研究结果表明,与含报告基因eGFP的重组CVB3类似[15],重组CVB3-mCherry基因组也具有不稳定的特点。虽然从第2~6代重组病毒所致的CPE看不出显著变化,但包括CVB3自身基因片段在内的基因序列丢失从第2代就已存在。因此,应用时病毒传代次数不宜超过2代;长期应用则需重新用重组质粒转染敏感细胞以收获病毒。此外,应通过噬斑形成实验纯化CVB3-mCherry毒株并测定其毒力。尽管如此,该重组体仍不失为研究CVB的方便且可靠的工具。
[1] Pinkert S, Westermann D, Wang X, Klingel K, Dörner A, Savvatis K, Grössl T, Krohn S, Tschöpe C, Zeichhardt H, Kotsch K, Weitmann K, Hoffmann W, Schultheiss HP, Spiller OB, Poller W, Fechner H. Prevention of cardiac dysfunction in acute coxsackievirus B3 cardiomyopathy by inducible expression of a soluble coxsackievirus-adenovirus receptor [J]. Circulation, 2009, 120(23): 2358-2366.
[2] Rutschow S, Leschka S, Westermann D, Puhl K, Weitz A, Ladyszenskij L, Jaeger S, Zeichhardt H, Noutsias M, Schultheiss HP, Tschope C, Pauschinger M. Left ventricular enlargement in coxsackievirus-B3 induced chronic myocarditis-ongoing inflammation and an imbalance of the matrix degrading system [J]. Eur J Pharmacol, 2010, 630(1-3): 145-151.
[3] Luo H, Wong J, Wong B. Protein degradation systems in viral myocarditis leading to dilated cardiomyopathy [J]. Cardiovasc Res, 2010, 85(2): 347-356.
[4] Mitsuya H, Broder S. Inhibition of the in vitro infectivity and cytopathic effect of human T-lymphotrophic virus type III/lymphadenopathy-associated virus (HTLV-III/LAV) by 2′,3′-dideoxynucleosides [J]. Proc Natl Acad Sci USA, 1986, 83(6): 1911-1915.
[5] Van Houten N, Bouchard PE, Moraska A, Huber SA. Selection of an attenuated Coxsackievirus B3 variant, using a monoclonal antibody reactive to myocyte antigen [J]. J Virol, 1991, 65(3): 1286-1290.
[6] Lyden DC, Olszewski J, Feran M, Job LP, Huber SA. Coxsackievirus B-3-induced myocarditis. Effect of sex steroids on viremia and infectivity of cardiocytes [J]. Am J Pathol, 1987, 126(3): 432-438.
[7] Piqueur MA, Verstrepen WA, Bruynseels P, Mertens AH. Improvement of a real-time RT-PCR assay for the detection of enterovirus RNA [J]. Virol J, 2009, 6: 95.
[8] Luker GD, Luker KE. Optical imaging: current applications and future directions [J]. J Nucl Med, 2008, 49(1): 1-4.
[9] Wong J, Zhang J, Si X, Gao G, Mao I, McManus BM, Luo H. Autophagosome supports coxsackievirus B3 replication in host cells [J]. J Virol, 2008, 82(18): 9143-9153.
[10] Shaner NC, Steinbach PA, Tsien RY. A guide to choosing fluorescent proteins [J]. Nat Methods, 2005, 2(12): 905-909.
[11] Campbell EM, Perez O, Melar M, Hope TJ. Labeling HIV-1 virions with two fluorescent proteins allows identification of virions that have productively entered the target cell [J]. Virology, 2007, 360 (2): 286-293.
[12] Drake JW, Holland JJ. Mutation rates among RNA viruses [J]. Proc Natl Acad Sci USA, 1999, 96(24): 13910-13913.
[13] Worobey M, Holmes EC. Evolutionary aspects of recombination in RNA viruses [J]. J Gen Virol, 1999, 80 (Pt 10): 2535-2543.
[14] Sierra S, Dávila M, Lowenstein PR, Domingo E. Response of foot-and-mouth disease virus to increased mutagenesis: influence of viral load and fitness in loss of infectivity [J]. J Virol, 2000, 74(18): 8316-8323.
[15] Tong L, Lin L, Zhao W, Wang B, Wu S, Liu H, Zhong X, Cui Y, Gu H, Zhang F, Zhong Z. Destabilization of coxsackievirus B3 genome integrated with enhanced green fluorescent protein gene [J]. Intervirology,2011,54(5):268-275.

