局部注射免疫抑制剂治疗复发性毒性弥漫性甲状腺肿伴功能亢进症的疗效和安全性
俞文梅,张 礼,张 伟,刘志民,陈向芳*
(1.上海市安达医院内分泌科,上海201204;2.第二军医大学长征医院内分泌科,上海200003)
毒性弥漫性甲状腺肿伴功能亢进症(又称Graves病,下文简称Graves病)是一种器官特异性的自身免疫性疾病[1]。目前Graves病的基础治疗是口服抗甲状腺药物抑制甲状腺合成甲状腺激素,常规治疗药物有甲巯咪唑、丙硫氧嘧啶等。但是单纯用抗甲状腺药物治疗疗程长,且治愈率仅有40%,复发率高达50%~60%[2]。抗甲状腺药物的药理机制未针对病人自身的免疫环节,因此选择针对病因治疗的方法十分重要[3]。本课题组之前的研究表明,甲状腺局部注射免疫抑制剂对初发甲状腺功能亢进症(简称甲亢)的疗效肯定[4,5],由此思考该方法是否也适用于复发性Graves病的治疗。作者于2007-2011年采用免疫抑制剂等药物经甲状腺局部注射治疗复发性Graves病,观察疗效和安全性,并与单独口服抗甲状腺药物作比较,现报道如下。
1 资料和方法
1.1 研究对象 选取2007-01-01至2008-12-31在第二军医大学长征医院内分泌科就诊的300例复发性Graves病病人,均为女性,试验方案经本院伦理委员会审定通过。所有病人均自愿参加该试验,并签署知情同意书。入选标准[6,7]:甲状腺功能高于正常,达到甲亢实验室诊断标准;甲状腺触诊达到Ⅱ度及以上肿大;正规口服抗甲状腺药物治疗2年以上,达到治愈标准,停药后病情再现者。排除标准[5-7]:有严重心、肝、肾、消化性溃疡等疾病;有骨质疏松、糖尿病、严重高血压病、精神病病史;孕妇、哺乳期妇女;既往对奥曲肽过敏者;合并甲状腺癌者;年龄≥80岁的高龄者。采用简单随机化方法,通过随机数字表得到的随机分组,将病人分为两组,治疗组200例,对照组100例,年龄分别为(35±8)岁和(36±7)岁。
1.2 治疗方案 两组病人均给予口服抗甲状腺药物,疗程为2年。初始治疗选择甲巯咪唑(商品名赛治,德国默克制药有限公司),剂量为10mg,tid。如出现轻度白细胞减少或轻度肝功能损害,换用丙硫氧嘧啶(商品名 丙赛优,上海复星朝晖药业有限公司),根据甲亢程度,剂量为50mg/次,bid至100mg/次,tid,不等。治疗组病人在此基础上,甲状腺局部注射免疫抑制剂:环磷酰胺(CTX,上海华联制药有限公司)50mg/次+地塞米松(Dex,苏州第六制药厂)4mg/次+奥曲肽(商品名善得定,北京诺华制药有限公司)0.1mg/次。局部注射治疗每周1次,连续3个月;后改为2周1次,连续2个月;再改为每月1次,连续4个月。局部注射方法:病人取仰卧位,肩部垫枕充分暴露颈前区,常规消毒皮肤,避开血管,分别刺入双侧甲状腺肿大最明显部位,缓慢注射药物[4,5]。
1.3 疗效指标 所有病人每3个月抽静脉血化验血清总三碘甲状腺原氨酸(TT3)、总甲状腺素(TT4)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)和超敏促甲状腺激素(sTSH)。分别观察并检测病人甲状腺功能恢复正常的速度,包括甲状腺体积缩小程度,以及血清甲状腺球蛋白抗体(TGAb)、甲状腺过氧化物酶抗体(TPOAb)和促甲状腺激素受体抗体(TRAb)转阴情况。治疗结束后观察2年,计算复发率。
1.4 甲状腺体积 治疗前及治疗开始后第3、6、24个月由专人应用B超测量甲状腺体积。甲状腺体积(cm3)=长(cm)×宽(cm)×厚(cm)×0.6。
1.5 疗效指标的检测方法 TT3、TT4、FT3、FT4、sTSH、TGAb、TPOAb和TRAb采用磁性微粒分离的免疫酶联测定法,应用SN-697型全自动双探头放射免疫γ计数器(上海原子核研究所日环仪器一厂)和配套定量检测试剂盒,参照试剂盒说明书进行检测。
1.6 药品不良反应(ADRs) 治疗第1、2、3、6个月抽血化验肝、肾功能,治疗第1、2个月每周化验血、尿常规,并观察治疗过程中有无过敏反应、甲状腺功能低下、局部出血、声带麻痹、消化性溃疡、骨质疏松、肥胖、多毛等并发症或ADRs。
2 结 果
2.1 一般情况 两组病人初始治疗均给予甲巯咪唑10mg,tid。其中治疗组15例和对照组18例病人由于血常规异常或肝功能受损而改用丙硫氧嘧啶,按甲亢程度调整药物剂量,之后密切监测,若病人的血常规和肝功能均恢复正常,仍纳入统计范畴。治疗组有3例,对照组有2例病人在换用丙硫氧嘧啶时,由于出现肝功能损害加重而退出试验,改用同位素治疗,因此从统计资料中去除。治疗组和对照组分别有197和98例病人纳入最终统计结果。
2.2 甲状腺功能恢复情况 治疗组所有病人在治疗6个月时FT3、FT4和sTSH均恢复正常,治疗第2、3、6个月分别有80、100和17例恢复正常。对照组病人在治疗第2、3、6和12个月分别有0、40、30和28例恢复正常,即在治疗第12个月时才全部恢复正常(见表1)。
2.3 甲状腺抗体转阴情况 治疗组和对照组甲状腺相关抗体阳性率的变化见表2。由表2可见,治疗组的甲状腺相关抗体转阴率明显高于对照组。
2.4 甲状腺体积变化情况 治疗组病人的甲状腺体积随着治疗时间增加明显缩小,在治疗3个月时与治疗前相比就有显著性差异(P<0.01),停止治疗一年内甲状腺未见明显增大。对照组病人的甲状腺体积亦有缩小,但与治疗前相比无显著性差异(见表3)。2.5 停药两年复发情况 经过2年的治疗,停药2年内追踪随访,观察复发情况,治疗组只有21%再次复发,而对照组的复发率高达70%。
2.6 ADRs发生情况 治疗期间病人的肝、肾功能,血、尿常规检查,血红蛋白、红细胞数和血小板计数均无明显变化,未发生消化性溃疡、骨质疏松、肥胖、多毛等糖皮质激素副反应,以及出血,喉返神经、喉上神经以及周围其他组织损伤等严重ADRs。
表1 两组病人治疗前后甲状腺功能的变化Table 1 The changes in thyroid function both before and after treatment in the two groups(±s)
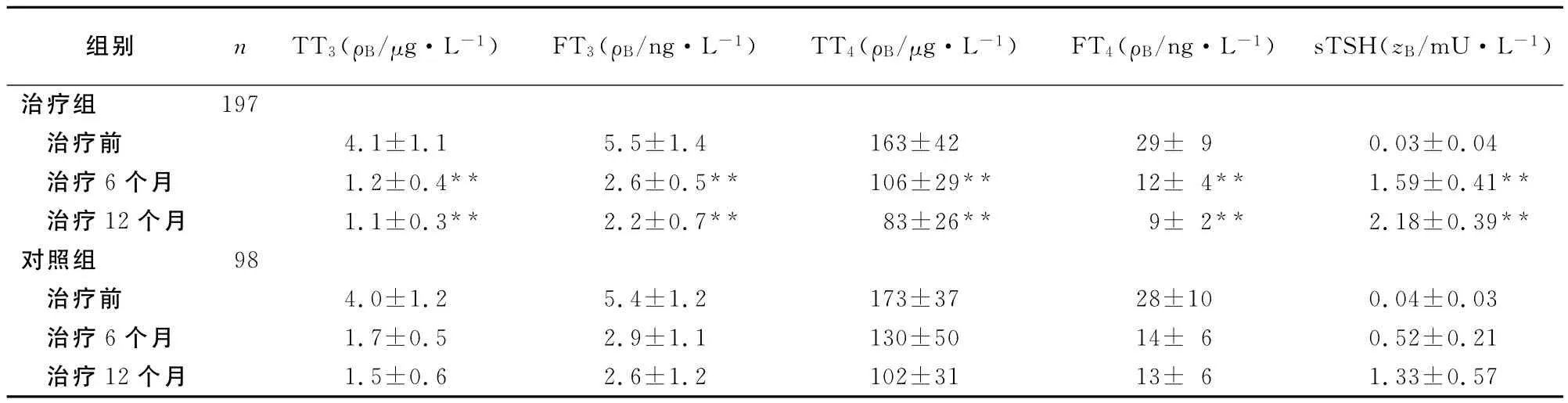
表1 两组病人治疗前后甲状腺功能的变化Table 1 The changes in thyroid function both before and after treatment in the two groups(±s)
**P<0.01,与对照组相同时间点比较;TT3:总三碘甲状腺原氨酸;FT3:游离三碘甲状腺原氨酸;TT4:总甲状腺素;FT4:游离甲状腺素;sTSH:超敏促甲状腺激素
组别 n TT3(ρB/μg·L-1) FT3(ρB/ng·L-1) TT4(ρB/μg·L-1) FT4(ρB/ng·L-1)sTSH(zB/mU·L-1)1.5±0.6 2.6±1.2 102±31 13±6 1.33±0.57 197治疗前 4.1±1.1 5.5±1.4 163±42 29±9 0.03±0.04治疗6个月 1.2±0.4** 2.6±0.5** 106±29** 12±4** 1.59±0.41**治疗12个月 1.1±0.3** 2.2±0.7** 83±26** 9±2** 2.18±0.39**对照组 98治疗前 4.0±1.2 5.4±1.2 173±37 28±10 0.04±0.03治疗6个月 1.7±0.5 2.9±1.1 130±50 14±6 0.52±0.21治疗12个月治疗组
表2 两组病人治疗前后甲状腺相关抗体阳性率的变化Table 2 The changes in thyroid-related antibody positive rates both before and after treatment in the two groups(±s,%)

表2 两组病人治疗前后甲状腺相关抗体阳性率的变化Table 2 The changes in thyroid-related antibody positive rates both before and after treatment in the two groups(±s,%)
**P<0.01,与对照组比较;TGAb:甲状腺球蛋白抗体;TPOAb:甲状腺过氧化物酶抗体;TRAb:促甲状腺激素受体抗体
组别 n个月治疗组 197 65.6±7.2 20.7±9.5** 71.8±12.1 24.7±12.8** 75.6±9.9 31.3±12.5 TGAb治疗前 治疗6个月TPOAb治疗前 治疗6个月TRAb治疗前 治疗6**对照组 98 70.3±6.9 52.3±8.2 85.5±11.9 55.8±10.9 81.8±10.1 62.8±11.3
表3 两组病人治疗前后甲状腺体积的变化Table 3 The changes in thyroid sizes both before and after treatment in the two groups(±s,V/cm3)

表3 两组病人治疗前后甲状腺体积的变化Table 3 The changes in thyroid sizes both before and after treatment in the two groups(±s,V/cm3)
**P<0.01,***P<0.001,与对照组相同时间点比较;△△P<0.01,△△△P<0.001,与本组治疗前比较
组别 n 治疗前 治疗3个月 治疗6个月 治疗2年治疗组197 35.9± 8.1 21.3± 6.9**16.4± 7.8**△△7.9± 6.1***△△△98 35.7±7.8 28.7±9.2 25.6±8.2 20.9±8.5对照组
3 讨 论
Graves病以毒性弥漫性甲状腺肿伴甲亢为临床表现,目前认为其诱发始动原因是由于病人抑制性T细胞(Ts细胞)的免疫监护和调节功能有遗传性缺陷。当有外来精神创伤或感染时,体内免疫系统遭破坏,“禁株”细胞失控,导致产生甲状腺刺激球蛋白(TSI)的B淋巴细胞增生,功能变异,在Ts细胞的作用下分泌大量的TSI而致病[8]。
国内外有学者应用免疫抑制剂口服治疗甲亢,但因其治疗费用较昂贵以及ADRs较多,临床应用受到一定限制。糖皮质激素的抗炎和免疫抑制作用使其在自身免疫性甲状腺疾病的治疗中占有重要地位。地塞米松属于长效糖皮质激素,可以减轻免疫反应和炎症对甲状腺组织的损害,减少甲状腺组织破坏性抗体的产生及其对甲状腺滤泡的破坏,可诱导淋巴细胞DNA降解,抑制淋巴细胞的物质代谢,诱导淋巴细胞凋亡,从而防止或抑制细胞介导的免疫反应[6]。但口服糖皮质激素ADRs多,病人用药依从性差,临床中常不推荐为常规治疗方法。甲状腺局部注射糖皮质激素,病灶局部药物浓度高,作用强,避免了糖皮质激素全身用药的ADRs。环磷酰胺是目前应用的各种免疫抑制剂中作用最强的药物之一,能非特异性地杀伤抗原敏感小淋巴细胞,限制其转化为免疫母细胞,对受抗原刺激进入分裂期的B细胞和T细胞具有相等的作用,因此对体液免疫和细胞免疫均有抑制作用,也常用于自身免疫性甲状腺疾病的治疗[9]。甲亢的发病机制亦与多种细胞因子密切相关。既往研究单独应用奥曲肽治疗甲亢,取得一定疗效[10],但其单用剂量较大,ADRs明显,价格昂贵。将奥曲肽与免疫抑制剂合用,剂量减小,疗效提高,且ADRs发生率随用药剂量减小也随之降低。奥曲肽的生物学作用很广泛,局部应用治疗甲亢可能通过拮抗表皮生长因子(EGF)、胰岛素样生长因子-Ⅰ(IGF-Ⅰ)等对甲状腺组织的作用而使甲状腺进一步缩小,进而达到辅助治疗效果[11]。刘志民等[4,5]研究表明,甲状腺局部注射免疫抑制剂可提高甲亢的缓解率,降低其复发率。本研究观察了该疗法对复发性Graves病的疗效,是对既往研究的补充。
免疫抑制剂局部注射治疗复发性甲亢的疗效较肯定,药物直接集中作用于发病器官,剂量小,甲亢症状得以较快缓解,抗体大部分转阴,并可降低复发率,增加治愈率,治疗无明显毒副作用,未观察到严重并发症,且操作简便,病人痛苦小,可作为临床治疗Graves病以及甲亢术前准备或I131放疗前准备的另一有效方法,值得在临床广泛推广应用。目前,探索短疗程、高治愈率、低复发率且不以甲状腺功能减退症为代价的疗法是Graves病的主要研究方向,本课题组将进一步探索其最佳治疗方案。
[1] Weetman A P.Graves’disease[J].N Engl J Med,2000,343(17):1236-1248.
[2] Mazza E,Carlini M,Flecchia D,et al.Long-term follow-up of patients with hyperthyroidism due to Graves’disease treated with methimazole.Comparison of usual treatment schedule with drug discontinuation vs continuous treatment with low methimazole doses:a retrospective study[J].J Endocrinol Invest,2008,31(10):866-872.
[3] Chung Y J,Lee B W,Kim J Y,et al.Continued suppression of serum TSH level may be attributed to TSH receptor antibody activity as well as the severity of thyrotoxicosis and the time to recovery of thyroid hormone in treated euthyroid Graves’patients[J].Thyroid,2006,16(12):1251-1257.
[4] 刘志民,顾明君,邹俊杰,等.免疫抑制剂局部注射治疗弥漫性甲状腺肿伴甲亢的疗效观察[J].第二军医大学学报,2002,23(3):308-310.
Liu ZhiMin,Gu MingJun,Zou JunJie,et al.Topical intrathyroid injection of immunosuppressive agents in treatment of Graves’disease[J].Acad J Sec Mil Med Univ,2002,23(3):308-310.In Chinese with English abstract.
[5] 刘志民,顾明君,邹俊杰,等.免疫抑制剂等药物局部注射治疗甲状腺功能亢进的疗效及安全性研究[J].上海医学,2003,26(1):18-20.
Liu ZhiMin,Gu MingJun,Zou JunJie,et al.Investigation on the efficacy and safety of local intrathyroid injection of immunosurpressive agents in treatment of hyperthyroidism[J].Shanghai Med J,2003,26(1):18-20.In Chinese with English abstract.
[6] Pearce E N,Hennessey J V,McDermott M T.New American Thyroid Association and American Association of Clinical Endocrinologists guidelines for thyrotoxicosis and other forms of hyperthyroidism:significant progress for the clinician and a guide to future research[J].Thyroid,2011,21(6):573-576.
[7] 中华医学会内分泌学分会《中国甲状腺疾病诊治指南》编写组.中国甲状腺疾病诊治指南——甲状腺功能亢进症[J].中华内科杂志,2007,46(10):876-882.
Writing group of guidelines for diagnosis and treatment of thyroid diseases in China,Branch of Endocrinology,Chinese Medical Association.Guidelines for diagnosis and treatment of thyroid diseases:hyperthyroidism[J].Chin J Intern Med,2007,46(10):876-882.In Chinese.
[8] Matthews D C,Syed A A.The role of TSH receptor antibodies in the management of Graves’disease[J].Eur J Intern Med,2011,22(3):213-216.
[9] Grbovic L,Radenkovic M.Therapeutic use of glucocorticoids and immunosuppressive agents[J].Srp Arh Celok Lek,2005,133(Suppl 1):67-73.
[10] Iukina Glu,Nevorotin A I,Bykov V L.Ultrastructural and metabolic characteristics of the thyrocytes exposed to cyclophosphane[J].Morfologiia,2004,125(1):66-71.
[11] Ruggeri R M,Barresi G,Sciacchitano S,et al.Immunoexpression of the CD30ligand/CD30and IL-6/IL-6Rsignals in thyroid autoimmune diseases[J].Histol Histopathol,2006,21(3):249-256.

