干旱胁迫对3种金银花叶绿素荧光参数的影响
刘志梅,蒋文伟,杨广远,黄建荣
(1.浙江农林大学 风景园林与建筑学院,浙江 临安 311300;2.上房园艺有限公司,上海 201114)
干旱是影响植物生长和发育的主要环境因子之一,干旱胁迫可以导致植物光合器官受损,从而使光合作用受到抑制[1]。叶绿素荧光是研究光合作用机制和探测光合生理状况的一种新兴技术,与反映 “表观性”的气体交换指标相比,叶绿素荧光参数具有反映 “内在性”的特点,是研究植物光合生理与逆境胁迫的内在探针[2]。金银花为忍冬科Caprifoliaceae忍冬属Lonicera多年生半常绿藤本植物,不仅具有较高的药用价值和经济价值,而且也是园林绿化中的重要攀缘植物。目前,一些学者研究了干旱胁迫和盐胁迫对金银花的光合作用及光合色素含量的影响[3-4],但尚未见到干旱胁迫下对金银花叶片叶绿素荧光参数影响的报道。本试验以3种金银花1年生扦插苗为试材,应用叶绿素荧光技术,研究不同干旱胁迫处理下金银花叶片相关荧光参数的变化,旨在探讨干旱胁迫对金银花的影响,为今后金银花的栽培应用及优良品种选育奠定基础。
1 材料与方法
1.1 试验材料
供试的材料为上房园艺有限公司提供的3种金银花的1年生扦插苗,分别为红花金银花Lonicera japonica ‘Chinensis’,台尔曼忍冬Lonicera×tellmanniana以及京红久忍冬Lonicera×heckrottii。于2011年4月下旬开始进行盆栽试验,将园土与含泥炭土、木质泥炭、椰壳粉、蛭石、珍珠石及有机质肥料的基质按1∶1比例混合,装入内径为18 cm的花盆中,选择长势良好、大小基本一致的金银花扦插苗移入盆内,1株·盆-1,常规管理。
1.2 干旱胁迫处理方法
2011年7月在浙江农林大学风景园林与建筑学院温室内进行人工干旱处理,设4个处理:对照(ck)处理,每天正常地进行水分管理,土壤相对含水量为32%左右;轻度干旱处理,土壤持续干旱5 d,土壤相对含水量为25%左右;中度干旱处理,土壤持续干旱10 d,土壤相对含水量为18%左右;重度干旱处理,土壤持续干旱20 d,土壤相对含水量为7%左右,重复3次·处理-1,3盆·重复-1。
1.3 叶绿素荧光参数测定
于2011年7月26日光照充足的上午9:00-11:00,采用德国WALZ生产的便携式调制叶绿素荧光仪PAM-2100对叶片进行活体测定。测定时,先将叶片置于暗中适应20 min,之后照射测量光(<0.5μmol·m-2·s-1)测定初始荧光(F0), 然后照射饱和脉冲(2800.0μmol·m-2·s-1)测定最大荧光(Fm)。 接着打开内源光化光(600.0μmol·m-2·s-1), 持续 5 min后测定光适应下的稳定态荧光(Ft), 隔 20 s打开饱和脉冲(2800.0μmol·m-2·s-1)测定光适应下的最大荧光(Fm′)[5]。 根据所测定的参数计算光系统Ⅱ(PSⅡ)潜在光化学效率(Fv/F0)=(Fm-F0)/F0,PSⅡ最大光化学效率(Fv/Fm)=(Fm-F0)/Fm,PSⅡ光化学量子产量, 表观光合电子传递速率 ETR=y×PAR(光合有效辐射)×0.50×0.84,光化学猝灭系数-F0), 非光化学猝灭系数 qN=(Fm-Fm′)/(Fm-F0)。
1.4 数据统计分析
采用Excel 2003和SPSS 11.5软件进行数据处理和统计分析,采用Sigma Plot 10.0软件绘图。
2 结果与分析
2.1 干旱胁迫对3种金银花叶片初始荧光(F0)和最大荧光(Fm)的影响

图1 不同干旱胁迫下3种金银花叶片F0和Fm的变化Figure1 Change of F0and Fmin leaves of three plants of Lonicera under different drought stress
初始荧光(F0),也称基础荧光,是光系统Ⅱ(PSⅡ)反应中心处于完全开放时的荧光产量。对不同干旱胁迫处理下叶片初始荧光测定分析表明(图1A):3种金银花叶片初始荧光变化趋势相同,均随胁迫程度的加剧呈现出上升的趋势。与对照相比,红花金银花在重度干旱胁迫时叶片初始荧光显著升高(P<0.05),且比对照高10.5%;而台尔曼忍冬在不同干旱胁迫处理时叶片初始荧光均显著升高(P<0.05),且重度干旱胁迫时,台尔曼忍冬叶片初始荧光比对照高15.0%;除轻度干旱胁迫外,与对照相比,京红久忍冬叶片初始荧光均显著升高(P<0.05),且重度干旱胁迫时,京红久忍冬叶片初始荧光比对照高10.9%。
最大荧光(Fm),是光系统Ⅱ(PSⅡ)反应中心处于完全关闭时的荧光产量,可反映通过PSⅡ的电子传递情况[2]。对不同干旱胁迫处理下金银花叶片最大荧光测定分析表明(图1B):3种金银花叶片最大荧光具有相同的变化趋势,都随胁迫程度的加剧而下降,且各处理与对照间均存在显著的差异 (P<0.05)。重度干旱胁迫时,3种金银花的最大荧光明显小于对照,其中,红花金银花叶片最大荧光比对照低26.3%,台尔曼忍冬叶片最大荧光比对照低26.8%,京红久忍冬叶片最大荧光为比对照低26.5%。
2.2 干旱胁迫对3种金银花叶片潜在光化学效率(Fv/F0)和最大光化学效率(Fv/Fm)的影响
潜在光化学效率(Fv/F0)表示光反应中心PSⅡ的潜在活性。最大光化学效率(Fv/Fm)反映PSⅡ反应中心内原初光能转化效率,表明PSⅡ利用光能的能力[6]。正常生理状态下,植物叶片荧光参数最大光化学效率极少变化,而受到光抑制和环境胁迫时,最大光化学效率明显下降[7]。对不同干旱胁迫处理下叶片最大光化学效率和潜在光化学效率测定分析表明(图2):3种金银花叶片最大光化学效率和潜在光化学效率的变化趋势相同,均随胁迫程度的增加而降低。与对照(ck)相比,3种金银花叶片潜在光化学效率有显著下降(P<0.05),且重度干旱胁迫时,红花金银花、台尔曼忍冬、京红久忍冬潜在光化学效率值比对照分别下降了40.5%,43.9%和40.4%。除红花金银花外,轻度干旱胁迫时,其他2种植物的最大光化学效率与对照相比均有显著下降(P<0.05),说明在轻度干旱胁迫时,红花金银花的原初光能转换效率几乎没有受到影响。中度干旱胁迫和重度干旱胁迫时,与对照相比,3种金银花叶片最大光化学效率显著降低(P<0.05),且重度干旱胁迫时,红花金银花、台尔曼忍冬、京红久忍冬最大光化学效率值比对照分别下降了10.2%,11.5%和10.5%。
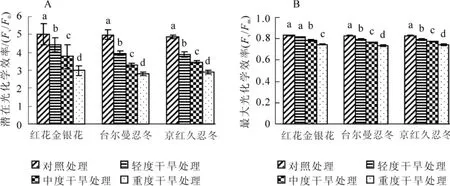
图2 不同干旱胁迫下3种金银花叶片潜在光化学效率(Fv/F0)和最大光化学效率(Fv/Fm)的变化Figure2 Change of Fv/F0and Fv/Fmin leaves of three plants of Lonicera under different drought stress
2.3 干旱胁迫对3种金银花叶片光化学量子产量(y)和表观光合电子传递速率(ETR)的影响
光化学量子产量(y)反映了光系统Ⅱ(PSⅡ)反应中心在有部分关闭情况下的实际原初光能捕获效率,可作为植物光合电子传递速率快慢的指标[8]。表观光合电子传递速率(ETR)反映实际光强条件下的表观电子传递效率。对不同干旱胁迫处理下金银花叶片光化学量子产量和表观光合电子传递速率测定分析表明(图3):3种金银花的y变化趋势相同,都随胁迫程度的加剧而降低,且3种金银花叶片ETR的变化和y的变化相一致,均随胁迫程度的增加,呈现出逐渐下降的趋势。与对照相比,3种金银花叶片光化学量子产量和表观光合电子传递速率都有显著的下降(P<0.05),且重度干旱胁迫时,与对照相比,红花金银花、台尔曼忍冬、京红久忍冬光化学量子产量值分别下降了49.1%,56.8%和49.6%,而表观光合电子传递速率分别下降了39.7%,48.6%和40.1%。说明干旱胁迫导致了3种金银花叶片光合电子传递过程遭到损伤或抑制,光化学量子产量和光合电子传递速率下降,但是红花金银花和京红久忍冬的下降幅度比较小,说明其光合电子传递过程受到的破坏较轻,表现出较强的抗旱性;与之相反,台尔曼忍冬的降幅比较大,说明其适应干旱环境的能力较差,表现出较差的抗旱性。
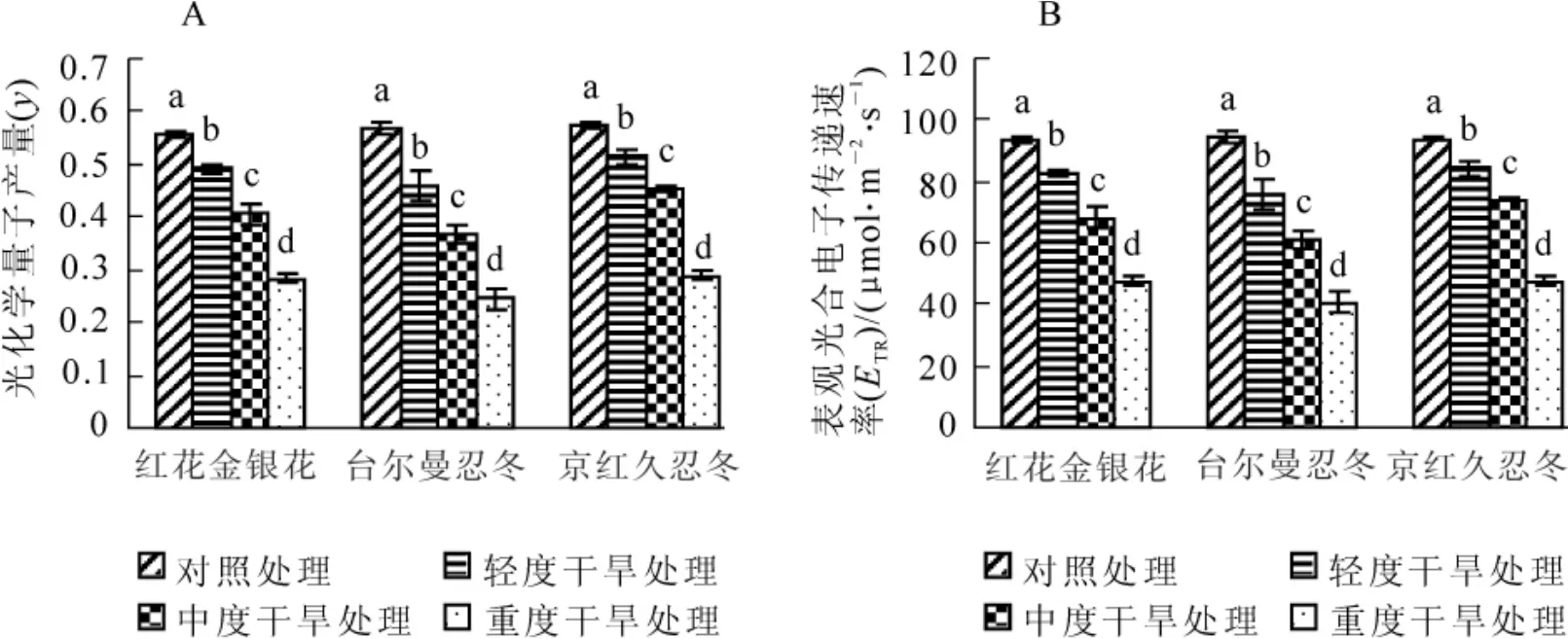
图3 不同干旱胁迫下3种金银花叶片光化学量子产量(y)和表观光合电子传递速率(ETR)的变化Figure3 Change of y and ETRin leaves of three plants of Lonicera under different drought stress
2.4 干旱胁迫对3种金银花叶片光化学淬灭系数和非光化学淬灭系数(qN)的影响
光化学淬灭系数(qP)表示光系统Ⅱ(PSⅡ)反应中心天线色素吸收的光能用于光化学电子转递的份额,其值越大,说明PSⅡ的电子传递活性越高[9]。光化学淬灭系数同时反映了PSⅡ反应中心的开放程度,其值越大,PSⅡ反应中心开放部分的比例就越高,天线色素所吸收的光能就能以更高的比例推动光合电子传递,从而提高PSⅡ的电子传递能力[10]。对不同干旱胁迫处理下金银花叶片光化学淬灭系数测定分析表明(图4A):随着干旱胁迫程度的增加,3种金银花叶片光化学淬灭系数都表现出下降的趋势。轻度干旱胁迫时,3种金银花叶片光化学淬灭系数虽有所降低,但与对照间差异不显著(P<0.05),说明金银花各品种在轻度干旱胁迫时光化学淬灭系数受到的影响较小,PSⅡ仍能维持较高的光合电子传递活性。重度干旱胁迫时,金银花的光化学淬灭系数明显降低(P<0.05),且与对照相比,红花金银花、台尔曼忍冬和京红久忍冬分别下降了16.7%,22.1%和20.3%。
非光化学淬灭反映了PSⅡ反应中心天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分,其热耗散能力可用非光化学淬灭系数(qN)表示[11]。非光化学碎灭是一种自我保护机制,PSⅡ反应中心通过提高非辐射性热耗散,可以消耗PSⅡ吸收的过量的光能,从而保护PSⅡ反应中心免受因天线色素吸收过多光能而引起光合器官的破坏或损伤[9]。对不同干旱胁迫处理下金银花叶片非光化学淬灭系数测定分析表明(图4B):随着干旱胁迫程度的增加,3种金银花叶片非光化学淬灭系数值均呈现出逐渐上升的趋势,说明在干旱胁迫下,金银花各品种PSⅡ反应中心潜在热耗散能力增强,从而避免因PSⅡ吸收过量光能而引起光合器官的损伤。轻度干旱胁迫时,除红花金银花外,其他2种的非光化学淬灭系数与对照间无明显差异(P<0.05),但重度干旱胁迫时,3种金银花的非光化学淬灭系数均显著增大(P<0.05),且与对照相比,红花金银花、台尔曼忍冬和京红久忍冬的非光化学淬灭系数值分别上升了13.9%,20.2%和18.4%。
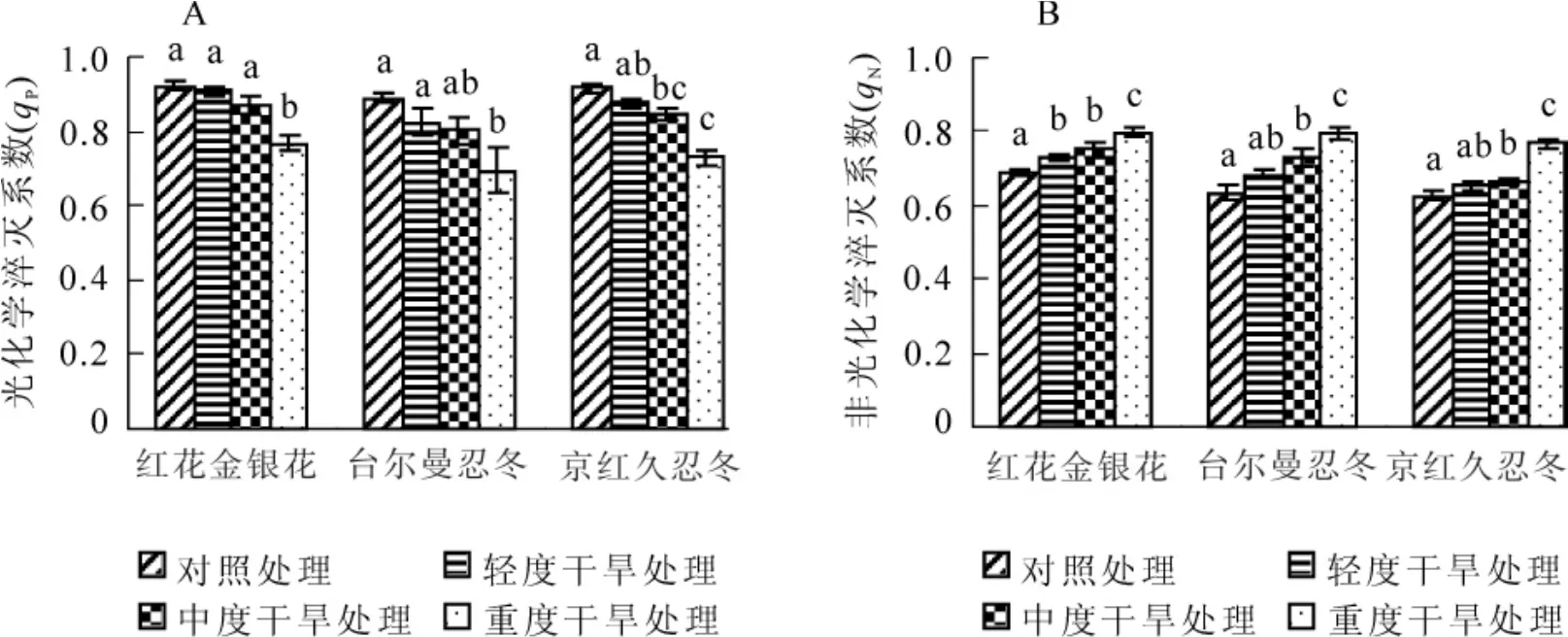
图4 不同干旱胁迫下3种金银花叶片光化学淬灭系数(qP)和非光化学淬灭系数(qN)的变化Figure4 Change of qPand qNin leaves of three plants of Lonicera under different drought stress
3 结论与讨论
叶绿素荧光诱导动力学参数可以快速、灵敏、无损伤地研究和探测干旱胁迫对植物光合作用影响[8,12-13]。已有研究证明:干旱胁迫处理导致辣椒Capsicum annuum叶片初始荧光呈现上升趋势,而光化学量子产量和最大光化学效率均呈现下降趋势[14];随干旱胁迫程度的加剧,毛竹Phyllostachys edulis幼苗叶片初始荧光表现出不断增加的趋势,而最大荧光、光化学量子产量、最大光化学效率呈逐渐降低的趋势[15];胡杨Populus euphratica叶片最大光化学效率、潜在光化学效率、光化学量子产量和表观光合电子传递速率均随着干旱胁迫的降低而呈现出上升的趋势[16]。本试验的研究结果表明:在干旱胁迫处理下,随着干旱胁迫程度的增加,3种金银花叶片初始荧光呈逐渐上升的趋势,而最大荧光、最大光化学效率、潜在光化学效率、光化学量子产量和表观光合电子传递速率呈逐渐下降的趋势,这与对辣椒、毛竹和胡杨Populus euphratica的研究结果相同。说明干旱胁迫使3种金银花PSⅡ反应中心出现可逆的失活或受到了不易逆转的破坏[17],抑制了PSⅡ光化学活性,降低了PSⅡ原初光能转化效率,使PSⅡ潜在活性受损,破坏了金银花的光合作用原初反应过程[11]。
光化学淬灭系数反映了PSⅡ反应中心的开放程度,而非光化学淬灭系数是保护PSⅡ反应中心免受因天线色素吸收过多光能而引起光合机构损伤的一种自我保护机制。也有研究表明:植物受到逆境胁迫时,可以通过启动叶黄素循环来消耗过多的光能[18],而非光化学淬灭系数与叶黄素循环中A+Z的含量呈线性关系[19],因此,非光化学淬灭系数值的增大可以说明PSⅡ反应中心耗散过多光能的能力增强。本试验中,随干旱胁迫程度的增加,金银花光化学淬灭系数逐渐下降,说明干旱胁迫导致了金银花叶片PSⅡ反应中心开放程度的比例的降低,从而使金银花叶片光合电子传递速率下降,PSⅡ天线色素捕获的光能用于光化学电子传递的份额减少,PSⅡ反应中心的光能累积过剩,但金银花叶片非光化学淬灭系数随干旱胁迫程度的增加而增大,说明金银花叶片PSⅡ反应中心提高了非辐射性热耗散,从而及时地耗散了过多的光能,也可能是金银花叶片通过叶黄素循环的热耗散能力增大,及时地耗散了过量的光能,有效的保护了光合器官。
有研究表明:叶绿素荧光参数的变化规律与植物的抗旱性存在着密切的关系,最大光化学效率、潜在光化学效率、光化学量子产量、光化学淬灭系数和非光化学淬灭系数可以作为鉴定植物抗旱性的相对指标[9,20-21]。本研究中,轻度干旱胁迫时,3种金银花各参数的变化幅度都较小,而重度干旱胁迫时,与对照相比,各参数的变化幅度均显著增加。其中,红花金银花各参数的变化幅度最小,京红久忍冬居中,台尔曼忍冬各参数的变化幅度最大,故红花金银花的抗旱性较强,京红久忍冬次之,台尔曼忍冬相对较弱。
[1]范苏鲁,苑兆和,冯立娟,等.水分胁迫下大丽花光合及叶绿素荧光的日变化特性[J].西北植物学报,2011,31(6): 1223-1228.FAN Sulu, YUAN Zhaohe, FENG Lijuan, et al.Daily variation characteristics of photosynthesis and chlorophyll fluorescence in Dahlia leaves under water stress [J].Acta Bot Boreali-Occident Sin, 2011, 31 (6): 1223-1228.
[2]吴甘霖,段仁燕,王志高,等.干旱和复水对草莓叶片叶绿素荧光特性的影响[J].生态学报,2010,30(14):3941-3946.WU Ganlin,DUAN Renyan, WANG Zhigao, et al.Effects of drought stress and rehydration on chlorophyll fluorescence characteristics in Fragaria × ananassa Duch [J].Acta Ecol Sin, 2010, 30 (14):3941-3946.
[3]彭素琴,刘郁林.不同品种金银花光合作用对干旱胁迫的响应[J].北方园艺,2010(19):191-193.PENG Suqin,LIU Yulin.The response of photosynthesis to drought stress in different varieties of Lonicera japonica Thunb.[J].North Hortic, 2010 (19): 191-193.
[4]鲍雅静,季静,杨晓慧,等.NaCl胁迫对金银花叶片光合色素含量的影响[J].安徽农业科学,2007,35(21):6366-6367,6382.BAO Yajing, JI Jing, YANG Xiaohui, et al.Effect of NaCl stress on the content of photosynthetic pigment in the leaf of Lonicera japonica [J].J Anhui Agric Sci, 2007, 35 (21):6366-6367, 6382.
[5]陶文文,蒋文伟,赵丽娟.3个钓钟柳品种叶绿素荧光特性比较[J].浙江农林大学学报,2011,28(3):367-371.TAO Wenwen, JIANG Wenwei, ZHAO Lijuan.Chlorophyll fluorescence parameters in three cultivars of Penstemon[J].J Zhejiang A & F Univ, 2011, 28 (3): 367-371.
[6]史胜青,袁玉欣,张金香,等.不同水分胁迫方式对核桃苗叶绿素荧光动力学特性的影响[J].河北农业大学学报, 2003, 26 (2): 20-24.SHI Shengqing, YUAN Yuxin, ZHANG Jinxiang, et al.Effects of water stress on characteristics of chlorophyll fluorescence in Juglans regia [J].J Hebei Agric Univ, 2003, 26 (2):20-24.
[7]刘昊,余树全,江洪,等.模拟酸雨对山核桃叶绿素荧光参数、叶绿素和生长的影响[J].浙江林学院学报,2009,26(1): 32-37.LIU Hao, YU Shuquan, JIANG Hong, et al.Chlorophyll fluorescence of Carya cathayensis with simulated acid rain[J].J Zhejiang For Coll, 2009, 26 (1): 32-37.
[8]孙志勇,季孔庶.干旱胁迫对4个杂交鹅掌揪无性系叶绿素荧光特性的影响[J].西北林学院学报,2010,25(4):35-39.SUN Zhiyong, JI Kongshu.Effects of drought stress on chlorophyll fluorescence of four hybrid tulip clones [J].J Northwest For Univ, 2010, 25 (4): 35-39.
[9]史胜青,袁玉欣,杨敏生,等.水分胁迫对4种苗木叶绿素荧光的光化学淬灭和非光化学淬灭的影响[J].林业科学, 2004, 40 (1): 168-173.SHI Shengqing, YUAN Yuxin, YANG Minsheng, et al.Effects of water stress on photochemical quenching and nonphotochemical quenching of chlorophyll a fluorescence in four tree seedlings [J].Sci Silv Sin, 2004, 40 (1): 168-173.
[10]张杰,邹学忠,杨传平,等.不同蒙古栎种源的叶绿素荧光特性[J].东北林业大学学报,2005,33(3):20-21.ZHANG Jie, ZOU Xuezhong, YANG Chuanping, et al.The chlorophyll fluorescence characteristic of Quercus mongolica from different provenance [J].J Northeast For Univ, 2005, 33 (3): 20-21.
[11]杨玉珍,陈刚,彭方仁.干旱胁迫对不同种源香椿主要叶绿素荧光参数的影响[J].东北林业大学学报,2010,38(7): 49-51.YANG Yuzhen, CHEN Gang, PENG Fangren.Effects of drought stress on chlorophyll fluorescence parameters in seedlings of different Toona sinensis provenances [J].J Northeast For Univ, 2010, 38 (7): 49-51.
[12]张秋英,李发东,高克昌,等.水分胁迫对冬小麦光合特性及产量的影响[J].西北植物学报,2005,25(6):1184-1190.ZHANG Qiuying, LI Fadong, GAO Kechang, et al.Effect of water stress on the photosynthetic capabilities and yield of winter wheat[J].Acta Bot Boreali-Occident Sin, 2005, 25 (6): 1184-1190.
[13]毕建杰,刘建栋,叶宝兴,等.干旱胁迫对夏玉米叶片光合及叶绿素荧光的影响[J].气象与环境科学,2008,31(1): 10-15.BI Jianjie, LIU Jiandong, YE Baoxing, et al.Effects of drought stress on photosynthesis and chlorophyll fluorescence of the summer maize leaf[J].Meteoro&Environ Sci, 2008, 31 (1):10-15.
[14]胡文海,曾建军,曹玉林,等.干旱胁迫对2种辣椒叶片气体交换和叶绿素荧光特性的影响[J].干旱地区农业研究, 2008, 26 (5): 156-159.HU Wenhai, ZENG Jianjun, CAO Yulin, et al.Effects of drought stress on gas exchange and chlorophyll fluorescence characteristics in leaves of two pepper (Capsicum annuum L.) varieties [J].Agric Res Arid Areas, 2008, 26(5):156-159.
[15]应叶青,郭璟,魏建芬,等.水分胁迫下毛竹幼苗光合及叶绿素荧光特性的响应[J].北京林业大学学报,2009, 31 (6): 128-133.YING Yeqing, GUO Jing, WEI Jianfen, et al.Photosynthetic and chlorophyll fluorescent responses of Phyllostachys pubescens seedlings to water deficiency stress [J].J Beijing For Univ, 2009, 31 (6): 128-133.
[16]周朝彬,宋于洋,王炳举,等.干旱胁迫对胡杨光合和叶绿素荧光参数的影响[J].西北林学院学报,2009,24(4): 5-9.ZHOU Chaobin, SONG Yuyang, WANG Bingju, et al.Effects of drought stress on photosynthesis and chlorophyll fluorescence parameters of Populus euphratica [J].J Northwest For Univ, 2009, 24 (4):5-9.
[17]宋莉英,孙兰兰,舒展,等.干旱和复水对入侵植物三裂叶蟛蜞菊叶片叶绿素荧光特性的影响[J].生态学报,2009, 29 (7): 3713-3719.SONG Liying, SUN Lanlan, SHU Zhan, et al.Effects of drought stress and rehydration on chlorophyll fluorescence characteristics in leaves of invasive Wedelia trilobata [J].Acta Ecol Sin, 2009, 29 (7): 3713-3719.
[18]CASER C, EICKMEIER W G, OSMOND C B.Changes of fluorescence and xanthophylls pigments during rehydration in the resurrection plant Selaginessa lepidophylla in low and medium light intensities [J].Oecolgia, 1993, 94:528-533.
[19]吴长艾,孟庆伟,邹琦.叶黄素循环及其调控[J].植物生理学通讯,2001,37(1):1-5.WU Changai, MENG Qingwei, ZOU Qi.The xanthophyll cycle and its regulation [J].Plant Phys Commun, 2001, 37(1): 1-5.
[20]徐建伟,席万鹏,方憬军,等.水分胁迫对葡萄叶绿素荧光参数的影响[J].西北农业学报,2007,16(5):175-179.XU Jianwei, XI Wanpeng, FANG Jingjun, et al.Effects of different water stress on grape chlorophyll fluorescence parameters [J].Acta Agric Boreali-Occident Sin, 2007, 16 (5): 175-179.
[21]张亚娟,谢忠奎,赵学勇,等.水分胁迫对东方百合光合特性、叶绿素荧光参数及干物质积累的影响[J].中国沙漠, 2011, 31(4): 884-888.ZHANG Yajuan, XIE Zhongkui, ZHAO Xueyong, et al.Effects of water stress on photosynthetic characteristics,chlorophyll fluorescence, and dry matter of oriental lilies [J].J Desert Res, 2011, 31 (4): 884-888.

