雷帕霉素对大鼠缺血再灌注肾细胞凋亡和P53蛋白表达的影响
郑传东 苟 欣 张 力 胡兴平
1.成都市第五人民医院泌尿外科,四川成都 611130;2.重庆医科大学附属第一医院泌尿外科,重庆 400016
雷帕霉素(RPM)是放线菌培养液中分离的大环内酯类抗生素,是一种强有力的免疫抑制剂,已应用于肾移植中[1]。肾移植失败的重要因素之一是肾缺血再灌注导致了严重的肾小管损伤。目前有研究表明,缺血再灌注导致肾损害的重要环节是细胞发生了凋亡[2]。降低肾缺血再灌注中细胞凋亡的发生对肾损伤的防治有显著的临床意义。有研究表明,细胞凋亡能被雷帕霉素抑制[3],促凋亡相关基因中P53是重要的因素之一[2]。本实验建立肾缺血再灌注大鼠模型,探讨雷帕霉素对大鼠缺血再灌注注损伤的疗效及对P53表达的影响。
1 资料与方法
1.1 主要试验药物和试剂
TUNEL试剂盒购自Roche公司;兔多抗P53,SA1022,DAB显色液均购自武汉博士德公司;RPM购自华北制药集团新药研究开发有限责任公司,RPM 批准文号2002HL0259,每毫升含RPM 1 mg。
1.2 试验动物和分组
54只8~9周的Wistar雄性大鼠,购自重庆医科大学实验动物中心(合格证号:检动字2002A040)。随机分成假手术(sham)组、手术(IR)组和药物(RPM+IR)组。再灌注后以0、24、48、72 h为4个观察时相(每个观察时相6只)。
l.3 动物模型的建立及用药
大鼠肾模型的建立[4]:给予10%水合氯醛(3 mL/kg)腹腔注射,皮肤消毒。腹部正切口,切除右肾,分离左肾动脉,无损伤动脉夹夹闭,肾脏血流阻断以肾脏颜色发白即可确认,缺血45 min后,松开动脉夹,肾脏血流恢复,肾脏由苍白变为红润可确认。假手术组只分离左肾动脉,不夹闭。假手术组、手术组以等量生理盐水代替药物,以做阴性对照,药物组于术前灌胃给药RPM 4 mg(/kg·d)×3 d,术日术前2 h灌胃,术后给药至0、24、48、72 h 各个观察时相。
l.4 HE染色组织学观察
肾标本予4%的多聚甲醛固定,石蜡处理,制成3 μm厚的石蜡切片,HE染色切片后,光镜观察各组的各时相肾脏切片。
l.5 细胞凋亡率检测
二甲苯进行各组各时相肾脏石蜡切片脱蜡至水,TUNEL试剂盒测定凋亡率,进行脱水、透明、封片。光镜下观察,棕黄色细胞核的细胞为凋亡细胞,切片各随机选择10个无重叠视野于分析仪(Noesis S.A.Frence)200倍光镜下,测定阳性染色平均光密度MOD及阳性染色面积率,计算细胞凋亡指数(apoptotic index,AI):AI(%)= MOD× 阳性表达面积率×100%。
l.6 免疫组化检测P53
进行三组的各时相肾脏石蜡切片脱蜡至水,按兔SABC法免疫组化试剂盒操作,切片各随机选择10个无重叠视野(×400),予医学图像分析系统处理。阳性细胞率=阳性细胞数/视野所有细胞总数×100%,计数阳性细胞数及细胞总数,各计数100个细胞,检测P53表达的平均光密度值MOD,计算P53阳性表达指数=MOD×阳性细胞率×100%。
1.7 统计学处理
采用SPSS13.00软件,数据均以(x ± s)表示,多组间均数比较,采用单因素方差分析,以P<0.05为有统计学意义。
2 结果
2.1 建模成功后各组肾脏形态学变化
肉眼下:假手术组正常;药物组轻度淤血和水肿;手术组严重淤血、水肿,髓质明显变苍白。光镜下:假手术组各组无病理改变。手术组再灌注不同时间的肾脏病理改变各不相同。0 h组:肾脏正常。24 h组:肾小管腔被大量坏死细胞残留物质堵塞,肾小管的结构轮廓尚见,大量肾小管上皮细胞呈空泡样肿胀,部分坏死脱落,基底膜仅剩轮廓。48 h组:肾小管开始修复,肾小管中坏死的堵塞物质明显减少。72 h组:部分肾小管结构完全修复,管腔干净,通畅,坏死物质极少。光镜下,手术组各个时相的病变均较药物组严重,药物组肾小管上皮细胞仅呈空泡样肿胀、少许颗粒样变性,无坏死,间质无异常。见图1~2。
2.2 细胞凋亡率检测
TUNEL阳性细胞的细胞质无染色,细胞核黄褐色。肾小球阴性表达;肾小管阳性表达,髓质明显。见图3~4。图像分析阳性表达后。见表1。假手术组呈极弱阳性表达;手术组的细胞阳性率明显增加(P<0.05);药物组的细胞阳性率相对手术组显著减少(P<0.05)。
2.3 P53蛋白的表达
P53阳性细胞细胞质无染色,细胞核黄褐色,肾小球阴性表达;肾小管阳性表达,髓质明显。见图5~6。图像分析阳性表达后。见表1。假手术组呈极弱阳性表达;手术组的细胞阳性率明显增加(P<0.05);药物组的细胞阳性率相对手术组显著减少(P<0.05)。
3 讨论
3.1 细胞凋亡和肾脏缺血再灌注损伤关系
在动物实验中发现,肾小管上皮细胞凋亡在肾脏缺血再灌注损伤中会大量出现[5],对移植后的尸体肾活检,发现了同样的情况[6],而且供肾冷缺血时间与细胞凋亡和缺血再灌注损伤呈正相关[7]。肾脏缺血再灌注损伤后细胞凋亡的机制极其复杂,氧自由基[8]、钙离子超载[9-10]、炎性因子和炎症介质[11]、与凋亡相关的基因,是多因素协同的病理生理过程。目前观点认为,根据激活的半胱天冬酶种类不同分为“外在”通路和“内在”通路[12]。亦即传统的死亡受体凋亡通路和线粒体凋亡通路。本实验与手术组比较,药物组细胞凋亡率显著下降(P<0.05),说明雷帕霉素能明显控制肾脏缺血再灌注中细胞凋亡的发生的作用。
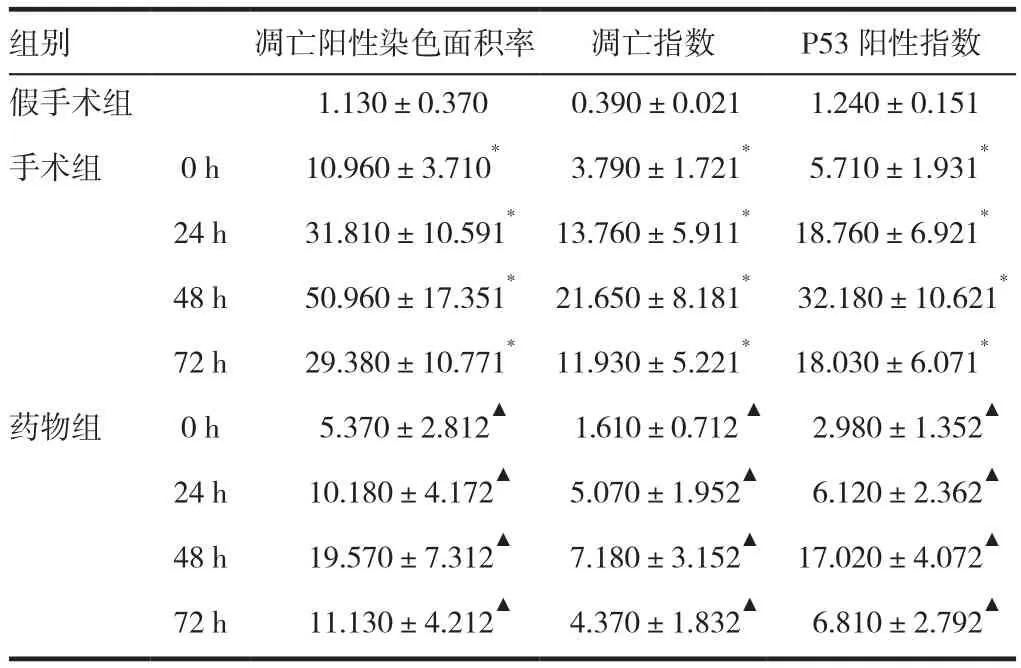
表1 TUNEL法测定肾缺血再灌注后大鼠肾小管上皮细胞凋亡结果及P53阳性细胞率(n=6,x ± s,%)

图1 手术组24 h的肾组织HE染色(SABC×400)

图2 药物组24 h的肾组织HE染色(SABC×400)

图3 手术组48 h的肾组织凋亡(SABC×400)

图4 药物组48 h 的肾组织凋亡(SABC×400)

图5 P53在手术组72 h的肾组织的表达(SABC×400)
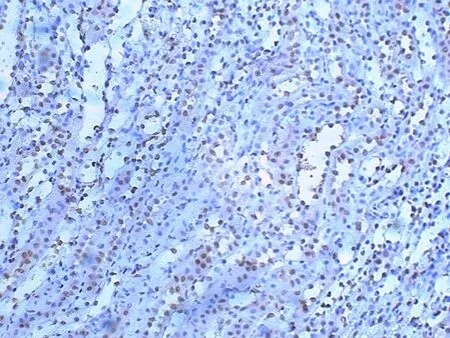
图6 P53在药物组72 h的肾组 织的表达(SABC×400)
3.2 P53在肾缺血再灌注中的作用
P53介导的线粒体凋亡通路:P53蛋白激活靶基因Bax,形成Bax-Bax二聚体,释放细胞色素C和胞质内的ATP,导致caspase-9裂解caspase-3,出现细胞凋亡。P53介导的死亡受体凋亡通路:P53诱导Fas激活caspase-8,导致caspase的裂解,细胞凋亡。实验表明:与手术组比较,药物组P53表达强度明显减弱(P<0.05),提示雷帕霉素能降低P53表达,抑制线粒体凋亡和死亡受体凋亡通路两条途径,抑制细胞凋亡的发生。
3.3 雷帕霉素作用的可能机制
RPM在结构上与FK506极为相似,FK506为钙调神经素抑制剂类免疫抑制剂,而RPM为具有不同作用机制的增殖信号抑制剂(proliferation signal inhibitors,PSI)类免疫抑制剂[13]。研究发现,RPM通过非直接通路使激活的T细胞凋亡,阻止树突状细胞抗原呈递,抑制其成熟,减少细胞因子的分泌[14]。阻止树突状细胞在肾组织迁移聚集,改善大鼠缺血再灌注肾组织的病理损伤及肾功能[15]。RPM抑制内皮细胞、平滑肌细胞和成纤维细胞等的增殖[16]。RPM可能是通过抑制细胞凋亡,抑制炎症,减少自由基的生成,抑制T细胞、T细胞依赖性B细胞、树突状细胞的活性,减少细胞因子的分泌;抑制平滑肌细胞、内皮细胞和成纤维细胞等的增殖改善肾脏微循环等多种途经减轻肾组织损伤。RPM已应用于临床器官移植中抗急、慢性排斥反应。此实验表明:给药RPM后,P53蛋白表达水平降低,细胞凋亡损害明显降低,降低缺血再灌注造成的肾组织损伤,在临床预防和减轻肾缺血再灌注损伤有很好的运用前景。
[1] Kuypers DR.Benefit-risk assessment of sirolimus in renal transplantation[J].Drug Saf,2005,28(2):153-181.
[2] 吴其夏,余应年,卢建.病理生理学[M].第2版.北京:中国协和医科大学出版社,2003:271-296.
[3] 何小玲,逯宁,刘彤,等.雷帕霉素和中药百令胶囊对大鼠小肠移植后细胞凋亡和FasL mRNA表达作用[J].中国中西医结合外科杂志,2001,7(2):102-105.
[4] 张世卿,苟欣, 李云祥,等.FK506对缺血再灌注肾TNF-α,p38MAPK蛋白表达的影响 [J].医学临床研究,2006,23(4):465-467.
[5] Jiang s,Chen Y,Zou J,et a1.Diverse effects of ischemic pretreatments on the long-term renal damage induced by ischemia-reperfusion[J].Am J Nephro1,2009,30(5):440-449.
[6] Castaneda MP,Swiatecka-Urban A,Mitsnefes MM,et a1.Activation 0f mitochondrial apoptotic pathways in human renal allografts following ischemia[J].Transplantation,2003,76(1):50-54.
[7] Zhang GX,Kimura S,Murao K,et a1.Inhibition of cytochrome C release by 10-N-nonyl acridine orange,a cardiolipin-specific dye,during myoeardial ischemia-reperfusion in the rat[J].Am J Physiol Heart Circ Physiol,2010,298(2):H433-H439.
[8] Schramm L,Seibold A,Schneider R,et a1.Ischemic acute renal failure in the rat effects of L-arginine and superoxide dismutase on renal function[J].Nephrol,2008,21(2):229-235.
[9] Li Z,Nickkholgh A,Yi X,et a1.Melatonin protects kidney grafts from ischemia/reperfusion injury through inhibition of NF-kB and apoptosis after experimental kidney transplantation[J].J Pineal Res,2009,46(4):365-372.
[10] salas MA,Valverde CA,S6nchez G,et a1.The signalling pathway of CaMKII-mediated apoptosis and necrosis in the ischemia/reperfusion injury[J].J Mol Cell Cardiol,2010,48(6):1298-1306.
[11] 薛福平,李荣山.中华眼镜蛇毒抑制肾缺血再灌注损伤的实验研究[J].中华肾脏病杂志,2005,21(8):483-486.
[12] Devarajan P,Mishra J,Supavekin S,et a1.Gene expression in early ischemic renal injury:clues towards pathogenesis,biomarker discovery,and novel therapeutics[J]. Molecular Genetics and Metabolism,2003,80(4):365-376.
[13] Lehmkuhl H,Ross H,Eisen H,et a1.Everolimus(certican)in heart transplantation:optimizing renal function through minimizing cyclosporine exposure[J].Transplant Proc,2005,37(10):4145-4149.
[14] Monti P,MercaIIi A,Leone BE,et a1.Rapamycin impairs antigen uptake of human dendritic cells[J].Transplantation,2003,75(1):137-145.
[15] 周同,孙桂芝,张玉梅,等.黏附分子与树突状细胞在大鼠肝和肾缺血-再灌注损伤中作用及抗黏附干预的影响[J].中国微循环,2004,8(5):342-343.
[16] 黄赤兵,张银甫.雷帕霉素作用机制研究及在肾移植中的应用进展[J].中国药房,2006,17(7):547-549.
——雷帕霉素

