不同加成数C60-β-丙氨酸衍生物的还原能力及金属螯合能力
孙 涛,孙 斐,巢 骏,谢 晶,周冬香
(1.上海海洋大学食品学院,上海 201306;2.上海海洋大学海洋科学研究院,上海 201306)
自1985年发现富勒烯(C60为其代表物质)以来[1],关于水溶性C60衍生物抗氧化性的研究引起广泛关注[2-4]。自由基是带有未成对电子的分子或离子,生物体内自由基的产生和清除一般是平衡的,一旦失衡就会对机体造成氧化伤害,导致蛋白质变性、酶失活、脂质过氧化等[5-6]。金属离子可催化自由基的产生。自由基氧化是一种自动链式反应,脂氧化酶或是光照可诱导反应发生,诱导剂是金属离子。自由基氧化可以导致DNA断裂,若在金属离子的催化下,断裂速度将会增加数倍。金属离子同样也是自由基氧化碳水化合物过程中的催化剂。体内钠钾泵是自由基攻击目标之一,在金属离子的参与下,其损伤程度将会加剧。因此,金属离子在自由基氧化过程中发挥着重要作用。
文献已报道过C60-β-丙氨酸具有清除超氧阴离子、羟基自由基的能力[7]以及对由活性氧聚集引起的PC12细胞损伤的保护作用[8],但是关于还原能力以及金属螯合能力的研究尚未进行。本试验合成了三种不同加成数目的水溶性C60-β-丙氨酸衍生物并对其还原能力及金属螯合能力进行考察,以期为水溶性C60衍生物在生物医学领域中应用提供参考数据。
1 材料与方法
1.1 材料与仪器
C60纯度>99.9%(河南永新试剂公司);β-丙氨酸(上海国药试剂有限公司);菲洛嗪(美国Fluka公司);甲苯、乙醇、氢氧化钠、磷酸二氢钠、磷酸氢二钠、铁氰化钾、三氯化铁、氯化亚铁等均为分析纯。
Nicolet Nexus 470型红外光谱仪(美国Nicolet);UV-1800PC型紫外分光光度计(上海Mapada);DMX 500型核磁共振波谱仪(德国Bruker);MOD 1106型元素分析仪(意大利Cario Erba);UV-2000型紫外分光光度计(上海尤尼柯);TDL80-2B型台式离心机(上海安亭);HHS型电热恒温水浴锅(上海博迅);79-3型恒温磁力搅拌器(上海司乐);Delta 320型pH计(瑞士Mettler Toledo);AB204-N型分析天平(瑞士Mettler Toledo)。
1.2 C60-β-丙氨酸衍生物的合成
按照文献[9]设计合成C60-β-丙氨酸衍生物的方法,分别取40.0 mg β-丙氨酸和2.0 g氢氧化钠溶于12 mL去离子水中,加入80.0 mL无水乙醇,搅拌下缓慢滴加C60甲苯溶液(250.0 mg/250.0 mL),室温下搅拌5 d,至有机层中紫色消失,说明C60已反应完全。分液移去无色有机层,将黑色溶液层用蒸馏水稀释,再加入无水乙醇使产物沉淀,将产物用水和无水乙醇反复沉淀,40℃经真空干燥得到黑褐色固体粉末A。茚三酮试验显示产物中不含游离β-丙氨酸。将β-丙氨酸用量分别改为200.0 mg和2.5 g,重复上述实验,分别得到黑褐色的固体粉末B和C。
1.3 C60-β-丙氨酸衍生物的表征
对产物A、B和C进行FT-IR、UV、1H MNR和元素分析(C、N、H)测试。红外光谱采用KBr压片法制样,测定波数范围为400~4 000 cm-1,分辨率为2 cm-1。紫外光谱,测定波长范围为200~800 nm,分辨率为0.5 nm。核磁共振,500 MHz,溶剂D2O。
1.4 还原能力的测定
还原能力测试根据文献[10]测定并稍做改进。取2.0 mL不同浓度样品,加入pH 6.60的0.2 mol·L-1磷酸缓冲液和1%铁氰化钾溶液各2.5 mL,混匀。50℃水浴20 min后迅速冷却,加入2.5 mL 10%三氯乙酸溶液,混匀后在3 000 r·min-1下离心10 min,取上清液2.0 mL,加入2.5 mL去离子水和0.5 mL 0.1%的三氯化铁溶液,静置10 min后在700 nm处测定吸光度。
1.5 金属螯合能力的测定
按文献[11]稍加修改测定反应产物的金属螯合能力。取不同浓度的样品溶液3.5 mL,加入0.1 mL 2.0 mmol·L-1的氯化亚铁溶液和0.2 mL 5.0 mmol·L-1的菲洛嗪溶液,混和均匀。混合液室温静置10 min,并于562 nm处测定其吸光度。计算其金属螯合能力:螯合能力(%)=[1-(Ai-Aj)/A0]×100%。式中,A0-用水代替样品所测得的吸光度;Ai-样品所测得的吸光度;Aj-样品本身的吸光度。
2 结果与分析
2.1 结构表征
C60-β-丙氨酸衍生物的红外图谱如图1所示,三种衍生物A、B、C均有在521 cm-1处的吸收峰(C60的特征吸收峰),1 066 cm-1处的吸收峰(NC60),1 400 cm-1处的吸收峰(COO-),1 560 cm-1处的吸收峰(C-N),3 414 cm-1处吸收峰(N-H),与文献[9]报道一致,表明合成出的产物是C60-β-丙氨酸衍生物。
C60、β-丙氨酸和C60-β-丙氨酸衍生物的紫外图谱(见图2),β-丙氨酸和C60-β-丙氨酸衍生物在210 nm处有吸收峰,C60在296 nm处和353 nm处有吸收峰,说明C60-β-丙氨酸衍生物保留β-丙氨酸的吸收峰,但在C60原有吸收峰处发生改变。
C60-β-丙氨酸衍生物的1H NMR图谱(D2O,500 MHz)如图3所示,在1.1、3.4 ppm处的吸收峰是C60-H的吸收峰,与文献[8]报道一致。
元素分析结果显示,C60-β-丙氨酸衍生物A、B和C中碳∶氮∶氢的比例分别为60.7∶2∶1、30.3∶2∶1、17.9∶2∶1,说明C60-β-丙氨酸衍生物A、B和C中与C60上连接的β-丙氨酸的平均数目分别是2,4,8(计算值分别为1.85,4.09,8.07)。

图1 C60-β-丙氨酸衍生物的红外图谱Fig.1 FTIR spectra of β-alanine C60derivatives

图2 C60-β-丙氨酸衍生物的紫外图谱Fig.2 UV spectrogram of β-alanine C60derivatives

图3 C60-β-丙氨酸衍生物的1H NMR图谱Fig.3 1H NMR of β-alanine C60derivatives
2.2 还原能力
C60-β-丙氨酸衍生物的还原能力如图4所示,随浓度增加,三种衍生物A、B和C的吸光值增加,还原能力增强。同时,β-丙氨酸在这个浓度范围内无还原能力。在浓度为2.5 μmol·mL-1时,三种衍生物A、B和C的吸光度分别是0.424,0.612和1.040。还原能力大小顺序为C>B>A,即随加成度增加,C60-β-丙氨酸衍生物的还原能力增强。

图4 C60-β-丙氨酸衍生物的还原能力曲线Fig.4 Reducing power of β-alanine C60derivatives
2.3 金属螯合能力
C60-β-丙氨酸衍生物的金属螯合能力如图5所示,随着浓度的增加,三种衍生物A、B和C的金属螯合能力逐渐增强。同时,β-丙氨酸在这个浓度范围内几乎没有金属螯合能力。当螯合率达到50%时,所需三种衍生物A、B和C的浓度分别是0.348、0.261和0.135 μmol·mL-1。它们的金属螯合能力大小顺序为C>B>A,即随着加成度的增加,C60-β-丙氨酸衍生物的金属螯合能力不断增强。
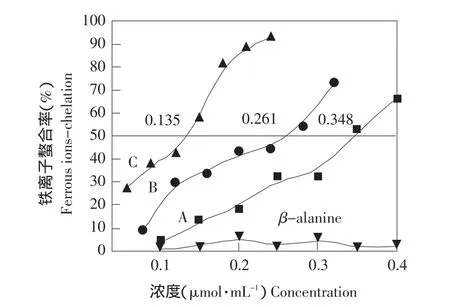
图5 C60-β-丙氨酸衍生物的金属螯合能力曲线Fig.5 Chelating ability of β-alanine C60derivatives
3 讨论与结论
a.C60-β-丙氨酸衍生物的还原能力主要与C60-β-丙氨酸衍生物分子上C=C双键的数量、位阻效应和加成基团的性质有关[12]。在还原能力测试中,β-丙氨酸无还原能力,而富勒烯化学研究表明,富勒烯还原金属离子主要是通过打开C=C双键来提供电子[3],因此C60-β-丙氨酸衍生物的还原能力主要来自于C60上保留下来的双键。C60与胺类物质之间的反应倾向于1,2-加成或1,4-加成反应[13]。随着加成基团的增加,阻碍铁离子进攻C=C双键所形成的空间位阻增大,导致C60-β-丙氨酸衍生物的还原能力降低。β-丙氨酸与C60以一个-NH基相连,-NH基是一个强供电子基团,其供电效应使具有不饱和烯烃性质的C60上的C=C双键的电荷密度增大,C=C双键给出电子,还原能力增强。三种C60-β-丙氨酸衍生物还原能力的大小顺序为C>B>A,说明在这个体系中-NH基供电效应对C60-β-丙氨酸衍生物还原能力占主导因素。
b.一些不饱和烯烃如乙烯(CH2=CH2)、乙炔(CH≡CH)可与金属离子形成配合物。具有成键π电子和能量较高的空π*分子轨道,给出其成键π电子与金属离子形成σ配位键或者其空轨道接受金属离子的电子形成反馈π键配位键。C60具有不饱和烯烃的性质,与金属离子形成配位键[14]。随着C60-β-丙氨酸衍生物侧链β-丙氨酸以及-NH基数目的增加,分子极性增强,π键电子云密度也不断增加,使C=C双键更容易与金属离子形成配位键,因此C60-β-丙氨酸衍生物的金属螯合能力不断增强。三种C60-β-丙氨酸衍生物金属螯合能力的大小顺序为C>B>A,即随加成度增加,C60-β-丙氨酸衍生物的β-丙氨酸侧链数量增加,金属螯合能力增强。
[1]Kroto H W,Heath J R,O'Brien S C,et al.C60:Buckminsterfullerene[J].Nature,1985,318:162-163.
[2]叶光明,吴秋业,姜云云,等.富勒烯在医药领域中的研究进展[J].药学实践杂志,2004,22(2):73-76.
[3]Chiang L Y,Lu F J,Lin J T.Free-radical scavenging activity of water-soluble fullerenols[J].J Chem Soc Chem Commun,1995(12):1283-1284.
[4]江贵长,郑启新.富勒烯-赖氨酸衍生物的合成及其体外抗癌活性研究[J].材料导报,2005,19(8):135-138.
[5]Fridovich I.The biology of oxygen radicals[J].Science,1978,201:875-880.
[6]Nordberg J,Arner E S J.Reactive oxygen species,antioxidants,and the mammalian thioredoxin system[J].Free Radic Biol Med,2001,31(11):1287-1312.
[7]Sun T,Xu Z D.Radical scavenging activities of α-alanine C60adduct[J].Bioorg Med Chem Lett,2006,16(14):3731-3734.
[8]Hu Z,Guan W C,Wang W,et al.Synthesis of β-alanine C60derivative and its protective effect on hydrogen peroxide-induced apoptosis in rat pheochromocytoma cells[J].Cell Biol Int,2007,31(8):798-804.
[9]Gan L B,Luo C P,Xu L B,et al.Water-soluble fullerene derivatives,synthesis and characterization of β-alanine C60adducts[J].Chinese Chemical Letters,1994,5(4):275-278.
[10]Yen G C,Chen H Y.Antioxidant activity of various tea extracts in relation to their antimutagenicity[J].J Agri Food Chem,1995,43(1):27-32.
[11]Chan E W C,Lim Y Y,Chew Y L.Antioxidant activity of Camellia sinensis leaves and tea from a lowland plantation in Malaysia[J].Food Chem,2007,102(4):1214-1222.
[12]孙涛,徐铸德,贾之慎.功能化基团对C60-β-丙氨酸衍生物清除超氧阴离子自由基O2能力的影响[J].高等学校化学学报,2003,24(7):1231-1233.
[13]Miller G P.Reactions between aliphatic amines and fullerene:A review[J].C R Chim,2006,9(7-8):952-959.
[14]Wu Z Y,Lin Y S,Chen D D,et al.Synthesis and redox properties study of C60RuH2(CO)(PPh3)complex[J].Chin J Inorg Chem,2001,17(6):883-887.

