大鼠血管外膜成纤维细胞亚群生长特性及功能研究*
刘 培,邵铁梅,卢海刚,柴锡庆,高维娟,安胜军
(河北化工医药职业技术学院,河北省高校生物反应器与蛋白类药物开发应用技术研发中心,河北 石家庄 050026)
血管外膜成纤维细胞在血管新生内膜形成、不良血管重塑和血管再狭窄病变中的重要作用引起了广泛的重视[1-3]。随着对细胞表面标记、结构蛋白及功能的研究,发现成纤维细胞是由许多具有独特表型和功能的亚群组成[4]。Das 等[5]和 Stenmark 等[6]对牛肺动脉外膜成纤维细胞的相关研究也支持血管外膜成纤维细胞在形态及功能特性上有巨大的异质性。但是有关SD大鼠胸主动脉外膜成纤维细胞亚群及其在血管功能中的比较研究目前尚未见报道。本实验旨在获得SD大鼠胸主动脉成纤维细胞亚群细胞系,并摸索其生长特性,比较血管紧张素II(angiotensin II,Ang II)及其受体拮抗剂氯沙坦(losartan)和PD-123319对不同细胞亚群前内皮素原-1(preproendothelin-1,preproET-1)mRNA表达的影响,为在细胞水平研究血管新生内膜形成、不良血管重塑和血管再狭窄机制提供充足可靠的靶细胞模型和一定的生理依据。
材料和方法
1 动物
SPF级SD大鼠,雄性,6~8周龄,购自河北医科大学实验动物中心,许可证号为SCXK(冀)2008-1-003。
2 主要试剂
胎牛血清(fetal bovine serum,FBS)购自Lonza BioWhittaker;DMEM/F12和0.25%胰蛋白酶购自Gibco;甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT)购自Solarbio;Trizol购自Invitrogen;二甲基亚砜(dimethyl sulphoxide,DMSO)、Ang II、losartan 和PD-123319购自Sigma;dNTP、Taq DNA聚合酶购自Promega;所用引物由上海生工生物技术有限公司根据设计合成,见表1、2。
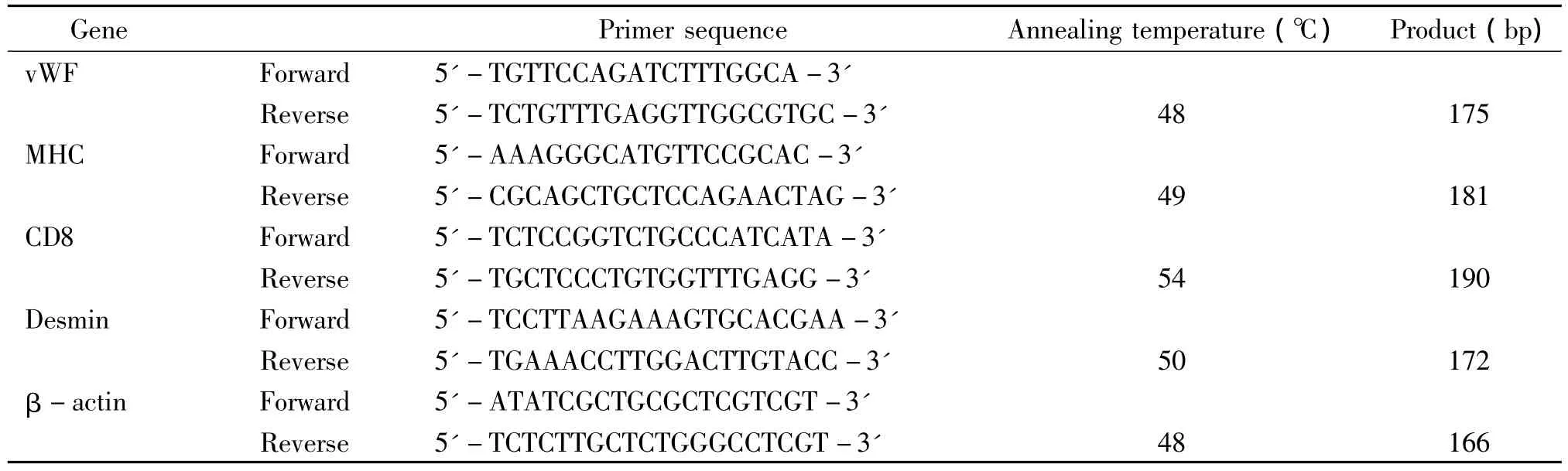
表1 RT-PCR引物序列Table 1.Sequences of the primers for RT-PCR
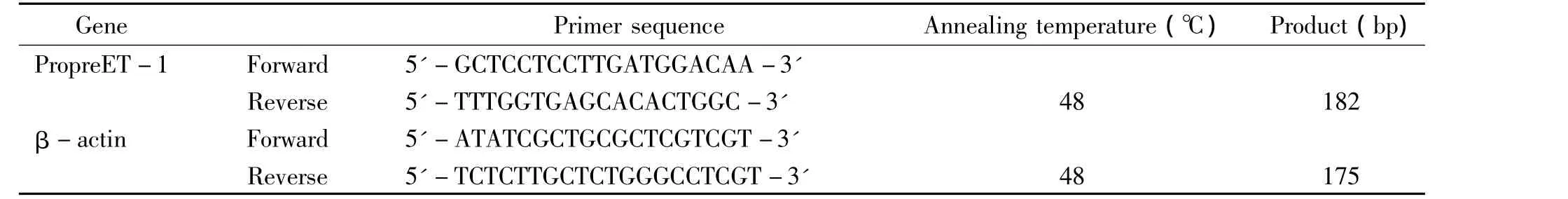
表2 荧光定量PCR引物序列Table 2.Sequences of the primers for fluorecent quantitative PCR
3 主要方法
3.1 血管外膜成纤维细胞亚群的分离与培养 SD大鼠断头处死,无菌条件下取胸主动脉,放入预冷的磷酸盐缓冲液(phosphate buffered solution,PBS)中,清洗后于手术镜下纵向剖开血管腔,刮去血管内膜和中膜,剩下薄层的血管外膜,转移入含有20%FBS的DMEM/F12培养基中,剪成约1 mm×1 mm×1 mm小块,吸弃多余的培养基,将组织块均匀铺于培养皿上,置37℃、5%CO2培养箱干涸24 h,待组织块贴壁后向培养皿中滴加少量含20%FBS的DMEM/F12培养基,置37℃、5%CO2培养箱中培养,次日补加适量培养液继续培养,细胞生长达80%融合状态时胰酶消化,并稀释为5.0×104cells/L的细胞悬液,取1 mL该悬液补加5 mL新鲜培养液,吹打均匀后移入100 mm培养皿中培养,待细胞贴壁后换液,用记号笔在培养皿底部标记单个细胞,采用克隆环法[7]进行单克隆细胞培养,第3 d即可长出克隆集落,用胰蛋白酶消化传至24孔板中扩大培养,逐步扩增细胞以获得足够的细胞量,实验用细胞为第3~5代成纤维细胞亚群。
3.2 细胞纯度鉴定 为了确认成纤维细胞亚群无内皮细胞、平滑肌细胞和白细胞的污染,采用RTPCR来鉴定,以β-肌动蛋白(β-actin)为内参照,von Willebrand因子(von Willebrand factor,vWF)为内皮细胞标志物,肌球蛋白重链(myosin heavy chain,MHC)和结蛋白(desmin)为平滑肌细胞标志物,CD8为白细胞标志物,设计并合成相关引物,引物序列及退火温度见表1。分别提取大鼠血管外膜组织和成纤维细胞亚群RNA,经反转录合成cDNA,以cDNA为模板进行梯度PCR,循环体系为1.25 U Taq聚合酶、20 mmol/L Tris- HCl(pH 8.0)、50 mmol/L KCl、0.2 mmol/L dNTP、1.5 mmol/L MgCl2和 0.02 μmol/L上、下游引物。循环程序如下:95℃初始化5 min,95 ℃ 1 min,46 ℃ ~56 ℃ 30 s,72 ℃ 30 s,30个循环,72℃ 10 min。PCR产物经2%琼脂糖凝胶电泳后溴化乙啶染色,凝胶成像系统捕获图像。
3.3 细胞生长曲线测定(MTT法) 血管外膜成纤维细胞亚群经胰酶消化后吹打均匀,调整细胞悬液浓度为1.0×107cells/L,接种于96孔板,每孔200 μL,每组8孔,其中包括3个平行对照孔(只加培养基,不加细胞),每24 h测1组,连续7 d。具体操作如下:将96孔板于37℃、5%CO2培养箱中孵育。待细胞贴壁后饥饿24 h,使其生长同步化。每24 h向1组细胞中加入20 μL MTT(5 g/L)溶液,继续孵育4 h后弃培养液,每孔加入200 μL DMSO,振荡10 min使结晶物充分溶解,采用酶联免疫检测仪测定各孔吸光度值(A),将平行对照孔调零,以时间为横坐标,吸光度为纵坐标,绘制细胞生长曲线。
3.4 Ang II对成纤维细胞亚群preproET-1 mRNA表达的影响 采用荧光定量PCR检测Ang II对成纤维细胞亚群preproET-1 mRNA表达的影响。取长至80%融合的细胞亚群,胰酶消化并计数,制备1.0×107cells/L细胞悬液,将细胞悬液种入6孔板中培养,待细胞长至80%融合后弃旧培养液,加入含100 nmol/L Ang II的新鲜培养液,分别于不同时点(0.5、1.0、1.5、3、6 和12 h)提取细胞亚群 RNA;进一步固定作用时间,用不同浓度 Ang II(0、10、100和1000 nmol/L)诱导各细胞亚群并提取RNA。
Ang II受体分为1型(angiotensin II type 1 receptor,AT1受体)和2型(AT2受体),其拮抗剂分别为losartan和PD-123319。将80%融合的成纤维细胞亚群分为6组:空白对照组、losartan组、PD-123319组和Ang II(100 nmol/L)组、Ang II+losartan组和Ang II+PD-123319组。首先用100 μmol/L losartan或PD-123319预处理30 min,空白对照组不给予拮抗剂,之后加或不加Ang II(100 nmol/L),继续培养30 min后提取RNA。
采用Trizol法提取各组RNA,通过反转录合成cDNA,以cDNA为模板进行荧光定量PCR。循环体系中有SBGR Green(20×),其余与RT-PCR相同,引物设计及退火温度等见表2。循环程序如下:95℃初始化 2 min,95 ℃ 1 min,48 ℃ 30 s,72 ℃30 s,共30个循环。以看家基因β-actin为内参照,采用Rotor-Gene 6000软件进行数据分析,即以处理前细胞preproET-1和β-actin的比值为1,获得各个preproET-1/β-actin的值。
4 统计学处理
统计学分析及图形处理使用GraphPad Prism 5.0软件,数据均用平均值±标准差()表示。各组间均数比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD-t检验。
结 果
1 成纤维细胞亚群形态学观察
克隆环法体外分离了120个血管外膜成纤维细胞亚群,倒置显微镜下观察发现,这些细胞从形态上可分为2个亚群:圆形细胞亚群和纺锤形细胞亚群,见图1。

Figure 1.Fibroblast subpopulations isolated from adventitia by cloning rings(×200).A:fibroblast subpopulation derived from adventitial fibroblasts demonstrated a epithelioid appearance,named round cells;B:subpopulation of adventitial fibroblasts appeared spindle shape,named spindle cells.The cells were isolated from 8 different SD rats.图1 克隆环法获得大鼠血管外膜成纤维细胞亚群
2 细胞纯度分析
分别提取自圆形细胞和纺锤形细胞的RNA经反转录扩增后进行琼脂糖凝胶电泳,结果如图2所示,圆形细胞和纺锤形细胞均无白细胞标志物CD8和内皮细胞标志物vWF的表达,平滑肌细胞标志物desmin和MHC亦未见表达;相同实验条件下,血管组织中各标记物均表达,其中β-actin为内参照。这表明,本实验经体外分离的圆形细胞和纺锤形细胞无白细胞、内皮细胞和平滑肌细胞的污染,为纯细胞系。
3 成纤维细胞亚群的生长特性
MTT法可以较准确地反映活细胞数,客观地反映细胞的增殖情况。2个细胞亚群的生长趋势有所不同,圆形细胞于第2 d进入指数分裂期,第4 d进入平台期;纺锤形细胞于第3 d进入指数分裂期,第5 d进入平台期,见图3。
4 Ang II对成纤维细胞亚群preproET-1 mRNA表达的影响
Ang II(100 nmol/L)作用时间为0.5 h时,2个细胞亚群preproET-1 mRNA表达量最高,且无显著差异,见图4。但是从1 h开始,preproET-1 mRNA表达量明显下降,呈衰减趋势。选定作用时间0.5 h,继续观察不同浓度Ang II(0、10 nmol/L、100 nmol/L和1000 nmol/L)对preproET-1 mRNA表达量的影响。结果显示:与自身对照组相比,Ang II呈浓度依赖性显著增加圆形细胞preproET-1 mRNA的表达量(P<0.01);而对纺锤形细胞preproET-1 mRNA表达量无显著影响,见图5。

Figure 2.Result of cell purity identification.Round cells and spindle cells derived from the aorta adventitia showed no expression fo von Willebrand factor(vWF,endothelial cell marker),CD8(leukocyte marker),desmin and myosin heavy chain(MHC,vascular smooth muscle cell marker).In contrast,the aorta had strong positive staining for vWF,CD8,MHC and desmin.Both cultured fibroblast subpopulations and aorta tissue expressed β - actin(housekeeping gene).图2 细胞纯度鉴定结果
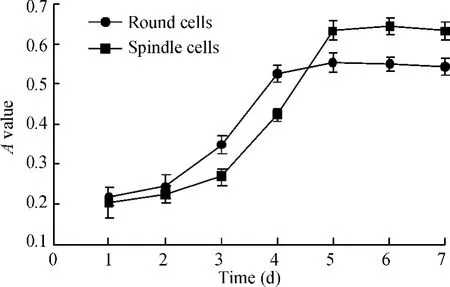
Figure 3.Growth curves of fibroblast subpopulations.For round cells,the exponential phase of growth was from the 2nd day to the 4th day after passage;for spindle cells,the exponential phase of growth was from the 3rd day to the 5th day after passage.图3 成纤维细胞亚群生长曲线
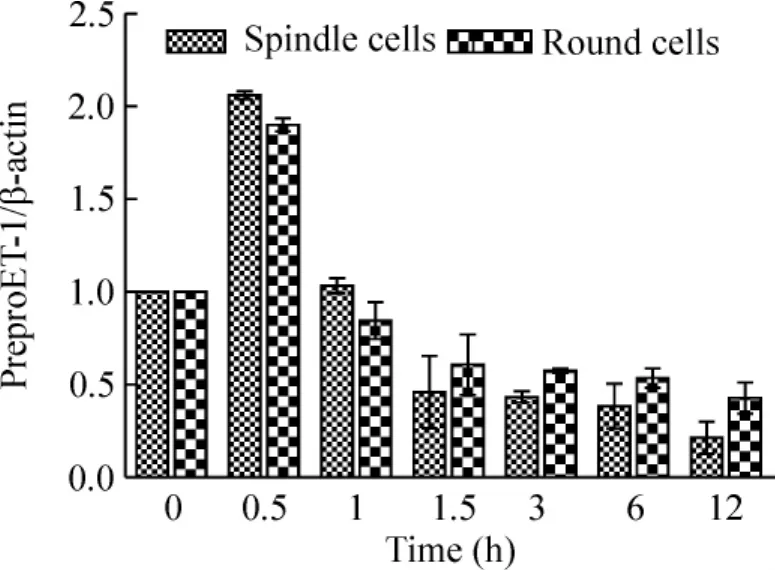
Figure 4.Effects of Ang II(100 nmol/L)on expression of preproET-1 in spindle cells and round cells for various time..n=3.图4 Ang II不同作用时间诱导成纤维细胞亚群preproET-1 mRNA的表达
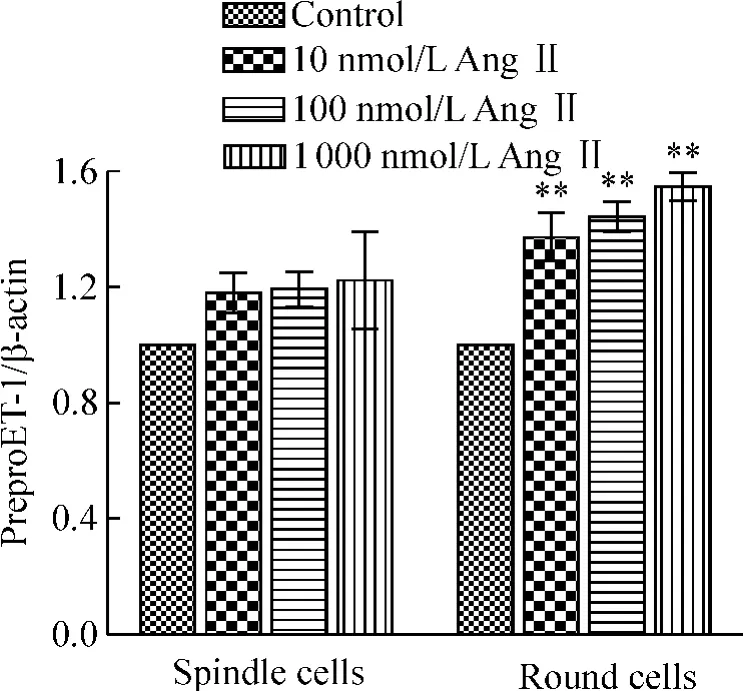
Figure 5.Effects of Ang II on expression of prepro ET-1 in spindle cells and round cells.The cells were incubated with Ang II at various concentrations(0,10 nmol/L,100 nmol/L and 1000 nmol/L)for 0.5 h..n=3.**P <0.01 vs control.图5 不同浓度Ang II对纺锤形细胞和圆形细胞preproET-1 mRNA表达的影响
图6中,与对照组(Ang II组)相比,losartan预处理30 min后,显著抑制Ang II诱导的圆形细胞preproET-1 mRNA的表达,而对纺锤形细胞preproET-1 mRNA的表达无明显影响;PD-123319预处理30 min后,对圆形细胞和纺锤形细胞preproET-1 mRNA的表达均无明显影响。无Ang II诱导的实验组中,细胞preproET-1 mRNA的表达均无明显变化,这说明Ang II诱导圆形细胞preproET-1 mRNA的表达是通过AT1受体介导的。
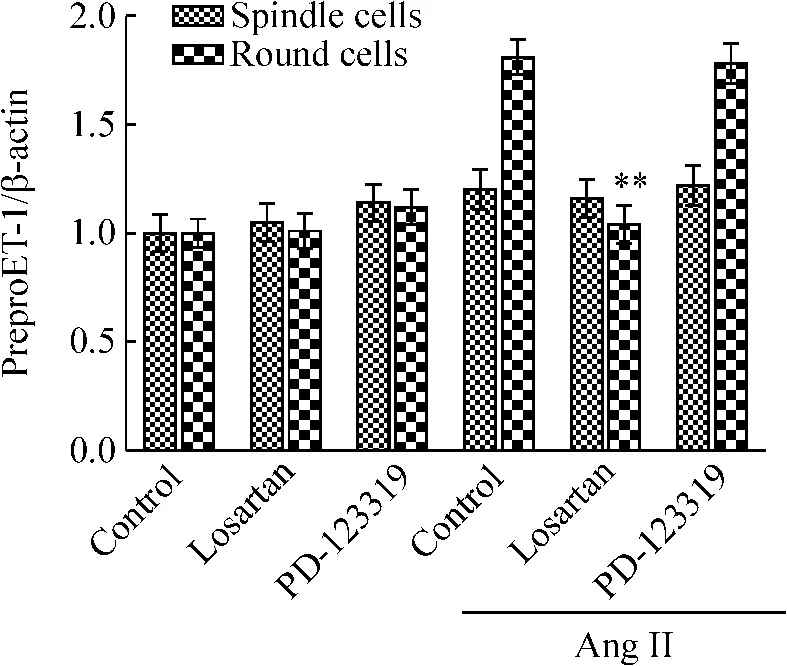
Figure 6.Effects of Ang II receptor inhibitors on Ang II-induced expression of preproET-1 mRNA in spindle cells and round cells.The cells were pre-incubated with losartan(100 μmol/L),an AT1receptor antagonist,or PD -123319(100 μmol/L),an AT2receptor antagonist,for 30 min.The cells were then incubated with or without Ang II(100 nmol/L)for 30 min..n=3.**P <0.01 vs respective control cells.图6 Ang II受体拮抗剂对preproET-1 mRNA表达的影响
讨 论
血管由内膜、中膜和外膜构成,成纤维细胞是血管外膜的主要细胞成分[4]。传统观念认为,血管损伤的主要反应在中膜,以平滑肌细胞增生、迁移为显著特征,对血管重构的研究多集中在中层平滑肌细胞上,而忽略了血管外膜改变在血管重构形成中的作用[8]。近年的研究结果指出外膜在血管功能中并非只起支持及营养作用。在血管损伤后,位于血管外膜的成纤维细胞由“静止”状态转为“激活”状态,迁移至内膜下区域并参与新生内膜形成[9]。
Das等[5]对新生牛肺动脉的研究表明,肺动脉外膜由很多表型各异的成纤维细胞亚群组成,牛肺动脉外膜成纤维细胞亚群的异质性表现在形态学、DNA合成、肌动蛋白表达量及表达形式等方面。成纤维细胞亚群的异质性在多种动物中均有体现,更重要的是,来自同一种动物的成纤维细胞亚群与来自其它动物的亚群具有惊人的相似性。该实验结果与有关内皮组织和中层组织细胞异质性的报道相一致[10-12]。
本研究中,我们体外分离了SD大鼠血管外膜成纤维细胞亚群(圆形细胞亚群和纺锤形细胞亚群),从形态上说明了成纤维细胞亚群的异质性,并鉴定了细胞纯度,以排除内皮细胞、平滑肌细胞及白细胞的污染,结果表明2个细胞亚群均为血管外膜成纤维细胞的纯细胞系。除形态上区分圆形细胞和纺锤形细胞,进一步采用MTT法,比较了2种细胞的增殖能力,根据各孔吸光度值与细胞活力的正比关系,间接反映了细胞的生长状态,结果显示2个细胞亚群的增殖能力略有差异,圆形细胞较纺锤形细胞早1 d进入指数分裂期。
外膜成纤维细胞在调节血管平滑肌功能中的作用目前尚不十分清楚。当前研究发现表明外膜细胞可能在血管损伤和高血压中起重要作用。相比WKY鼠胸主动脉血管外膜成纤维细胞,自发性高血压大鼠的成纤维细胞有更高的增殖能力。这些发现说明在血液动力学和组织水平,ET-1有利于Ang II参与的血管作用。且有报道指出在鼠成心肌纤维细胞[13]和主动脉平滑肌细胞[14]中Ang II能诱导的 ET-1表达。我们前期的研究亦证明血管外膜成纤维细胞能够合成和释放ET-1[15]。在Ang II刺激下,成纤维细胞培养液中ET-1的分泌呈时间和剂量依赖性,成纤维细胞能够表达preproET-1 mRNA,蛋白质斑迹法检测其蛋白的表达与mRNA水平趋势一致,据此我们推测外膜源性的ET-1的分泌参与了血管损伤及修复过程。外膜ET-1在吸引白细胞渗透方面也扮演重要角色。研究显示高血压在某种程度上是由炎症引起的。C反应蛋白是炎症的标志,在高血压患者体内该蛋白明显增多,C反应蛋白水平亦是高血压并发症的一个很好的指标。ET-1能促进炎症细胞浸润,导致醛固酮依赖性高血压患者肾脏组织损伤。另外,在局部缺血再灌注诱导的黏膜功能障碍中,ET-1参与多形核白细胞的渗透。因此,Ang II诱导ET-1的释放在细胞外基质调节中的作用以及外膜ET-1的其它作用很重要。本文就成纤维细胞的2个亚群的细胞功能进行了比较研究。在(0~1000)nmol/L浓度范围内,Ang II浓度依赖性地增加了圆形细胞preproET-1 mRNA的表达,而对纺锤形细胞内preproET-1 mRNA的表达无显著影响,该结果显示Ang II诱导圆形细胞prepro-ET-1 mRNA的表达是通过AT1介导的,AT1拮抗剂losartan阻断了Ang II诱导ET-1表达量的增加。
综上所述,本研究成功分离了SD大鼠血管外膜成纤维细胞亚群,比较了2个亚群的增殖能力,并分析了Ang II对2个细胞亚群preproET-1表达的影响。为从细胞分子水平研究心血管疾病病因、机制和防治奠定了基础。据此我们推测成纤维细胞的2个亚群在迁移能力、表型分化及肌动蛋白表达等功能特性上亦存在差异,可能不同程度地参与新生内膜的形成和血管重构等过程,具体作用机制有待进一步探讨。
[1]Siow RC,Mallawaarachchi CM,Weissberg PL,et al.Migration of adventitial myofibroblasts following vascular balloon injury:insights from in vivo gene transfer to rat carotid arteries[J].Cardiovasc Res,2003,59(1):212 -221.
[2]Stenmark KR,Gerasimovskaya E,Nemenoff RA,et al.Hypoxic activation of adventitial fibroblasts:role in vascular remodeling[J].Chest,2002,122(6):326 -334.
[3]Wallner K,Sharifi BG,Shah PK,et al.Adventitial remodeling after angioplasty is associated with expression of tenascin mRNA by adventitial myofibroblasts[J].J Am Coll Cardiol,2001,37(2):655 -661.
[4]杨 汀,王 辰,庞宝森,等.透明质酸对大鼠肺泡巨噬细胞和肺成纤维细胞分泌蛋白酶的影响[J].中国病理生理杂志,2009,25(3):541-546.
[5]Das M,Dempsey EC,Reeves JT,et al.Selective expansion of fibroblast subpopulations from pulmonary artery adventitia in response to hypoxia[J].Am Physiol Lung Cell Mol Physiol,2002,282(5):L976 - L986.
[6]Stenmark KR,Davie N,Frid M,et al.Role of adventitia in pulmonary vascular remodeling[J].Physiology,2006,21(2):134-145.
[7]Davie NJ,Gerasimovskaya EV,Hofmeister SE,et al.Pulmonary artery adventitial fibroblasts cooperate with vasa vasorum endothelial cells to regulate vasa vasorum neovascularization:a process mediated by hypoxia and endothelin-1[J].Am J Pathol,2006,168(6):1793 -1807.
[8]沈丹彤,傅向阳,黄巧冰.衰老和低氧对体外培养大鼠肺动脉平滑肌细胞形态的影响[J].中国病理生理杂志,2007,23(2):284-287.
[9]郭淑杰,吴凌云,魏 坚,等.血管外膜肌成纤维细胞分化相关蛋白研究[J].化学学报,2007,65(15):1504-1510.
[10]王伟铭,周 同,姚 建.成纤维细胞及其异质性研究进展[J].生命科学,1997,9(3):132-135.
[11]Stevens T,Phan S,Frid MG,et al.Lung vascular cell heterogeneity:endothelium,smooth muscle,and fibroblasts[J].Proc Am Thorac Soc,2008,5(7):783 -791.
[12]Das M,Bouchey DM,Moore MJ,et al.Hypoxia-induced proliferative response of vascular adventitial fibroblasts is dependent on G protein-mediated activation of mitogen- activated protein kinases[J].J Biol Chem,2001,276(19):15631-15640.
[13]Cheng TH,Cheng PY,Shih NL,et al.Involvement of reactive oxygen species in angiotensin II-induced endothelin - 1 gene expression in rat cardiac fibroblasts[J].J Am Coll Cardiol,2003,42(10):1845 -1854.
[14]Hong HJ,Chan P,Liu JC,et al.Angiotensin II induces endothelin-1 gene expression via extracellular signalregulated kinase pathway in rat aortic smooth muscle cells[J].Cardiovasc Res,2004,61(1):159 -168.
[15]An SJ,Boyd R,Wang Y,et al.Endothelin-1 expression in vascular adventitial fibroblasts[J].Am J Physiol Heart Circ Physiol,2006,290(2):H700 - H708.

