西洋参茎叶总皂苷通过抑制过度内质网应激减轻大鼠心肌细胞缺氧/复氧损伤*
王 琛,李玉珍,王晓礽,吕振嵘,史大卓△,刘秀华△
(1中国中医科学院西苑医院,北京 100091;2解放军总医院病理生理研究室,北京 100853)
上世纪九十年代以来我国对西洋参茎叶化学成分和药理学作用进行了大量研究,表明其化学成分包括皂苷类、氨基酸类、糖类、挥发油类、无机元素类和脂肪酸类等,西洋参茎叶总皂苷(Panax quinquefolium saponin,PQS)是从西洋参茎叶中提取出的活性成分。研究显示,PQS具有抗缺血/再灌注(ischemia/reperfusion,I/R)心肌细胞凋亡、抗心律失常、改善梗死后心室重构、增强抗氧化酶活性、减轻缺血所致的游离脂肪酸代谢紊乱和乳酸堆积、维持细胞内Ca2+稳态等作用[1-4]。内质网 (endoplasmic reticulum,ER)是细胞加工蛋白质和贮存Ca2+的主要场所,缺血缺氧、葡萄糖/营养物质匮乏、ATP耗竭、大量自由基的产生及Ca2+稳态破坏等均可引起ER功能障碍,触发内质网应激 (endoplasmic reticulum stress,ERS)。持续而严重的ERS可通过钙超载、影响线粒体功能等加重细胞凋亡和I/R损伤[5-6],表现为ERS标志分子葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)、钙网蛋白 (calreticulin,CRT)的表达及ERS相关细胞凋亡途径[C/EBP同源蛋白(C/EBP homologous protein,CHOP)、caspase-12等]的激活。PQS是否通过抑制过度的ERS,发挥抗心肌I/R损伤的作用,以往尚缺乏研究。本研究利用乳鼠心肌细胞缺氧/复氧 (hypoxia/reoxygenation,H/R)模型,观察PQS对心肌细胞损伤的保护作用,并通过ERS探讨PQS抗心肌缺血再灌注损伤的相关保护机制。
材料和方法
1 动物与试剂
清洁级SD 24 h内新生乳鼠由军事医学科学院实验动物中心提供;PQS粉由吉林省集安益盛药业股份有限公司提供;DMEM培养基购自Gibco;新生牛血清 (newborn calf serum,NCS)购自PAA;胰蛋白酶(trypsin)购自Amresco;蛋白酶抑制剂购自Sigma;Annexin V-FITC细胞凋亡检测试剂盒购自南京凯基生物工程公司;乳酸脱氢酶(lactate dehydogenase,LDH)测试盒购自南京建成生物工程研究所;TRNzol-A+总RNA提取试剂、2×Taq PCR Master Mix和电泳级琼脂糖购自北京天根生化科技有限公司;cDNA第1链合成试剂盒购自北京全式金生物技术有限公司;PCR引物由北京三博远志生物技术有限责任公司合成;蛋白电泳分子量 (7~175 kD)标记为Bio-Rad产品;兔抗人CRT、caspase-12和GRP78多克隆抗体购自Stressgen;兔抗人GAPDH单克隆抗体、小鼠抗人CHOP单克隆抗体和兔抗人Bax、Bcl-2多克隆抗体均购自Cell Signal;增强化学发光(ECL)试剂盒购自Millipore;辣根过氧化酶标记山羊抗兔和山羊抗小鼠IgG购自Santa Cruz。
2 乳鼠心肌细胞培养
参照Simpson等[7]加以改进,无菌操作取出生后24 h内SD新生乳鼠心尖部组织,剪碎成1 mm×1 mm×1 mm大小,加入适量0.15% 胰蛋白酶,37℃水浴下轻柔搅动、反复消化,制备心肌细胞悬液,差速贴壁。用含15%新生牛血清的DMEM培养液,调整细胞浓度为每瓶3×106,接种于底面积为75 cm2的培养瓶,置CO2孵箱进行原代培养。
3 实验分组
取原代培养心肌细胞,置于CO2孵箱常规培养24 h,换无新生牛血清的DMEM培养液同步化24 h后,进行如下2个部分研究。为证明PQS对H/R心肌细胞的保护作用分为以下3组:正常对照 (control)组:细胞置CO2孵箱37℃,常规培养至实验结束;H/R组:按Li等[8]将细胞置于缺氧仓内,通入95%N2-5%CO2混合气,缺氧4 h后放回CO2孵箱,37℃常规继续培养12 h结束实验;PQS+H/R组:以PBS缓冲液稀释PQS原粉,配成浓度分别为20、40、80、160 g/L的储存液,过滤除菌,4 ℃保存,应用时将储存液1000倍稀释加入心肌细胞培养液中,培养24 h,进行H/R操作,根据预实验结果(见图1),选取终浓度为160 mg/L为最佳给药浓度。为进一步探讨PQS对H/R心肌细胞保护作用的机制,又分为以下4组:正常对照组、H/R组和H/R+PQS组,处理同上;PQS组,细胞置CO2孵箱37℃常规培养16 h,然后加入160 mg/L的PQS水溶液,继续培养24 h。
4 凋亡率、LDH漏出及细胞存活率测定
实验结束时,收集各组细胞培养液,用0.25%胰蛋白酶+0.02%EDTA消化液制备单细胞悬液,按照测试盒方法分别加入染料Annexin V和溴化丙啶(propidium lodide,PI),室温下孵育5 ~15 min,以流式细胞仪(BD FACScalibur,Becton-Dickinson)检测细胞凋亡情况,以台盼蓝排斥实验[9]测定细胞存活率,按LDH测试盒方法检测细胞培养液中LDH活性。
5 RT-PCR测定
TRNzol-A+提取总RNA,紫外分光光度计测定RNA含量。按cDNA第1链合成试剂盒操作步骤将RNA反转录成cDNA,进行PCR扩增。各目的基因上、下游引物见表1。采用Image-Pro Plus 4.1软件分析条带平均吸光度值 (A),以目的片段和GAPDH的平均光密度比值反映目的基因mRNA水平。

Figure 1.Panax quinquefolium saponin(PQS)reduced apoptosis induced by hypoxia/reoxygenation(H/R)in vitro as determined by flow cytometric analysis of Annexin V and propidium iodide(PI)double-stained cardiomyocytes.A:flow cytometric images;B:apoptotic rates of cardiomyocytes in different groups..n=3.*P<0.05 vs control;#P<0.05 vs H/R.图1 流式细胞术分析PQS对H/R诱导心肌细胞凋亡的影响
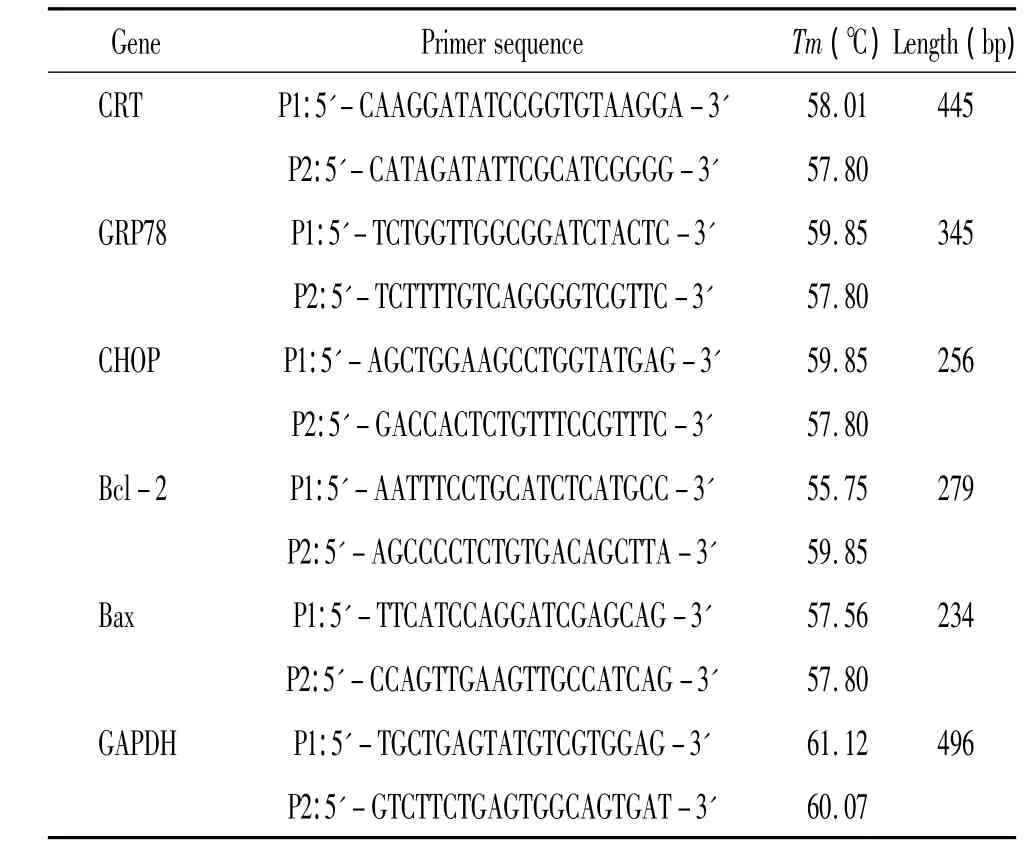
表1 PCR反应中目的片段引物Table 1.Primer sequences used in PCR
6 Western blotting分析
按Liu等[10]报道方法提取心肌细胞总蛋白,Bradford法蛋白定量后分装,-80℃保存。取上述细胞蛋白提取液上清(含蛋白80 μg)进行聚丙烯酰胺凝胶电泳 (SDS-PAGE,12%分离胶),将电泳分离后的蛋白质电转移至硝酸纤维素膜上,用5%BSA封闭40 min后分别加入 CRT、GRP78、caspase-12、Bcl-2、Bax多克隆抗体(均为1∶500)、CHOP 单克隆抗体 (1∶500)4℃过夜孵育,用1×TBS-T洗膜后,以相应的II抗孵育1.5 h,并以GAPDH(1∶500)单克隆抗体重复上述实验过程,作为上样对照。化学发光ECL显示,采用Image-Pro Plus 4.1软件分析蛋白条带的积分吸光度值(integrated A value,IA,平均吸光度值×面积),以靶蛋白/GAPDH IA比值反映靶蛋白水平。
7 统计学处理
采用SAS 8.2统计软件对实验数据进行分析,数据用均数±标准差()表示,采用单因素方差分析 (One-way ANOVA)进行多组间比较,采用q检验进行多组间两两比较,两变量相关性采用Pearson相关分析,以P<0.05为差异有统计学意义。
结 果
1 西洋参茎叶总皂苷对H/R心肌细胞的保护作用
1.1 心肌细胞凋亡率 正常对照组细胞生长状态良好,细胞凋亡率为2.12%;H/R组细胞凋亡率为7.09%(P <0.05);分别以 20、40、80、160 mg/L PQS培养细胞24 h,细胞凋亡率分别为4.2%、3.5%、3.2%和2.9%,P<0.05,呈剂量依赖性,见图1。
1.2 细胞培养液LDH活性 正常对照组细胞生长状态良好,细胞培养液LDH活性为113.4 U/L,H/R组细胞膜通透性增高,培养液LDH活性较对照组升高约6倍 (P<0.05),以160 mg/L PQS培养液培养细胞24 h,其细胞培养液LDH活性较H/R心肌细胞培养液降低了66.58%(P<0.05),见表2。
1.3 细胞存活率 台盼蓝排斥实验结果显示,正常对照组细胞存活率为96.3%,H/R组细胞存活率较对照组降低21.7%(P<0.05)。以160 mg/L PQS培养液孵育细胞24 h,其细胞存活率较H/R心肌细胞升高了21.1%(P<0.05),见表2。
1.4 凋亡相关蛋白Bax、Bcl-2 mRNA和蛋白的表达 RT-PCR的结果显示,H/R组Bcl-2 mRNA的表达较对照组降低44.5%(P<0.05),BaxmRNA的表达较对照组升高86.9%(P<0.05),提示H/R可诱导抗凋亡蛋白Bcl-2和抑制促凋亡蛋白Bax mRNA的表达。PQS可诱导H/R后抗凋亡蛋白Bcl-2 mRNA表达,PQS+H/R组心肌细胞Bcl-2 mRNA表达较H/R组升高30.9%(P<0.05);抑制促凋亡蛋白Bax mRNA的表达,Bax mRNA表达较H/R组降低39.7%(P<0.05),见图2A、B。
表2 PQS预处理对H/R后细胞存活率及LDH活性的影响Table 2.Effect of PQS preconditioning on survival rates and LDH activity of cardiomyocytes after H/R(.n=4)

表2 PQS预处理对H/R后细胞存活率及LDH活性的影响Table 2.Effect of PQS preconditioning on survival rates and LDH activity of cardiomyocytes after H/R(.n=4)
*P<0.05 vs control;#P<0.05 vs H/R.H/R:hypoxia/reoxygenation;PQS:Panax quinquelium saponin.
Group Cell survival rate(%) LDH activity(U/L)Control 96.29±0.79 113.40±11.87 H/R 75.36±2.32* 671.33±46.62*160 mg/L PQS+H/R 95.47±0.53# 224.33±22.57*#
Western blotting的结果显示,H/R组Bcl-2蛋白表达较对照组降低58.3%(P<0.05),Bax蛋白表达较对照组升高167.0%(P<0.05),提示H/R可诱导抗凋亡蛋白Bcl-2和抑制促凋亡蛋白Bax蛋白表达。PQS可诱导H/R后抗凋亡蛋白Bcl-2的表达,PQS+H/R组心肌细胞Bcl-2蛋白表达较H/R组升高48.0%(P<0.05);抑制促凋亡蛋白Bax的表达,较H/R组降低48.4%(P<0.05),见图2C、D。
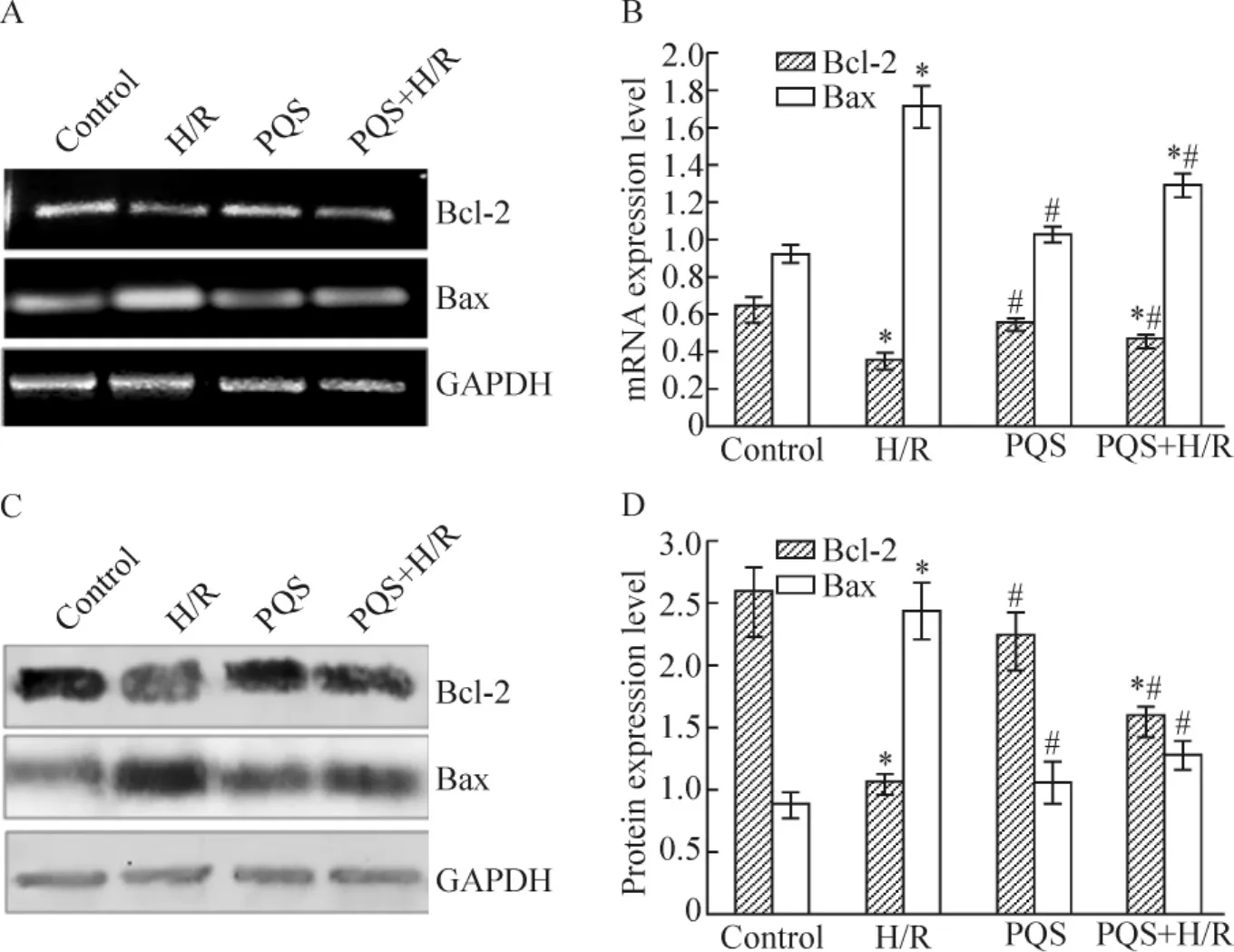
Figure 2.Panax quinquefolium saponin(PQS)reduced the expression of pro-apoptotic protein Bax and increased expression of anti-apoptotic protein Bcl-2 in H/R-treated cardiomyocytes.A:the levels of Bcl-2 and Bax mRNA were examined by RT-PCR.GAPDH was used as a normalization control.B:bar chart of densitometry of the bands shown in A.C:the levels of Bcl-2 and Bax protein were examined by Western blotting.GAPDH was used as a normalization control.D:bar chart of densitometry of the bands shown in C..n=3.*P<0.05 vs control;#P<0.05 vs H/R.图2 PQS对H/R心肌细胞Bcl-2和Bax表达的影响
2 西洋参茎叶总皂苷对H/R心肌细胞内质网应激相关分子表达的影响
2.1 GRP78、CRT mRNA和蛋白表达的变化 RTPCR的结果显示,H/R可明显诱导GRP78和CRT mRNA的表达,较对照组分别高380.0%和96.0%(P<0.05);PQS可抑制H/R诱导的GRP78和CRT mRNA的表达,PQS+H/R组较H/R组分别降低61.6%和35.7%(P<0.05)。Western blotting的结果显示,H/R可明显诱导GRP78和CRT蛋白的表达,较对照组分别升高142.0%和312.0%(P<0.05);PQS可抑制H/R诱导的GRP78和CRT蛋白表达,较H/R组分别降低37.7%和52.2%(P<0.05),见图 3。
2.2 CHOP mRNA和蛋白表达的变化 RT-PCR的结果显示,H/R可明显诱导心肌细胞CHOP mRNA的表达,较对照组高311.0%(P<0.05);PQS可抑制H/R后的CHOP mRNA表达,PQS+H/R组心肌细胞CHOP mRNA表达较H/R心肌细胞降低57.0%(P<0.05);Western blotting结果显示,H/R可明显诱导CHOP蛋白表达,较对照组升高219.0%(P<0.05);PQS抑制H/R后的CHOP蛋白的表达,PQS+H/R组心肌细胞CHOP蛋白表达较H/R组降低51.7%(P <0.05),见图4A、B。

Figure 3.Effect of Panax quinquefolium saponin(PQS)on the expression of GRP78 and CRT in H/R-treated cardiomyocytes.A:the levels of GRP78 and CRT mRNA were examined by RT-PCR.GAPDH was used as a normalization control.B:bar chart of densitometry of the bands shown in A.C:the levels of GRP78 and CRT protein were examined by Western blotting.GAPDH was used as a normalization control.D:bar chart of densitometry of the bands shown in C..n=3.*P<0.05 vs control;#P<0.05 vs H/R.图3 PQS对H/R心肌细胞GRP78、CRT表达的影响
2.3 Capase-12蛋白表达的变化 采用可同时识别caspase-12酶原(pro-caspase-12,分子量约48~50 kD)和剪切后的caspase-12(cleaved caspase-12,分子量36 kD)的特异性抗体,进行免疫印迹检测,结果显示H/R可明显诱导caspase-12蛋白剪切活化,较对照组升高180.0%(P<0.05);PQS抑制H/R后caspase-12蛋白活化,以160 mg/L PQS培养液培养24 h,剪切后caspase-12蛋白表达较H/R心肌细胞降低34.9%(P <0.05),见图4C、D。
3 CHOP蛋白表达与凋亡调节因子Bcl-2、Bax蛋白表达的相关性分析
相关性分析显示,ERS凋亡分子CHOP蛋白表达与促凋亡因子Bax蛋白表达显著正相关 (r=0.956,P<0.05),与抗凋亡因子Bcl-2蛋白表达显著负相关 (r=-0.967,P<0.05)。
讨 论
缺血再灌注 (ischemia/reperfusion,I/R)损伤指缺血一定时间的心肌恢复灌流后,组织损伤反而进行性加重,心肌细胞从可逆损伤转变为不可逆损伤的现象。心肌细胞坏死和凋亡是心肌I/R损伤的特征之一[11]。Musat-Marcu 等[12]在离体灌流大鼠心脏上发现,再灌注早期即可发生心肌细胞凋亡。其中抗凋亡蛋白Bcl-2与促凋亡蛋白Bax参与了心肌I/R损伤中细胞凋亡的调控[13]。本研究利用乳鼠心肌细胞H/R模型,采用LDH活性检测法、台盼蓝排斥实验、流式细胞术以及RT-PCR和Western blotting方法,证实PQS能明显减轻H/R诱导的心肌细胞损伤和凋亡。H/R前以160 mg/L PQS培养液培养细胞24 h,与H/R心肌细胞相比,细胞凋亡率、LDH活性以及促凋亡蛋白Bax mRNA和蛋白的表达均明显降低,而细胞存活率及抗凋亡蛋白Bcl-2 mRNA和蛋白的表达显著升高。
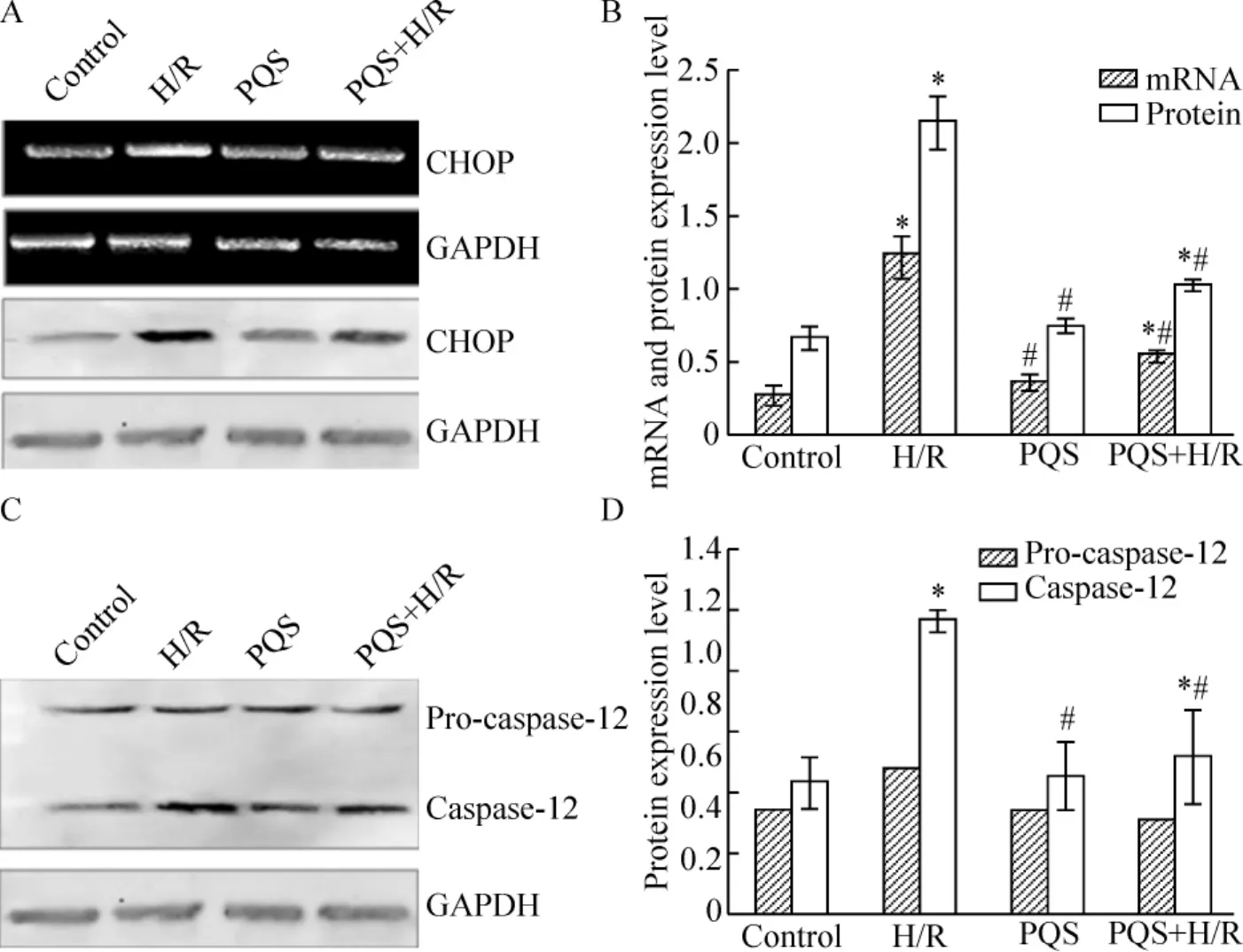
Figure 4.Effect of Panax quinquefolium saponin(PQS)on the expression of the ERS-associated apoptotic protein CHOP and activation of the apoptotic effector enzyme caspase-12 in H/R-induced cardiomyocytes.A:the levels of CHOP mRNA and protein were examined by RT-PCR and Western blotting.GAPDH was used as a normalization control.B:bar chart of densitometry of the bands shown in A.C:Western blotting analysis of caspase-12 activation in cardiomyocytes.GAPDH was used as a normalization control.D:bar chart of densitometry of the bands shown in C..n=3.*P<0.05 vs control;#P<0.05 vs H/R.图4 PQS对H/R心肌细胞后CHOP表达的影响
I/R发生的主要环节是氧自由基产生和钙超载,其机制尚未完全阐明,ER是调节Ca2+和蛋白质合成的重要场所,因此ER理化环境改变和ER过负荷等因素导致的ERS在I/R损伤的发生发展中具有重要意义[14-15]。ERS是细胞对刺激的适应性反应,一定程度的ERS诱导GRP78、CRT等内质网伴侣分子表达上调[16],增强 ER处理未折叠蛋白的能力,促进ER功能恢复。但H/R触发的严重ERS可显著增加GRP78和 CRT的蛋白表达[17-18],诱导 CHOP、caspase-12等促凋亡因子的表达及活化,触发ERS相关凋亡途径,诱导细胞凋亡和组织损伤[19-20]。本研究发现H/R前以160 mg/L的PQS培养液培养心肌细胞24 h,可显著抑制H/R诱导的GRP78、CRT mRNA和蛋白表达,提示PQS可能通过减轻H/R诱导的严重ERS触发的细胞凋亡,起到心肌保护作用;CHOP通过直接调节核内靶基因,增加细胞对ERS介导凋亡的敏感性,促进细胞凋亡[21]。CHOP介导的凋亡信号通路与线粒体凋亡途径有密切联系,CHOP可通过下调Bcl-2蛋白表达而促进细胞凋亡,并导致Bax从胞浆内向线粒体内易位[22]。本研究发现,H/R前以160 mg/L的PQS培养液培养心肌细胞24 h,可显著抑制H/R诱导的 CHOP mRNA和蛋白表达;在此基础上对CHOP蛋白表达与凋亡调节因子Bcl-2、Bax蛋白表达之间进行相关分析发现CHOP蛋白表达与Bax蛋白表达呈正相关,与Bcl-2蛋白表达呈负相关,提示CHOP介导的凋亡信号通路可能通过抑制Bcl-2和促进Bax蛋白表达,引起细胞凋亡,与以往文献报道一致[23-24],由此推测PQS可能通过抑制过度ERS介导的细胞凋亡起到心肌保护作用;caspase-12是内质网膜上的组成性蛋白,以无活性酶原形式存在于ER膜胞浆侧,在ERS时被剪切激活,cleaved caspase-12通过激活caspase-9、caspase-3 引起细胞凋亡[25],因而caspase-12被认为是内质网凋亡信号通路的关键分子。本研究发现,H/R明显诱导心肌细胞cleaved caspase-12蛋白表达并引起细胞凋亡,与以往文献报道一致[26]。H/R前以160 mg/L PQS培养液培养24 h,可显著抑制H/R诱导的cleaved caspase-12的蛋白表达,提示PQS可能通过抑制caspase-12介导的内质网相关凋亡发挥心肌保护作用。
综上所述,我们认为PQS通过抑制过度ERS发挥抗心肌细胞H/R损伤作用,表现为降低H/R诱导的 GRP78、CRT mRNA和蛋白表达,抑制 CHOP、caspase-12等内质网凋亡通路激活。但PQS对在体大鼠心肌缺血/再灌注损伤的心肌保护作用尚待进一步研究。
[1]曹 霞,谷欣权,陈燕萍,等.西洋参茎叶三醇组皂苷对缺血再灌注损伤心肌的保护作用[J].中国老年学杂志,2004,24(7):654-655.
[2]殷惠军,张 颖,蒋跃绒,等.西洋参叶总皂苷对急性心肌梗死大鼠心肌细胞凋亡及凋亡相关基因表达的影响[J].中国中西医结合杂志,2005,25(3):232-235.
[3]关利新,衣 欣,杨世杰,等.西洋参茎叶皂苷对大鼠心肌细胞Ca2+内流的影响[J].中国药理与临床,2004,20(6):8-9.
[4]鞠传静,张志国,赵学忠,等.西洋参叶二醇组皂苷对大鼠实验性心室重构的保护作用[J].中国老年学杂志,2007,27(22):2173-2175.
[5]Boya P,Cohen I,Zamzami N,et al.Endoplasmic reticulum stress induced cell death requires mitochondrial membrane permeabilization[J].Cell Death Differ,2002,9(4):465-467.
[6]Breckenridge DG,Germain M,Mathai JP,et al.Regulation of apoptosis by endoplasmic reticulum pathways[J].Oncogene,2003,22(53):8608-86l8.
[7]Simpson P,Savion S.Differentiation of rat myocytes in single cell cultures with and without proliferating nonmyocardial cells.Cross-striations,ultrastructure,and chronotropic response to isoproterenol[J].Circ Res,1982,50(1):101-116.
[8]Li YZ,Liu XH,Rong F.Puma mediates the apoptotic signal of hypoxia/reoxygenation in cardiomyocytes through mitochondrial pathway[J].Shock,2011,35(6):579-584.
[9]Rabkin SW,Kong JY.Nitroprusside induces cardiomyocyte death:interaction with hydrogen peroxide[J].Am J Physiol Heart Circ Physiol,2000,279(6):H3089-H3100.
[10]Liu X,Wu X,Han Y,et al.Signal pathway of cardioprotection induced by monophosphoryl lipid A in rabbit myocardium[J].Pathophysiology,2002,8(3):193-196.
[11]Fliss H,Gattinger D.Apoptosis in ischemic and reperfused rat myocardium[J].Circ Res,1996,79(5):949-956.
[12]Musat-Marcu S,Gunter HE,Jugdutt BI,et al.Inhibition of apoptosis after ischemia-reperfusion in rat myocardium by cycloheximide[J].J Mol Cell Cardiol,1999,31(5):1073-1082.
[13]Borutaite V,Brown GC.Mitochondria in apoptosis of ischemic heart[J].FEBS Lett,2003,541(1-3):1-5.
[14]Shibata M,Hattori H,Sasaki T,et al.Activation of caspase-12 by endoplasmic reticulum stress induced by transient middle cerebral artery occlusion in mice[J].Neuroscience,2003,118(2):491-499.
[15]Vilatoba M,Eckstein C,Bilbao G,et al.Sodium 4-phenylbutyrate protects against liver ischemia reperfusion injury by inhibition of endoplasmic reticulum stress-mediated apoptosis[J].Surgery,2005,138(2):342-351.
[16]Kaufman RJ.Stress signaling from the lumen of the endoplasmic reticolum:coordination of gene transcriptional and translational controls[J].Gene Dev,1999,13(10):1211-1233.
[17]Ma QB,Gao W,Guo YH,et al.Hypoxia/reoxygenation induced endoplasmic reticulum stress in cultured neonatal rat cardiomyocyte[J].J Peking Univ(Health Sci),2005,37(4):386-388.
[18]祝筱梅,刘秀华,蔡莉蓉,等.P38丝裂素活化蛋白激酶介导低氧预处理诱导的内质网应激相关的心肌细胞保护[J].生理学报,2006,58(5):463-470.
[19]Zhang PL,Lun M,Teng J,et al.Preinduced molecular chaperones in the endoplasmic reticulum protect cardiomyocytes from lethal injury[J].Ann Clin Lab Sci,2004,34(4):449-457.
[20]Oyadomari S,Mori M.Roles of CHOP/GADD153 in endoplasmic reticulum stress[J].Cell Death Differ,2004,11(4):381–389.
[21]Friedman AD.GADD153/CHOP,a DNA damage-inducible protein,reduced CAAT/enhancer binding protein activities and increased apoptosis in 32D c13 myeloid cells[J].Cancer Res,1996,56(14):3250-3256.
[22]McCullough KD,Martindale JL,KlotzLO,etal.Gadd153 sensitizes cells to endoplasmic reticulum stress by down-regulating Bcl-2 and perturbing the cellular redox state[J].Mol Cell Biol,2001,21(4):1249-1259.
[23]Nieto-Miguel T,Fonteriz RI,Vay L,et al.Endoplasmic reticulum stress in the proapoptotic action of edelfosine in solid tumor cells[J].Cancer Res,2007,67(21):10368-10378.
[24]Gotoh T,Terada K,Oyadomari S,et al.hsp70-DnaJ chaperone pair prevents nitric oxide-and CHOP-induced apoptosis by inhibiting translocation of Bax to mitochondria[J].Cell Death Differ,2004,11(4):390-402.
[25]Nakagawa T,Zhu H,Morishima N,et al.Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid- β[J].Nature,2000,403(6765):98-103.
[26]祝筱梅,刘秀华,蔡莉蓉.缺氧后处理对缺氧/复氧心肌细胞的保护作用及其机理研究[J].中国微循环,2007,11(4):223-230.
——疾病防治的新靶标

