应用链脲左菌素构建SD大鼠2型糖尿病模型效果的研究
王 艳,刘 蔚,王 征
(湖南农业大学生物科学技术学院,湖南 长沙 410128)
糖尿病(diabetes mellitus,DM)是一种与遗传因素相关联的全身慢性分泌代谢疾病,表现为体内胰岛素的绝对或相对不足而引起糖、脂肪、蛋白质的代谢紊乱。糖尿病分为1型与2型,1型糖尿病(DM1)由胰岛素绝对不足引起,2型糖尿病(DM2)是指以胰岛素分泌缺陷和胰岛素抵抗为主要病理生理基础和显著特征,导致体内葡萄糖和脂质代谢紊乱的一类糖尿病[1]。而2型糖尿病是糖尿病人群的主体,占糖尿病发病率的90%以上。因此,建立2型糖尿病的动物模型,用以研究2型糖尿病致病机理及筛选治疗2型糖尿病药物具有极其重要的意义。试验采用高糖高脂饮食,再结合链脲佐菌素(STZ,35 mg/kg)腹腔注射,在较短时间内成功构建了T2DM SD大鼠模型,并连续监测该模型大鼠动态血糖的变化规律。
1 材料与方法
1.1 试验动物和材料
雌性SD大鼠20只,SPF级,4周龄,体重100~130 g(湖南斯莱克景达公司,合格证号:HNASLKJ20101790);高脂饲料配方[2]:普通饲料68.5%、猪油10%、蔗糖20%、猪胆盐0.5%、胆固醇1%(中南大学湘雅附一);STZ(美国sigma公司),大鼠ELISA试剂盒(美国RD进口分装),罗康全优越型血糖试纸(德国罗氏诊断公司)。
1.2 方法
1.2.1 2型糖尿病大鼠模型的建立 实验性2型糖尿病模型参考袁琼等[2]、施红[3]、李雅晶等[4]的方法略加改进。SD大鼠20只,动物房饲养,自由饮水、摄食,室温控制在20~24℃,明暗周期12 h。 适应性喂养7 d后,随机分为对照组(NC,n=8)和2型糖尿病模型组(DM,n=12)。试验期间,对照组饲以普通饲料,模形组饲以高脂饲料。4周后,所有大鼠禁食12 h,模形组以小剂量链脲佐菌素(STZ,35 mg/kg)腹腔注射,72 h后测定空腹血糖,选择FBG≥11.1 mmol/L为2型糖尿病模型的合格标准[3]。对照组腹腔注射等体积柠檬酸钠+柠檬酸钠缓冲液,并连续3周监测2型糖尿病大鼠空腹血糖的动态变化。
1.2.2 口服糖耐量试验 大鼠禁食过夜,单次灌胃葡萄糖 2.5 g/kg,分别在 0、0.5、1.0、2 h 尾静脉取血检测血糖。
1.2.3 血清胰岛素(FINS)检测 试验结束时,大鼠过夜禁食12 h,次日上午眼球取血,3000 r/min离心10 min,取上清血测空腹血糖(FBG)及空腹胰岛素(FINS),FINS用ELISA试剂盒测,并计算各自胰岛素敏感指数ISI=Ln[1/FBG×FINS]及胰岛素抵抗指数 HOMA-IR=(FBG×FINS)/22.5
1.2.4 大鼠胰腺组织形态学检测 8周后采用眼球取血将全部大鼠处死,立即解剖取胰腺组织,以10%中性的甲醛溶液固定,石蜡包埋、切片,HE染色,光镜下观察组织形态学变化。
1.3 数据分析
所有数据采用SPSS16.0软件进行统计学分析,组间差异比较采用t检验。p<0.05,表示差异有统计学意义。
2 结果
2.1 糖耐量试验结果
糖耐量试验表明,试验以第8周未时,灌胃葡萄糖并分别于0、0.5、1、2 h后取样测定血糖,与对照组相比,模型组血糖显著高于对照组,且均具有极显著性差异(图1)。

图1 糖耐量试验
2.2 腹腔注射STZ后FBG的变化
由图2可知,整体来看,模型组FBG程上升趋势,注射STZ 17 d后,血糖含量基本稳定,这说明该模型FBG相对保持稳定。且在注射STZ 3、10、17 d后FBG极显著高于对照组,

图2 腹腔注射STZ后FBG的变化
2.3 2型糖尿病大鼠胰岛素敏感性变化
由表1可知,与对照组相比,模型组的胰岛素和胰岛素抵抗指数显著增加(p<0.01),胰岛素敏感指数显著下降(p<0.01),这说明了模型组大鼠产生了胰岛素抵抗。

表1
2.4 2型糖尿病大鼠的成模率
12只用于造模的SD大鼠,有10只大鼠FBG≥11.1 mmol/L,成模率为83.3%。
2.5 大鼠胰腺组织形态的变化
从图3、图4中可以看出,与对照组相比,模型组大鼠胰腺组织结构散乱,胰岛细胞数目减少伴萎缩,胰腺胰岛细胞核不清晰,核质颜色变淡,胰岛内β细胞有严重的脱颗粒现象,少数细胞塌陷、缺失,排列不规则。
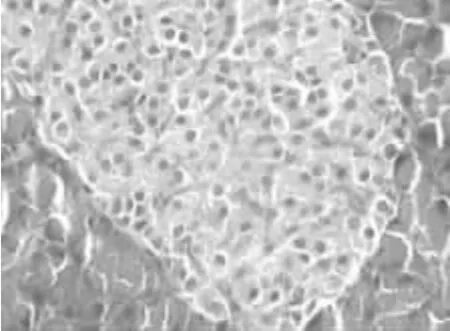
图3 对照组胰腺组织(HE×400)

图4 模型组胰腺组织(HE×400)
3 讨论
胰岛素抵抗(IR)是T2DM发病机制的基本环节和其代射疾病的生理基础,表现为胰岛素敏感性下降和胰岛素抵抗增加,很多研究表明,高脂饮食是胰岛素抵抗和T2DM发生的重要因素[5-6],STZ注射和高糖高脂喂养是形成T2DM模型的重要条件,所以在同时进行小剂量注射STZ造成的胰岛β细胞轻度损伤的情况下,使多数动物产生糖耐量异常,再继续饲以高糖高脂饲料,进而复制出T2DM大鼠模型。STZ诱导的糖尿病因给药方式、剂量不同,其成模效果也有所差别,STZ注射剂量15~50 mg/kg均有报道[7],造成较大差别的原因很多,但最有可能的是高糖高脂喂养的时间,喂养的时间越长,所需的STZ剂量就越少[8],如高脂4周时,袁琼等所用的剂量是35 mg/kg[2],两周高脂饲养时,REED所用的STZ剂量为50 mg/kg[9]。虽然理论上高脂高糖饲养时间长短与STZ剂量大小关系很大,但考虑到动物的年龄以及造模后续的试验还需要一定的时间,因此,建议高脂高糖饲养时间4周左右为宜。另一个重要的原因是STZ的给药途径,有研究表明腹腔注射与尾静脉注射两种途径在诱导试验性糖尿病动物模型无显著差异[10],因此选用35 mg/kg的STZ腹腔注射,对SD大鼠进行研究。
从试验结果看,STZ注射后动物血糖升高,糖耐量异常;从胰岛病理改变观察看到胰岛细胞数目减少伴萎缩,从而导致胰岛素敏感性下降,使动物产生T2DM,说明此建模方法是成功的。
为了证实成模后T2DM模型大鼠FBG的稳定性,又连续监测STZ注射后17 d其血糖动态变化情况。结果发现,T2DM模型大鼠FBG在STZ注射后10 d内具有波动性。但STZ注射17 d后FBG基本趋于稳定。
试验证实,该模型发病过程类似人类T2DM。该实验操作方法简便、周期短、注射STZ量少,减少对动物的损伤和节约成本,高血糖形成较快、成模率较高,且成模后17 d内大鼠FBG的稳定性较好。因此,该方法构建的T2DM动物模型可以很好地应用于各种相关的糖尿病试验研究。
[1]Donath M Y,Shoelson S E.Type 2 diabetes as an inflammatory disease[J].Nature Reviews Immunology 2011,(11):98-107.
[2]袁 琼,刘思妤,邹晓青,等.白藜芦醇衍生物改善2型糖尿病大鼠血糖及胰岛素抵抗作用的研究[J].中南药学,2010,8(3):161-165.
[3]施 红,金国琴,余文珍.诱导构建最佳类似人类2型糖尿病大鼠的造模方式[J].中国临床康复,2005,9(39):69-71.
[4]李雅晶,茹建甫.蜂胶桑叶复合片对2型糖尿病病人糖脂代谢的调节作用[J].安徽农业科学,2010,38(36):20611-20613
[5]Kim C H,Park J Y,Youn J H,et al,Effects of high-fat diet and exercise training on intracellular glucose metabolism in rats[J].Am J Physiol Endocrinol Metab,2000,278:977-984.
[6]Storlien L H,Baur L A,Kriketoes A D,et.Al.Dietary fats and insulin action[J].Diabetologia,1997,39:621-631.
[7]郭延敏.体重和剂量对链脲佐菌素致糖尿病小鼠模型影响的研究[J].畜牧与饲料科学,2011,32(12):17-18.
[8]向雪松,王 竹,祝宇铭,等,链脲佐菌素注射剂量对建立2型糖尿病大鼠模型的影响[J].卫生研究,2010,39(2):138-142.
[9]Reed M J,Meszaros K,Entes L J,et al.A new rat model of type 2 diabetes:the fat-fed,streptozotocin-treated rat[J].Metabolism,2000,49(11):1390-1394.
[10]沈亚非,徐焱成.链脲佐菌素诱导实验性糖尿病模型建立的研究[J].实用诊断与治疗杂志,2005,19(2):79-83.

