脂肪干细胞研究进展
吴海涛
(南京中医药大学基础医学院,江苏 南京 210046)
长期以来,脂肪组织被认为是惰性组织,主要致力于能量储存与释放。近年的研究表明,脂肪组织不仅参与内分泌和免疫调控,还含有具备多向分化潜能的多能干细胞。2004年国际脂肪应用技术协会 (International Fat Applied Technology Society)将此干细胞命名为脂肪来源干细胞(Adipose-derived Stem Cell,ASC)[1],因为来源于中胚层间充质,也常将其称为脂肪间充质干细胞(Adipose-derived Mesenchymal Stem Cell,AMSC)。
目前常用的干细胞包括胚胎干细胞、成体干细胞、诱导多能干细胞。因为面临伦理、法律和政治争议,人体胚胎干细胞一般不可用于当前的医疗实践。中胚层来源的骨髓干细胞是最早研究的成体多能干细胞,已广泛用于组织工程,但它来源有限,抽取骨髓时有疼痛,而且从骨髓组织中提取的干细胞比例非常低(大约每105个黏附间质细胞可获得1个干细胞);脐带血干细胞也属于成体多能干细胞,其分化潜能低于骨髓干细胞,且需要长期保存;而脂肪干细胞可以从脂肪组织抽吸物中大量分离获取,而且容易培养、生长速度快、衰老也比骨髓干细胞慢,另外,其致病性低、分化稳定、移植安全的特点使其成为基础和临床研究中理想的成体干细胞。
1 脂肪干细胞的分离
吸脂术产生的脂肪吸取物是自体ASC的理想来源,从脂肪吸取物原代培养得到的细胞称为脂肪基质微管碎片细胞(SVF),这种细胞不仅含有脂肪干细胞,还包括内皮细胞、平滑肌细胞、周细胞、成纤维细胞、白细胞、造血干细胞、内皮祖细胞等[2]。在细胞培养过程中,ASC 通过与塑料培养皿粘附而与其它细胞分离[3],但是成纤维细胞也会和塑料培养皿壁粘附,所以,一些批评意见指出,如果存在造血干细胞污染,那么细胞分化的来源就不是单一的。
2 脂肪干细胞的培养特性
骨髓干细胞对胎牛血清的来源和质量有严格要求,而脂肪干细胞在添加任何批号胎牛血清的DMEM 培养基中均能很好地扩增,细胞形态成纤维状,传代培养平均倍增时间为60小时,并且保持稳定的倍增率直至13~15 代,其中衰老和死亡细胞的比例也很低,这表明ASC 体外扩增能力很强,易于获得大量有分化能力的细胞。但是Rubio 等人发现[4],人类ASC 连续增殖传代超过4个月后,将出现恶变现象,提示新提取的ASC 较培养传代后的ASC 更安全、更适合用于临床。
3 脂肪干细胞表面的分子标记
特异性细胞表面的分子标记有助于ASC的纯化、鉴定以及进一步研究,但大量实验结果表明ASC 细胞表面分子标记存在异质性[5],不同研究小组报道的分子标记有差异,这与ASC 细胞纯化和培养方法不同以及分子标记检测时细胞处于不同的阶段有关。
大多数研究人员通过原代培养得到的SVF 细胞是异源的细胞混合物,其中的ASC 会通过和塑料培养皿壁粘附而与其他细胞分离,所以伴随细胞生长、传代,造血干细胞的分子标记CD11、CD14、CD45 会逐步丧失[6];而利用塑料培养皿进行ASC培养时,一些分子标记也极易发生变化,比如粘附分子;研究还表明ASC 和骨髓干细胞有相似的分子标记[7],一些骨髓干细胞分子标记也可以作为ASC的分子标记,比如STRO1、CD73[8],但是它们仍然不是特异性分子标记。不过已有实验结果表明ASC细胞是SVF 细胞中的CD34+、CD31-细胞群[9]。但目前ASC 细胞仍然只能通过功能实验或者后续的分化结果加以确切鉴定。
4 脂肪干细胞的多向诱导分化
多能ASC 细胞可以分化为多种中胚层来源的细胞类型,包括骨骼肌、心肌、软骨、脂肪、成骨等分化方向,其中心肌分化的重复性和产量是最低的[10]。在软骨分化方面,ASC 不如骨髓干细胞有效[11]。来源于中胚层的脂肪干细胞分化为外胚层起源的神经细胞[12]和内胚层起源的胰腺表型细胞[13]是非常令人惊奇的,而且脂肪干细胞可能还有助于血管[14]和造血细胞的生成[7]。
ASC 在不同成分的培养基中培养,其生长和分化存在极大的差异,比如牛血清促进细胞生长,马血清则有助于细胞分化;转化生长因子β、纤维生长因子2 增强ASC 细胞增殖却对分化没有作用,表皮生长因子被证实是抗分化因子;体外ASC 向不同细胞类型分化依赖于培养基中不同的添加剂,比如在含有地塞米松、β-甘油磷酸钠、L-谷氨酰胺和维生素C的培养基中,ASC 经过3~4周培养可以产生成骨反应;添加胰岛素、地塞米松、吲哚美辛、异丁基-甲基黄嘌呤的DMEM 培养液,可诱导ASC分化为脂肪细胞,其它分化方向的诱导条件见表1。另外,在组织工程领域,理想的支架有利于细胞贴附、生长和分化,最终形成组织。比如结合于胶原微球支架的ASC 可以表现出成骨与成脂方向的分化与增殖[15],结合有硫酸软骨素的聚乙二醇水凝胶也被应用于促进ASC分化为软骨细胞[16]。
5 脂肪干细胞的应用研究
体外扩增的ASC 与生物材料结合,是实现修复较大器官组织缺损,重建缺损部位生理功能的新途径。但是目前脂肪干细胞的应用研究多是个案报道,临床研究也处于Ⅰ期临床的早期。以下对脂肪干细胞在不同方向的应用研究作简要阐述。
ASC 在分化为脂肪细胞的同时,还有助于血管生成,可以明显提高脂肪移植后的长期存活率,ASC的成脂分化在面部轮廓整形、除皱等软组织重建中发挥着重要的作用。
成熟脂肪细胞及其前体细胞均表达单纯疱疹病毒的受体,体内和体外实验证明复制缺陷的单纯疱疹病毒可以有效转染脂肪细胞,携带的外源基因在脂肪细胞中亦能稳定表达。故以脂肪细胞为靶细胞,复制缺陷单纯疱疹病毒介导的基因转移有可能成为基因治疗的一种方式[17]。
ASC的成骨分化,在临床上可用于骨折和关节植骨融合的治疗。2003年首次实验证明将体外成骨分化后的大鼠ASC,重新植入皮下,8周后有骨骼形成[18];2004年德国MacroPore Biosurgery 公司与德国Giessen 大学联合对外公布了一项使用脂肪干细胞治疗一名七岁女孩颅骨缺损的临床报告。在这项手术中,因骨伤面积接近120 cm2,髂嵴来源的骨数量有限,自体脂肪组织干细胞被加入到患者髂嵴移植骨,然后均匀地敷在颅骨缺损部位,并固定两片可降解的MacroPoreTM 保护膜,3个月后CT分析显示新骨形成,并且颅骨创伤区周围颅顶几近完全连续[19]。
Rodriguez 等将正常人ASC 移植到Duchenne 型肌营养不良模型小鼠(抗肌营养不良蛋白缺陷)的胫骨前肌,6个月后,90%的胫骨前肌检测到抗肌营养不良蛋白表达,50天时,在相邻腓肠肌发现由胫骨前肌迁移而来的抗肌营养不良蛋白阳性肌纤维[20]。
注射ASC 到裸鼠缺血的后肢,后肢血流量和毛细血管密度明显增加[14]。这和ASC分泌血管内皮生长因子、肝细胞生长因子、肿瘤坏死因子β[14]等血管生成因子有关,不太可能是ASC直接分化为血管内皮细胞。有报道指出,使用自体脂肪移植治疗20 位放疗后期因慢性组织缺血导致并发症的患者,都表现出新血管形成等进行性组织再生现象[21]。尽管机制仍不明了,但这种方法也有可能用于治疗微血管病变。
ASC 能表达、分泌巨噬细胞集落刺激因子和粒细胞巨噬细胞集落刺激因子等造血相关细胞因子[7]。2003年报道腹腔注射ASC 可以挽救40%被辐射小鼠的生命,虽然效果较骨髓干细胞慢,但存活率和骨髓干细胞一样;文章分析认为,ASC 促进了骨髓造血干细胞的增殖[22],不过脂肪干细胞静脉注射会出现辐射小鼠死亡[22]的现象。
脂肪干细胞用于治疗复发性克罗恩瘘(recurrent Crohn’s f istulae)的Ⅰ期临床已在马德里LaPazUniversityHospital 进行[23],4位患者的9 处瘘管进行自体ASC 接种治疗,在每周随访的8 处瘘管中,6 处瘘管(75%)在8周内完全治愈,无副作用发现,更多评价还有待于Ⅱ期临床试验的进行。
6 ASC 研究需要解决的问题
尽管有报道称ASC 用于人体是安全的[24],但是,也有研究指出植入ASC 会导致机体出现免疫抑制[19],显然这个问题需要进行大规模的临床实验加以证实。
除此之外,以下一些问题的解决将有助于ASC 在临床实践中的应用。首先,特异性分子标记的发现可以从根本上改变ASC 细胞的纯化和鉴定。其次,要建立可靠、快速、有效的细胞分化方案。ASC 脂肪分化大约需要两周时间,成骨和软骨分化时间更长且分化的细胞数量少。改进现有分化方法可从以下方面进行:不同细胞因子和生长因子的应用、利用可靠有效的生物材料进行3-D 培养、更清楚了解细胞分化相关的受体配体以及细胞外基质成分等。另外无血清细胞培养和分化方法的建立、可靠稳定的动物模型实验也是ASC 临床应用需要解决的问题。
令人鼓舞的是上述很多问题正在被解决,所以ASC 在未来临床实践中的广泛应用是令人期待的。
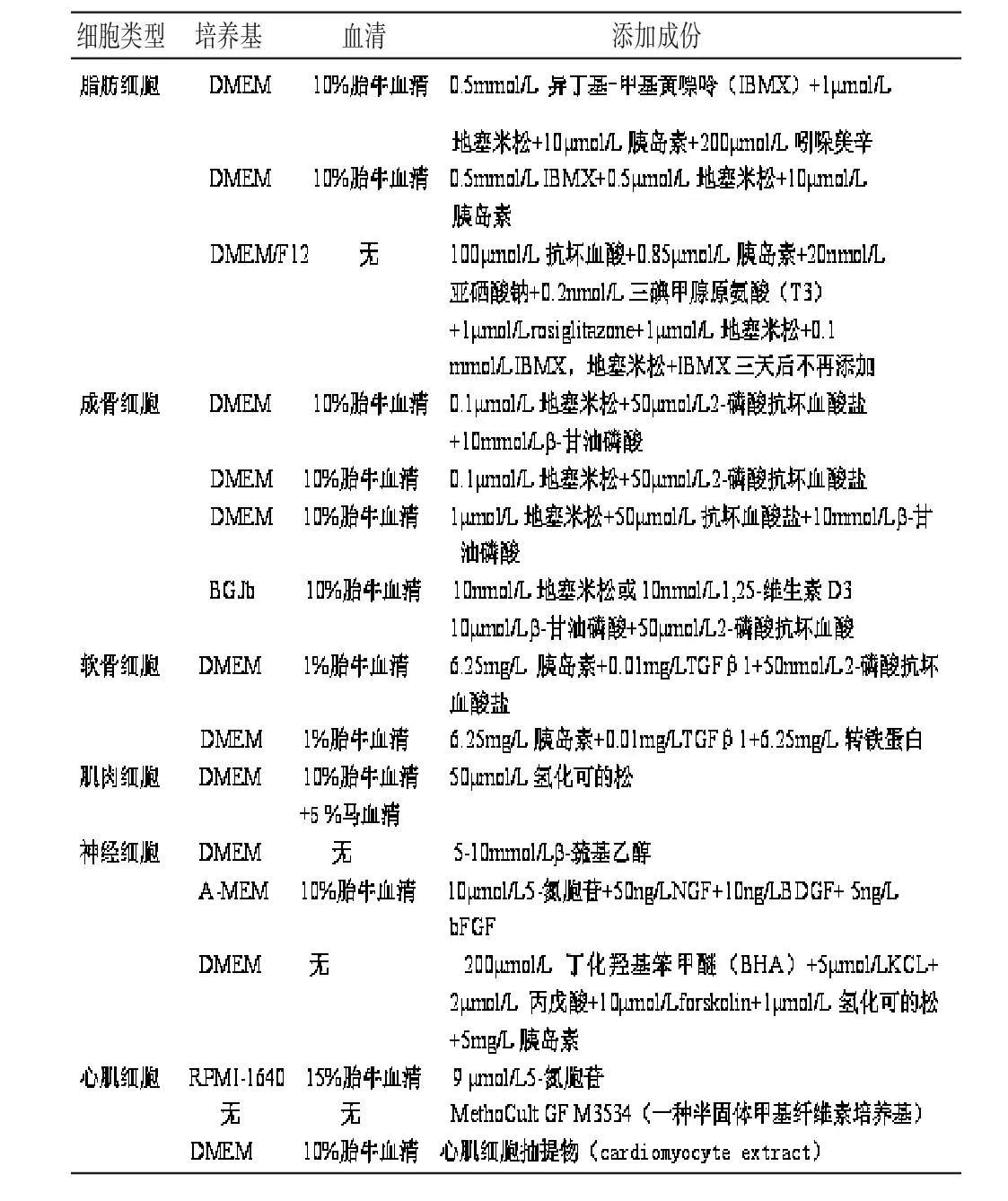
表1 ASC 向特异的细胞谱系分化的诱导条件
[1]Zuk PA.Consensus statement.In:International Fat Applied Technology Society 2nd International Meeting.Pittsburg,PA,2004.
[2]Tholpady SS,Llull R,Ogle RC,et al.Adipose tissue:stem cells and beyond[J].Clin Plast Surg,2006,33(1):55-62.
[3]Ogawa R.The importance of adipose-derived stem cells and vascularized tissue regeneration in the field of tissue transplantation[J].Curr Stem Cell Res Ther,2006,1(1):13-20.
[4]Rubio D,Garcia-Castro J,Mart ín MC,et al.Spontaneous human adult stem cell transformation[J].Cancer Res,2005,65(8):3035-3039.
[5]Gimble JM.Adipose tissue-derived therapeutics[J].Expert Opin Biol Ther,2003,3(5):705-713.
[6]Mitchell JB,McIntosh K,Zvonic S,et al.Immunophenotype of human adipose-derived cells:temporal changes in stromal-associated and stem cell-associated markers[J].Stem Cells,2006,24(2):376-385.
[7]Gimble JM,Guilak F.Differentiation potential of adipose derived adult stem(ADAS)cells[J].Curr.Top.Dev.Biol,2003(58):137-160.
[8]De Ugarte DA,Alfonso Z,Zuk PA,et al.Differential expression of stem cell mobilization-associated molecules on multi-lineage cells from
adipose tissue and bone marrow[J].Immunol Lett,2003,89(23):267-270.
[9]Varma MJ,Breuls RG,Schouten TE,et al.Phenotypical and functional characterization of freshly isolated adipose tissue-derived stem cells[J].Stem Cells Dev,2007,16(1):91-104.
[10]Tholpady SS,Llull R,Ogle RC,et al.Adipose tissue:stem cells and beyond[J].Clin Plast Surg,2006,33(1):55-62.
[11]Winter A,Breit S,Parsch D,et al.Cartilage-like gene expression in differentiated human stem cell spheroids:a comparison of bone marrowderived and adipose tissue-derived stromal cells[J].Arthritis Rheum,2003,48(2):418-429.
[12]Tholpady SS,Llull R,Ogle RC,et al.Adipose tissue:stem cells and beyond[J].Clin Plast Surg,2006,33(1):55-62.
[13]Timper K,Seboek D,Eberhardt M,et al.Human adipose tissue-derived mesenchymal stem cells differentiate into insulin,somatostatin,and glucagon expressing cells[J].Biochem Biophys Res Commun,2006,341(4):1135-1140.
[14]Rehman J,Traktuev D,Li J,et al.Secretion of angiogenic and antiapoptotic factors by human adipose stromal cells[J].Circulation,2004,109(10):1292-1298.
[15]Rubin JP,Bennett JM,Doctor JS,et al.Collagenous microbeads as a scaffold for tissue engineering with adipose-derived stem cells[J].Plast Reconstr Surg,2007,120(2):414-424.
[16]Varghese S,Hwang NS,Canver AC,et al.Chondroitin sulfate based niches for chondrogenic differentiation of mesenchymal stem cells[J].Matrix Biol,2008,27(1):12-21.
[17]Fradette J,Wolfe D,Goins WF,et al.HSV vector-mediated transduction and GDNF secretion from adipose cells[J].Gene Ther,2005,12(1):48-58.
[18]Lee JA,Parrett BM,Conejero JA,et al.Biological alchemy:engineering bone and fat from fat-derived stem cells[J].Ann Plast Surg,2003,50(6):610-617.
[19]Lendeckel S,J?dicke A,Christophis P,et al.Autologous stem cells(adipose)and fibrin glue used to treat widespread traumatic calvarial defects:case report[J].J Craniomaxillofac Surg,2004,32(6):370-373.
[20]Rodriguez AM,Pisani D,Dechesne CA,et al.Transplantation of a multipotent cell population from human adipose tissue induces dystrophin expression in the immunocompetent mdx mouse[J].J Exp Med,2005,201(9):1397-1405.
[21]Rigotti G,Marchi A,Gali è M,et al.Clinical treatment of radiotherapy tissue damage by lipoaspirate transplant:a healing process mediated by adipose-derived adult stem cells[J].Plast Reconstr Surg,2007,119(5):1409-1422.
[22]Cousin B,Andr é M,Arnaud E,et al.Reconstitution of lethally irradiated mice by cells isolated from adipose tissue[J].Biochem Biophys Res Commun,2003,301(4):1016-1022.
[23]Garc ía-Olmo D,Garc ía-Arranz M,Herreros D,et al.A phase in clinical trial of the treatment of Crohn's fistula by adipose mesenchymal stem cell transplantation[J].Dis Colon Rectum,2005,48(7):1416-1423.
[24]Garc ía-Olmo D,Garc ía-Arranz M,Garc ía LG,et al.Autologous stem cell transplantation for treatment of rectovaginal fistula in perianal Crohn's disease:a new cell-based therapy[J].Int J Colorectal Dis,2003,18(5):451-454.■

