小鼠骨髓间充质干细胞移植后在炎症性肠病模型的定位
陈倩倩,万 军,阎 丽,王卫华,王昌正,石 卉,苏斌斌,曾庆环,杜海涛
解放军总医院 南楼消化科,北京 100853
炎症性肠病(inflammatory bowel disease,IBD)包括溃疡性结肠炎(ulcerativecolitis,UC)和克罗恩病(Crohn′s disease,CD),是一种病因和发病机制尚未完全明了的慢性肠道炎性疾病,近年来其发病呈上升趋势。目前的治疗手段包括抗炎药物、激素、免疫抑制剂及生物治疗等,但疗效不佳。国外有报道[1]称造血干细胞移植治疗血液系统恶性肿瘤合并IBD的案例,移植后其IBD症状也随之得到缓解,这为IBD的治疗提供了一种新的选择。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)具有自我更新、多向分化功能,在特定条件下可诱导成为骨细胞、软骨细胞及脂肪细胞等,还可向神经细胞、心肌细胞、上皮细胞、血管内皮细胞分化[2]。本实验以2,4,6-三硝基苯磺酸(TNBS)作为灌肠剂,构建小鼠炎症性肠病模型,以小鼠的BMSCs为细胞源,经尾静脉途径进行移植,并观察其在肠道损伤部位的定植情况。
材料和方法
1 实验动物 BALB/C小鼠,6-8周龄,雌性,SPF级,用于制作IBD动物模型;BALB/C小鼠,2-3周龄,雄性,SPF级,用于提取骨髓间充质干细胞;均由军事医学科学院实验动物中心提供。
2 主要实验试剂及仪器 2,4,6-三硝基苯磺酸(Sigma公司);低糖改良Eagle完全培养基(Hyclone公司);0.25%胰蛋白酶+0.02% EDTA(Gibco公司);顶级胎牛血清(Gibco公司);油红-O(Sigma公司);茜素红S(Sigma公司);CFDA SE(上海奔大生物科技有限公司);DNA提取试剂盒(Omega公司);倒置相差荧光显微镜及照相系统(日本Olympus公司);PCR仪(Eppendorf公司)。
3 小鼠骨髓MSCs的分离培养[3]用断颈法处死小鼠,乙醇浸泡鼠体2min,在超净台中取出四肢骨并将其附着肌肉组织剥离干净,低糖改良Eagle完全培养基(LG-DMEM)浸泡。用1ml注射器分别在骨两端钻一小孔,用LG-DMEM反复冲洗骨髓腔至四肢骨干呈略带透明状,取出四肢骨用手术剪将其剪成1-3mm3的骨片后,将其移入5ml小瓶中并加入3ml LG-DMEM(含双抗)及1mg/ml(wt/vol)胶原酶Ⅱ,置于37℃恒温摇床上以200r/min速度摇1-2h后中止消化,并洗涤3次后加入6ml含10%胎牛血清(FBS)的LG-DMEM置于37℃,5%CO2饱和湿度细胞培养箱中静置培养。静置3d后首次换液,并除去未贴壁的细胞及骨组织。原代培养第5天进行传代,加入1ml 0.25%胰蛋白酶+0.02% EDTA,细胞培养箱中消化1min,以1∶2进行传代。此后每2d换1次液,待细胞生长满培养皿的80%-90%可进行传代。
4 小鼠骨髓MSCs的标记 取第3代BMSCs进行荧光标记,用1ml CFDA SE细胞标记液悬浮2×106/细胞,加入1ml CFDA SE储存液(2×),37℃孵育10min后加入完全细胞培养液(含血清)终止,PBS洗涤2次后,用2ml PBS重悬细胞,备用;经过标记的细胞可按正常方法进行培养,在荧光显微镜下直接观察标记效果。
5 IBD模型构建及分组 参考文献[4]方法加以改进:将小鼠随机分为3组:对照组(n=12):给予0.9%氯化钠溶液100µl灌肠后第2天给予尾静脉移植BMSCs;TNBS组(n=12):给予TNBS 2.0mg/50%乙醇灌肠剂 100µl;TNBS-MSCs移植组(n=12):给予TNBS 2.0mg/50%乙醇灌肠剂100µl,并于造模后第2天给予尾静脉移植BMSCs。小鼠禁食不禁饮,48h后称重。用左手固定小鼠,右手将2.5cm静脉留置针经小鼠肛门轻轻插入结肠,至套管顶端距离肛门约2.5cm,立即将连有1ml注射器的套管针内芯插入套管,使小鼠倒立,分别缓缓注入TNBS 2.0mg/50%乙醇灌肠剂100μl,拔出套管针,使小鼠保持倒立姿态60s后放入笼中,对照组给予0.9%氯化钠溶液。此后每隔1d测量小鼠体重变化情况。
6 细胞移植及取材 造模后第1天,TNBS-MSCs移植组小鼠均经尾静脉注射0.1ml CFDA SE标记的BMSCs悬液(含有1×106细胞)。于移植后第2、5、9天各处死4只,取远端结肠组织,0.9%氯化钠溶液冲洗肠道内容物,观察肠道大体形态变化。一部分制成冰冻切片,在荧光显微镜下观察肠道荧光定植情况,及进行HE染色观察肠道病理变化;另一部分用于提取DNA进行SRY基因检测。
7 聚合酶链式反应 分别提取移植后第9天的TNBS组、TNBS-MSCs移植组及用于提取干细胞的雄性小鼠结肠组织DNA后,采用PCR技术检测Y染色体的性别决定区(SRY)基因,观察BMSCs在受体结肠组织的植入情况。引物由primer3软件设计,由上海生工生物工程公司合成,上游引物序列为5'-GGTGTGGTCCCGTGGTGAGAG-3',下游引物序列为5'-ATGGCATGTGGGTTCCTGTCC-3',所得产物片断为294bp。反应体系为25μl,扩增条件:94℃ /2min,35×(94℃ /20s,64℃ /20s,72℃ /20s),72℃延伸5min。扩增产物在2%琼脂糖凝胶中电泳,于Image Master VDS凝胶扫描仪上成像。
8 统计学分析 采用SPSS17.0统计学分析软件。多组间数据用单因素方差分析,两组间数据t检验比较分析。
结 果
1 BMSCs形态学特点 原代培养可见贴壁细胞从骨片中爬出来,形态为小圆形、多角形、梭形、扁平形,增殖形成大小不等的克隆集落,并向周围进一步扩展变大与邻近的克隆集落融合,经换液传代后细胞形态较为一致,融合状态时细胞排列呈束状、旋涡状或放射状,见图1A;用CFDA SE荧光标记后几乎所有BMSCs呈绿色荧光,见图1B。2 IBD模型一般情况 TNBS组及TNBS-MSCs移植组的BALB/C小鼠造模24h后出现懒动、身体蜷缩、扎堆、厌食、大便次数增多、多为稀便或血便、体重下降等情况,TNBS组小鼠此后3d上述症状不同程度加重,其中体重在第3天下降最为明显,造模后第5天,上述症状逐渐改善。对照组小鼠则反应灵活、食量正常、体重增加。TNBS-MSCs移植组小鼠于造模24h后给予尾静脉移植BMSCs,并与移植后第2天体重开始上升,上述症状较前明显好转直至恢复正常。各组小鼠体重变化见图3。3 IBD模型病理 造模后第3天,远端结肠肠壁大部分结构破坏,明显充血、水肿、伴有点状或片状出血,多发溃疡形成,糜烂、坏死,多呈节段性,部分肠管狭窄(图2A);光镜下为肠黏膜充血水肿、上皮脱落、溃疡、糜烂、坏死、出血,部分溃疡深达黏膜全层,黏膜下层有大量中性粒细胞及淋巴细胞浸润(图2C)。正常对照组肠壁表面光滑,结构完整(图2B);光镜下可见肠道黏膜完整、无破坏,肠腺开口清晰,腺管表面界沟明显,可见杯状细胞和吸收细胞,无炎症细胞浸润(图2D)。
4 CFDA SE标记的BMSCs移植后在肠道的分布TNBS-MSCs移植组绿色荧光标记的BMSCs较多分布在肠道溃疡坏死病灶周边(图3),而对照组无溃疡坏死的正常肠道黏膜无BMSCs定植。
5 SRY基因在各组小鼠肠道内的检测 在移植后的第9天TNBS-MSCs移植组及雄性小鼠对照组均能检测到SRY基因,在TNBS组不能检测到该基因,见图4。
讨 论
近年来,随着干细胞研究的深入,MSCs移植已被用来治疗心血管系统疾病、呼吸系统疾病、消化系统疾病及自身免疫性疾病等[5-7],并取得了一定的治疗效果。本实验采用骨片培养法获得生长迅速、纯度较高、生物活性好的BMSCs,采用成脂肪、成骨诱导分化的方法来鉴定BMSCs的多向分化能力,从而证明该细胞为骨髓中的多能干细胞;而且也表明经过体外传代后BMSC仍然保持其多向分化的能力。目前炎症性肠病的动物模型很多,本实验采用2,4,6-三硝基苯磺酸(TNBS)复制出类似人发病的模型,该模型具有操作简便、经济实用、重复性好、造型时间短等优点。病理学改变也与人发病相似,发病时可见结肠黏膜毛细血管扩张、充血、水肿,大量的中性白细胞、淋巴细胞及单核细胞浸润,并可见点状或片状出血点。黏膜腺体正常结构破坏,腺细胞减少或消失,有隐窝脓肿及溃疡形成。
BMSCs还具有向骨髓归巢及损伤部位迁移的特性[8],植入细胞在受体内的归巢,对于鉴定细胞移植是否成功至关重要。经尾静脉移植的BMSCs经血液循环到达肠道损伤部位的机制可能是,BMSCs的黏附分子可在全身神经-体液免疫系统调控下表达逐渐增强,并在受损伤部位炎症介质的引导下向损伤结肠部位附壁、游出、趋化,穿过血管内皮屏障后定植于该部位并逐渐增多,为其促进溃疡部位再生修复奠定了基础。但不是所有移植BMSCs都聚集于损伤结肠,其余细胞在趋化因子的作用下逐渐归巢于骨髓,结肠以外器官内干细胞逐渐减少。有研究显示,BMSCs主要分布于肠道组织的黏膜层中[9]。本实验通过荧光显微镜观察到CFDA SE标记的BMSCs可以定植到肠道上皮细胞层或肠黏膜隐窝的结肠上皮祖细胞定居的部位,多数位于BMSCs多分布于黏膜溃疡和糜烂处病灶周边,而正常组织黏膜层、未移植组及重度损伤区域未见BMSCs定植。有实验[10]选择雌性IBD模型小鼠为移植受体,以雄性小鼠的BMSCs为细胞源,选择雄性基因SRY为分子标志,采用PCR技术检测植入细胞在动物体内的归巢,结果显示在移植后第9天可检测到SRY阳性细胞存在,而其相应对照组则无信号显示;但并不是在所有TNBS-MSCs移植组的结肠黏膜中能检测到荧光或SRY基因表达,这可能与细胞增殖数量、细胞归巢时间、取材及IBD模型组织损伤的轻重程度有关。可见移植的BMSC可在受体内存活并进入局部组织微环境,但一方面存在BMSCs被血液稀释可能最终进入结肠组织的细胞数量有限;另一方面,经外周移植的BMSCs不仅仅只在结肠分布,在经过肺、肝等脏器时发生滞留。

表1 各组小鼠体质量变化率Tab1 Weight of mice in different groups(-x±s)
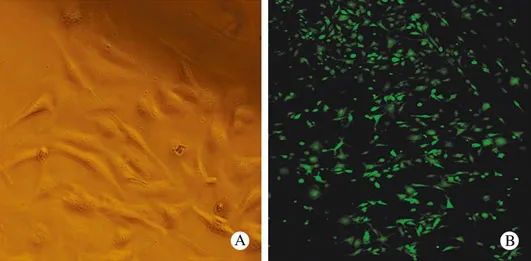
图1 BMSCs的培养及荧光标记A:未标记干细胞;B:荧光标记干细胞Fig 1 Incubation and flourescent labelingA: Unlabeled MSCs; B: fluorescent labeled MSCs
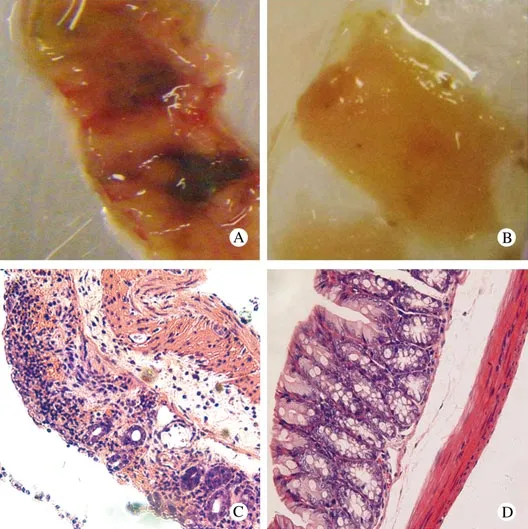
图2 肠道组织肉眼观及HE染色A:IBD模型组肠道黏膜肉眼观;B:对照组肠道黏膜肉眼观;C:IBD模型肠道组织HE染色;D:对照组肠道组织HE染色Fig 2 HE staining of colon tissueA: Macroscopic observation of colon mucosa in IBD model group; B:Macroscopic observation of colon mucosa in control group; C: HE staining of colon tissue from IBD model group; D: HE staining of colon tissue from control group
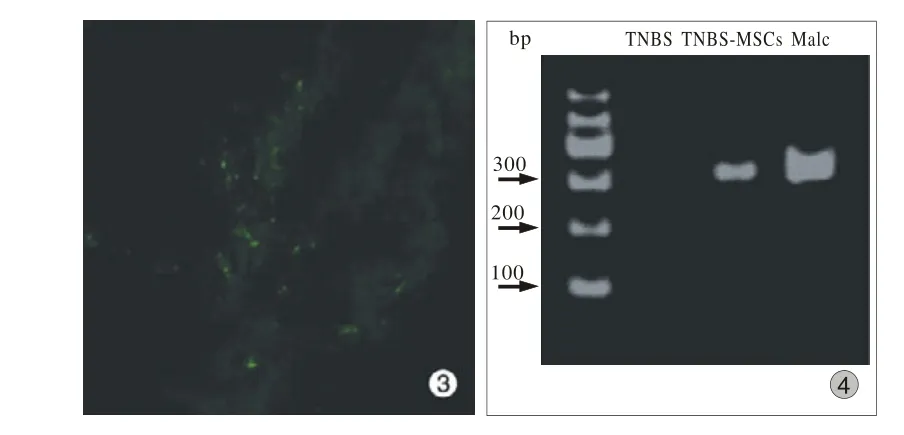
图3 移植后肠道内BMSCs图4 Y染色体PCR产物琼脂糖凝胶电泳Fig 3 BMSCs in colon after transplantationFig 4 Agarose gel electrophoresis of PCR Y chromosome products
综上所述,BMSCs可作为细胞移植治疗炎症性肠病的一种细胞源选择。然而,有关BMSCs如何发挥作用、是否可以在受体肠道组织内长期存活并增殖分裂、是否定向分化为肠道干细胞、是否通过免疫及炎症调节机制促进肠道本身的干细胞定向分化、是否对IBD各个发病阶段或其并发症都发挥作用、以及植入后干细胞在体内的最终命运等等问题,还需要研究人员进一步深入探讨。
1 Ditschkowski M, Einsele H, Schwerdtfeger R, et al. Improvement of inflammatory bowel disease after allogeneic stem-cell transplantation[J]. Transplantation,2003,75(10):1745-1747.
2 Bianco P,Robey PG,Simmons PJ. Mesenchymal stem cells:revisiting history,concepts,and assays[J]. Cell Stem Cell,2008,2(4):313-319.
3 Zhu H,Guo ZK,Jiang XX,et al. A protocol for isolation and culture of mesenchymal stem cells from mouse compact bone[J].Nat Protoc,2010,5(3):550-560.
4 Daniel C, Sartory NA, Zahn N, et al. Immune modulatory treatment of trinitrobenzene sulfonic acid colitis with calcitriol is associated with a change of a T helper (Th) 1/Th17 to a Th2 and regulatory T cell profile[J]. J Pharmacol Exp Ther,2008,324(1):23-33.
5 Assmus B, Rolf A, Erbs S, et al. Clinical outcome 2 years after intracoronary administration of bone marrow-derived progenitor cells in acute myocardial infarction[J]. Circ Heart Fail,2010,3(1):89-96.
6 Quante M,Wang TC. Stem cells in gastroenterology and hepatology[J]. Nat Rev Gastroenterol Hepatol,2009,6(12):724-737.
7 Sun L,Akiyama K,Zhang H,et al. Mesenchymal stem cell transplantation reverses multiorgan dysfunction in systemic lupus erythematosus mice and humans[J]. Stem Cells,2009,27(6):1421-1432.
8 Barry FP, Murphy JM. Mesenchymal stem cells: clinical applications and biological characterization[J]. Int J Biochem Cell Biol,2004,36(4):568-584.
9 Tanaka F,Tominaga K,Ochi M,et al. Exogenous administration of mesenchymal stem cells ameliorates dextran sulfate sodium-induced colitis via anti-inflammatory action in damaged tissue in rats[J].Life Sci,2008,83(23-24):771-779.
10 刘芳,陈少红,刘青波,等.骨髓间充质干细胞移植后的肝功能重建[J].中国组织工程研究与临床康复,2011,15(10):1803-1808.

