大鼠肥厚心肌组织CaN Aβ基因沉默的实现及对细胞肥大抑制作用
齐迎春,谢晓华,陈 雯,李朝晖
解放军总医院 南楼综合外一科,北京 100853
左室心肌肥厚(myocardial hypertrophy,LVH)是高血压、心脏瓣膜病以及心肌缺血等常见的心脏疾患发生发展过程中共同的病理生理过程之一,是目前公认的心血管疾病发病及死亡的独立危险因素[1]。钙调神经磷酸酶(calcineurin,CaN)在病理性心肌肥厚发生发展中起重要作用[2-3],抑制CaN通路为心肌肥厚的防治提供了一种全新的视角。RNA干扰(RNA interference,RNAi)技术作为一种新兴的研究及治疗手段,有巨大的潜在价值及重要的临床诊疗意义。本研究采用RNAi技术,构建质粒非病毒载体进行转染,以探讨动物水平心肌组织提高非病毒载体转染效率的方式及安全、有效抑制CaN通路的方法。
材料和方法
1 主要试剂 Block-it U6 RNAi Entry载体试剂盒(Invitrogen),TOP10感受态大肠杆菌细胞,质粒大提试剂盒(威格拉斯),胶原酶Ⅱ(Sigma),透明质酸酶(Sigma),声诺维微泡(Sonovue,Bracco),CaN Aβ多克隆抗体(Santa crutz),RT-PCR系统(promega,A3500),Trizol(Gibico),PCR引物(赛百盛公司)。
2 动物与分组 160-200g Wistar成年雄性大鼠(n=30)(军事医学科学院动物中心),随机分为6组(每组5只):1)假手术组:仅开腹,术后饮用正常水;2)“一肾一夹”模型组:术后26d处死。3)CaN Aβ心包腔内干扰组:“一肾一夹”术后第20天,经心包腔内途径转染siRNA表达质粒,转染6d后处死。4)CaN Aβ舌下静脉干扰组:“一肾一夹”术后第20天,经舌下静脉途径转染,转染6d后处死。5)心包腔内阴性对照组:以针对绿色荧光蛋白(green fluorescent protein,GFP)特定序列的干扰质粒作为阴性对照干扰质粒,心包腔内注射转染,转染6d后处死。6)舌下静脉阴性对照组:以针对GFP特定序列的阴性对照干扰质粒,舌下静脉内注射转染,转染6d后处死。其中麻醉后未苏醒2只。
3 “一肾一夹”高血压心肌肥厚动物模型制作 术前12h禁食。戊巴比妥钠麻醉后仰卧固定,开腹后暴露左肾肾蒂,分离肾动脉,在近腹主动脉端0.5cm处使用U型银夹(内径0.2mm)夹住,使肾动脉狭窄但血流未被完全阻断。结扎右侧肾动静脉及右侧输尿管,切除右肾,关腹。术后以1%氯化钠代饮水。
4 质粒制备 选取我们已在细胞水平上筛选的CaN Aβ基因的有效干扰片段1280(21bp)GCAAGAT GGCAAGAGTCTTCT,以针对GFP的GCTGACCCT
GAAGTTCATC(19bp)序列作为阴性对照[4]。根据Entry vector的特点设计单链寡核苷酸,退火处理合成双链寡核苷酸,克隆至pENTRTM/U6载体中,转化TOP10感受态大肠杆菌,培养皿过夜培养后挑取4个分离较好的单菌落,摇床过夜扩增(37℃,180r/min)。菌落PCR初步鉴定,并取少量菌液测序(三博远志公司),测序正确的菌种大量制备质粒,并经紫外分光光度计及琼脂糖凝胶电泳测定质粒浓度及质量。
5 基因包载与检测 用0.9%氯化钠注射液稀释2mg质粒至总体积5ml,注入sonovue微泡冻干粉瓶中,振摇混合成乳白色,即微泡+质粒混悬液。酶的配制:称取透明质酸酶0.8mg,胶原酶Ⅱ1mg,溶于0.9%氯化钠注射液250μl。心包腔内组取微泡+质粒混悬液500μl与酶溶液250μl混合(每只心包腔内注射液体总体积为750μl)。舌下静脉组取微泡+质粒混悬液500μl(含质粒200μg,无酶)。微泡+质粒悬液及微泡+质粒+酶悬液各取50μl,另取仅加入0.9%氯化钠注射液的sonovue微泡悬液50μl作空白对照,分别加入GelRed 0.5μl,GelRed可与DNA结合并在紫外光下激发荧光,使用荧光显微镜观察质粒与微泡的黏附情况。镜下可见(图1),sonovue微泡与质粒共同孵育后,微泡表面光晕较单纯的sonovue微泡表面光晕增厚,表明sonovue表面结合了一定的质粒,加入酶溶液后,微泡的完整性以及质粒与微泡的黏附不会受到明显影响。
6 经腹心包腔内注射方法 参照既往报道[5]的方法,戊巴比妥钠麻醉后固定。消毒后取上腹部中线切口约2-3cm,暴露膈肌,取自制套管针,以心脏上缘与肺交界、靠近镰状韧带处进针,水平向前刺入,有突破感后撤出针芯,将质粒微泡及酶的混合液750μl注入心包腔内,拔出套管针,以无菌纱布按压针孔1-2min,关腹。
7 超声导入 在心包腔内注射后30min-1h、舌下静脉注射同时进行。使用Philips5500超声仪、S3探头,心前区去毛后涂藕合剂,将探头垂直于心前区表面,照射参数为:二次谐波(频率为1.3/2.6MHz),机械指数MI 1.6,深度4cm,持续8min,心电触发模式,每5个周期触发1次。
8 检测 下腔静脉取血,采用日立7600全自动生化仪测定血浆常规肝肾功能、心肌酶指标:谷丙转氨酶(GPT)/谷草转氨酶(GOT)、肌酐(Cr)/尿素氮(UN)/尿酸(Ua)、肌酸激酶(CK)/心肌型肌酸激酶同功酶(CK-MB)/乳酸脱氢酶(LDH)。横切面切取心室水平心肌组织50-80mg,提取总RNA,采用两步法RT-PCR试剂盒,以β-actin为内参(ctatcggcaatgagcggttc,cttaggagttgggggtggct),观察CaNAβ(agggatgttgcctagtgg,gtatgtgcggtgttcagg)及肥大相关基因心房利钠因子(atrial natriuretic factor,ANF)(ctgctagaccacctggaga,accaagctgtgtgacacacc)以及β-重链肌球蛋白(myosin heavy chain,β-MHC)(cccagaacaccagcctcatc,ctcttcctcatgcccttcaccgac)基因的mRNA水平。1.5%琼脂糖凝胶电泳后,采用Champ Gel 3000凝胶分析仪扫描,以目的片段与内参片段光密度之比作为mRNA的相对含量。切取左心室前壁脏层心包下少量薄层心肌组织50-80mg,方法同上进行相关基因的mRNA水平检测。另取小块左室前壁心肌组织立即置-70℃冰箱保存,以CaN Aβ多克隆抗体(浓度1∶100)作为一抗,冰冻切片后进行心肌免疫荧光检测。
9 统计学分析 以-x±s表示计量资料,采用SPSS15.0软件行方差齐性检验以及单因素方差分析(one-way ANOVA),采用LSD法进行组间两两比较,以α=0.05为检验水准。
结 果
1 心肌组织RT-PCR结果 横切面切取心室水平心肌组织进行RT-PCR,结果表明“一肾一夹”模型组大鼠CaN mRNA水平及肥大相关基因ANF、β-MHC基因mRNA水平明显高于假手术组(P<0.05),但是“一肾一夹”模型组(0.43±0.09)、CaN Aβ心包腔内组(0.36±0.10)、CaN Aβ舌下静脉组(0.39±0.11)、心包腔内阴性对照组(0.41±0.05)及舌下静脉阴性对照组(0.43±0.14)之间比较,心肌组织 CaN Aβ、ANF、β-MHC mRNA水平比较无统计学差异(P>0.05)。切取左心室前壁脏层心包下薄层心肌组织进行相关基因的RT-PCR,结果表明心包腔内干扰组大鼠与模型组及心包腔内阴性对照 组 相 比,CaNAβmRNA水 平 及ANF、β-MHC基因mRNA均有明显降低(P<0.05)。见表1。
2 血浆常见肝肾功能、心肌酶水平 各组之间心肌酶(CK/CK-MB/LDH)、肝功能(GPT/GOT)比较无统计学差异(P>0.05),所有“一肾一夹”手术组血浆Cr水平较假手术组均有明显增加(P<0.05),BUN及Ua各组之间无统计学差异(P>0.05)。
3 心肌组织CaN Aβ蛋白免疫荧光染色 心肌组织CaN Aβ蛋白免疫荧光染色后,CaN Aβ显示为胞浆内红色荧光,心肌细胞核显示为蓝色荧光。可见与“一肾一夹”模型组比较,CaN Aβ干扰心包腔内组大鼠心外膜下部分心肌细胞胞浆红色荧光明显减弱,说明细胞内CaN Aβ蛋白含量相对较低。CaN Aβ干扰舌下静脉注射组和各阴性对照组均无明显减弱。见图2。
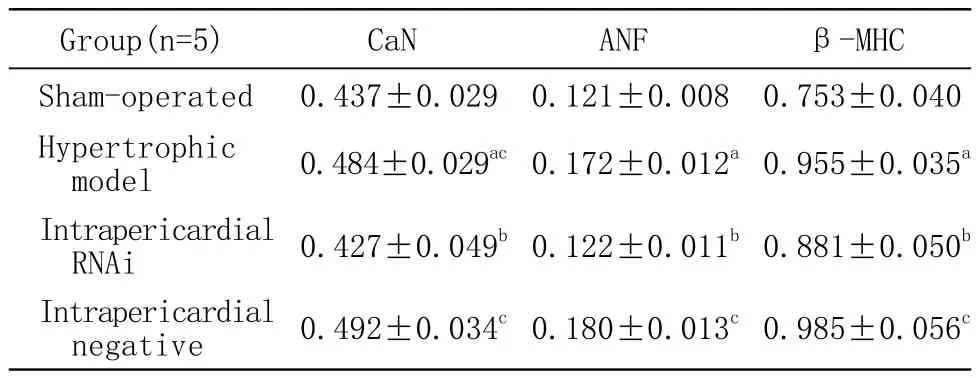
表1 CaN Aβ、ANF、β-MHC基因mRNA 水平(心外膜下薄层心肌组织)Tab 1 Levels of CaN Aβ, ANF and β-MHC mRNA in myocardial tissue(-x±s)
讨 论
心肌肥厚是高血压、心脏瓣膜病、心肌缺血等常见心脏疾患的共同病理生理过程之一,与心血管病发病及死亡风险间存在明显正相关[6]。CaN在病理性心肌肥厚发生发展中起重要作用,多种因素如内皮素、醛固酮、血管紧张素等均可上调大鼠心肌细胞CaNAβ的转录,介导心肌肥大的信号通路[7]。
RNA干扰(RNA interference,RNAi)技术是通过转录后基因沉默的方式来抑制目标蛋白的表达,是诱导基因沉默、研究基因功能的重要手段。但安全、高效、高特异性的转染载体及转染方式一直是其临床应用的瓶颈,也是各国学者研究的热点。可以通过非病毒载体或病毒载体的方式构建,病毒载体转染效率高,但制备复杂,有一定的免疫原性,不适于体内重复使用,而且病毒的基因产物对细胞可能产生一定的毒性,同时还有整合突变、重组成能够复制的病毒等风险;非病毒载体相对更为经济、操作简便、易构建、低毒性、无免疫原性、无传染性,适于临床重复应用[8],但非病毒载体的转染效率远不如病毒载体,若能改善非病毒载体的转染效率,它将更具有临床应用价值。本研究采用RNAi理论及技术,选择质粒非病毒载体,关键问题就是如何改善非病毒载体的转染效率,获得安全有效的目的基因(CaNAβ)的沉默,从而达到抑制心肌肥大的目的。
我们制作大鼠心肌肥厚模型,针对CaN Aβ既往验证的siRNA有效序列-1280(21bp)构建小发夹RNA (short hairpin RNA,shRNA)表达载体(si1280),采用心包腔内及舌下静脉内注射辅以超声导入的方法,在整体动物水平转染心肌组织,通过CaN Aβ基因mRNA水平及其蛋白表达的情况体现肥厚心肌组织CaN Aβ的抑制效果,并关注肥大相关基因ANF、β-MHC mRNA水平的变化。研究表明,“一肾一夹”模型组大鼠较假手术组CaNAβ基 因mRNA水 平 及ANF、β-MHC基因mRNA水平均明显升高;切取左心室前壁脏层心包下薄层心肌组织检测,心包腔内干扰组大鼠与模型组及心包腔内阴性对照组相比,CaN Aβ、ANF、β-MHC基因mRNA水平均有明显降低;若以横切面切取心室心肌组织,心包腔内干扰组的CaN AβmRNA水平低于其他手术组,但上述基因mRNA水平在各手术组之间比较均无统计学差异,这可能与样本量相对有限、有效的转染较集中于心外膜下心肌组织等因素有关。免疫荧光检测结果也提示,CaN Aβ干扰心包腔内组大鼠心外膜下局部心肌细胞胞浆CaN Aβ蛋白含量下降,而CaN Aβ干扰舌下静脉注射组和各阴性对照组CaN Aβ蛋白含量无明显减少。

图1 质粒与声诺维(sonovue)结合情况的检测A:sonovue微泡;B:微泡+质粒;C:微泡+质粒+酶Fig 1 Binding of plasmid to sonovueA:Sonovue bubbles; B: Sonovue+plasmid; C: Sonovue+plasmid+enzyme
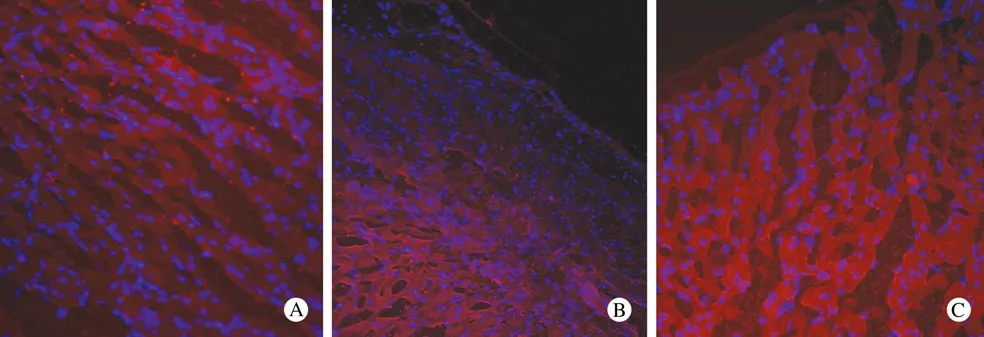
图2 心肌组织CaN Aβ蛋白免疫荧光染色(×20)A:“一肾一夹”模型组;B:心包腔内干扰组;C:舌下静脉干扰组Fig 2 Immunofluorescence staining of CaN Aβ protein in myocardial tissue(×20)A: Hypertrophic model group; B: Intrapericardial RNAi group; C: Sublingual vein RNAi group
心包腔作为一个密闭腔,可充分延长心肌组织与载体的接触时间,有利于目的基因在心肌组织的表达,并具有一定靶向性。本研究所采用的声学造影剂微泡、超声导入以及酶类的应用,对减轻心包脏层对转染的屏障作用、增加质粒的转染效率起到了一定的辅助作用。其中,超声微泡导入增强转染效率的方式越来越受到国内外学者的重视[9-10],其原理主要是携带基因的声学微泡在超声作用下瞬间破裂,同时产生声孔效应,有助于载体更易到达组织[8],此传输系统操作简单、损伤较小而且有一定靶向性,最主要的是可提高转染效率,弥补质粒等非病毒载体转染效率相对低下的不足。我们的研究同时表明,各组血浆常见肝酶、心肌酶含量无显著差异,“一肾一夹”各手术组之间血浆Cr含量无显著差异,提示经舌下静脉和心包腔内途径辅以超声微泡导入的方式对心、肺、肝及肾等组织无明显损伤,使其在临床上的进一步应用成为了可能。我们试验所涉及的质粒用量有待进一步考究,以及超声各个参数的优化还需更为深入的研究,以获得更为满意的转染效果。如能进一步改善质粒转染效率(如辅以酶类)、增加心肌的靶向性(如使用心肌特异性启动子)、这种方法将会具有更大的临床应用潜力。
1 Jiang QJ,Xu G,Mao FF,et al.Effects of com-bination of irbesartan and perindopril on calcineurin expression and sarco-plasmic reticulum Ca2+-atpase activity in rat cardiac pressure-overload hypertrophy[J]. J Zhejiang Univ Sci B,2006,7(3):228-234.
2 叶家欣,卢新政. 钙调神经磷酸酶与心肌重构[J]. 心血管病学进展,2009,30(2):284-287.
3 Heineke J,Molkentin JD. Regulation of cardiac hypertrophy by intracellular signalling pathways[J]. Nat Rev Mol Cell Biol,2006,7(8):589-600.
4 Firlej V,Bocquet B,Desbiens X,et al. Pea3 transcription factor cooperates with USF-1 in regulation of the murine bax transcription without binding to an Ets-binding site[J]. J Biol Chem,2005,280(2):887-898.
5 Fromes Y,Salmon A,Wang X,et al. Gene delivery to the myocardium by intrapericardial injection[J]. Gene Ther,1999,6(4):683-688.
6 Gradman AH,Alfayoumi F. From left ventricular hypertrophy to congestive heart failure:management of hypertensive heart disease[J]. Prog Cardiovasc Dis,2006,48(5):326-341.
7 Zobel C,Rana OR,Saygili E,et al. Mechanisms of Ca2+-dependent calcineurin activation in mechanical stretch-induced hypertrophy[J]. Cardiology,2007,107(4):281-290.
8 Roques C,Fattal E,Fromes Y. Comparison of toxicity and transfection efficiency of amphiphilic block copolymers and polycationic polymers in striated muscles[J]. J Gene Med,2009,11(3):240-249.
9 Phillips LC,Klibanov AL,Wamhoff BR,et al. Targeted gene transfection from microbubbles into vascular smooth muscle cells using focused,ultrasound-mediated delivery[J]. Ultrasound Med Biol,2010,36(9):1470-1480.
10 Zhou S,Li S,Liu Z,et al. Ultrasound-targeted microbubble destruction mediated herpes simplex virus-thymidine kinase gene treats hepatoma in mice[J]. J Exp Clin Cancer Res,2010,29(1):170.

