不同抗凝剂和激活剂组合在自体富血小板血浆凝胶支架促进脂肪干细胞增殖的影响
张 宁,李 放,罗 涛
1北京军区总医院 骨科,北京 100700;2解放军总医院/军医进修学院,北京 100853
富血小板血浆(platelet rich plasma,PRP)是全血经浓集后分离得到的血液制品[1-2]。通常认为血小板浓度达到全血的4倍即可称为富血小板血浆。其富含高浓度促进骨组织和软组织再生修复的生长 因 子 TGF-β1、TGF-β2、EGF、FGF、PDGF、VEGF、IL-1[3-5]。而富血小板血浆最大优势在于其来源于患者自身,无免疫原性,使其在组织工程应用中有显著优势。应用富血小板血浆PRP复合脂肪干细胞(adipose derived stromal cells,ADSCs)支架材料,构建组织工程髓核,治疗椎间盘退变性疾病的临床应用提供方法。目前国内外抗凝剂和激活剂选择尚无统一标准。本实验在制作自体PRP支架并植入ADSCs过程中,使用不同抗凝剂(肝素、EDTA)和激活剂(凝血酶、Ⅰ型胶原),探讨各组之间ADSCs生长情况的差异性,为体内试验打下基础。
材料和方法
1 实验动物及分组 取3月龄新西兰雄性大白兔10只,体质量2.0-2.5kg,由军事医学科学院动物中心提供。在制作自体PRP支架并植入ADSCs过程中,每1.0ml L-DMEM完全培养基中含使用不同抗凝剂(肝素、EDTA)和激活剂(牛凝血酶、Ⅰ型胶原)PRP,EDTA与凝血酶组,EDTA与Ⅰ型胶原组,肝素与凝血酶组,肝素与Ⅰ型胶原组,空白对照组,L-DMEM完全培养基中不含PRP。
2 脂肪干细胞培养与鉴定 将成年新西兰大白兔以3.0%戊巴比妥钠(1.0ml/kg)耳缘静脉麻醉,取兔肩胛间区皮下脂肪。参照马健[6]等文献的方法进行脂肪干细胞分离培养和鉴定,取第3代脂肪干细胞进行实验。
3 富血小板血浆制备 用注射器从兔耳中央动脉抽血分别取5ml移入两组抗凝管(EDTA抗凝管和肝素抗凝管)中。采用二次离心法先以2 400r/min,离心10min,超净台内用枪头吸取全部上清液以及白膜层,加入离心管中,再次以3 600r/min离心15min,,弃掉约3/4上清液,剩余液体即为PRP,约0.5ml[6]。制备PRP凝胶前需分别于两组激活剂混和。以10ml PRP加入牛凝血酶(Sigma,USA)60U和1ml 10% CaCl的比例混合。I型胶原(Sigma,USA)20μg/ml,并用碳酸氢钠缓冲至pH 7.4[7]。
4 脂肪干细胞生长增殖能力测定 取第3代脂肪干细胞按1 000个/孔接种到7块96孔板内,用不含血清的L-DMEM培养基培养24h使其同步化后,弃去培养液及未贴壁细胞,将每块板上的孔随机分为5组,每组6孔(共用30个孔),根据不同分组分别加入相应L-DMEM培养基,分别37.8℃培养7d,每天计数1块板,连续观察7d,绘制细胞生长曲线。用MTT法在第2、3、4、6天检测细胞存活和增殖能力。在每孔内加入5mg/ml MTT液50µl,继续培养4h,弃去MTT液,每孔加入150µl二甲基亚砜(DMSO),振荡5min,用酶联免疫检测仪法测定吸光度A值(490nm),每个样品均重复测量6次,取平均值。
5 各组TGF-β1,Ⅱ胶原及sox-9含量测量 1)TGF-β1的测量:通过酶联免疫吸附试验(ELISA)定量检测TGF-β1的含量。具体操作遵循操作手册。所有OD值都减除零孔值后再行计算;以标准品 1 000、500、250、62.5、31、15.6、0ng/ml之OD值在双对数纸上作图,画出标准曲线。通过标本OD值在标准曲线上查出相对应TGF-β1的浓度。2)酶联免疫吸附试验(ELISA)定量检测细胞的Ⅱ胶原:取第3代脂肪干细胞按2×104个/孔的浓度在96孔培养板内培养过夜,用不含血清的L-DMEM培养基培养24h使其同步化后弃去培养液及未贴壁细胞,将每块板上的孔随机分为5组,每组6孔(共用30个孔),根据不同分组加入含不同抗凝剂和激活剂PRP的L-DMEM培养液,3d后PBS清洗,体积分数2%甲醛固定,体积分数0.3%过氧化氢中和内源性过氧化物酶,加入Ⅱ胶原抗体,室温下孵育60min,加入过氧化物酶标记的二抗30min后,用0.25mol/L的硫酸中止反应,每孔100µl的样品转移至96孔培养板内,使用酶标仪在吸光度450nm(A450nm)条件下测量胶原的产生。通过realtime RT-PCR测量sox-9基因含量,把脂肪干细胞加入向软骨分化培养液(Cambrex公司)中培养21d并在前7天加入PRP。实时定量RT-PCR是使用ABI PRISM7900检测系统。用Trizol试剂提取总RNA,逆转录合成cDNA。cDNA样本用于PCR分析[8]。使用相对标准化曲线法进行量化和规范化的内部控制。
6 统计学分析 使用SPSS16.0统计软件包进行数据分析。数据用-x±s表示,组间比较采用方差分析。P<0.05为差异有统计学意义。
结 果
1 血小板计数 全血为(181.75±41.44)×109/L,使用EDTA抗凝管PRP中含的血小板含量(1 040.01±159.72)×109/L约为全血的5.7倍。使用肝素抗凝管PRP中含的血小板含量(795.01±140.69)×109/L约为全血的4.2倍。
2 ADSCs生长曲线及增殖情况 各组脂肪干细胞均有增长且随着时间点增长。在培养第2天各组细胞数无统计学差异(P>0.05),可能与细胞处于G0静止期有关,在第3-7天,各组细胞数有明显增长,并且加入PRP的各组与空白对照组相比明显升高(P<0.05),表明细胞处于快速生长期。但第3天PRP各组间差异不明显(P>0.05),在第4-7天EDTA-凝血酶组与其他各组相比细胞数明显较高(图1)。MTT法也显示各组PRP细胞数与空白对照组相比均有增加,在培养第6天,EDTA-凝血酶组细胞数较空白对照组升高约2.5倍。见表1。
3 各组TGF-β1、Ⅱ胶原及sox-9含量 在基因表达方面,我们发现软骨分化标志物sox-9增长更加明显(最高约为8倍),而TGF-β1(最高约为5.8倍),Ⅱ型胶原(最高约为1.8倍)。各PRP组sox-9的基因相对于管家基因18s表达量分别为30.11±4.03,25.78±5.24,26.53±6.05,22.77±4.33,空白对照组为3.75±0.21(P<0.01)。TGF-β1表达量分别为289.83±24.36,203.4±33.11,205.71±48.54,198.71±19.01,空白对照组为50.71±10.17 (P<0.05)。Ⅱ型胶原表达量分别为0.54±0.04,0.48±0.03,0.48±0.02,0.46±0.03,空白对照组为0.30±0.02(P<0.05)。见图2。

表1 MTT法测定各组脂肪干细胞增殖能力Tab 1 Proliferation of ADSC in different groups detected by MTT assay(-x±s, %)
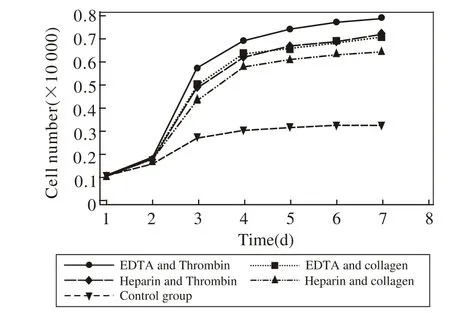
图1 各组别脂肪干细胞生长曲线图Fig 1 Growth curves of bone ADSC in different groups
讨 论
富血小板血浆中含高浓度的生长因子,可促进细胞生长及组织修复。研究显示富血小板血浆可促进干细胞增殖并诱导其向成骨、软骨及脂肪细胞等多个方面转化,也可刺激软组织再生,并促进伤口早期愈合。富血小板血浆凝胶是三维的多孔结构,具有一定的黏附性,这有利于脂肪干细胞黏附生长、防止生长因子流失,并能保持局部较高的生长因子浓度[9]。本文使用的脂肪间充质干细胞作为实验种子细胞有以下优势:首先取材简便,成本低廉;其次与骨髓干细胞相比,其在生长动力学、细胞老化、基因转染和细胞的黏附特性等方面无明显差别。目前已证实脂肪干细胞在一定条件下能够向中胚层细胞系包括脂肪、软骨、骨、肌肉和其他胚层细胞系包括神经、内皮等转化。
PRP再生潜力是基于血小板破裂时生长因子的释放,因此制作PRP时要求使用的抗凝剂尽量减少对血小板的损伤,保持血小板的生理活性。陈小玲等[10]报道了不同浓度凝血酶对富血小板血浆促骨髓基质的影响,研究显示在使用凝血酶时,20、40、60U/ml促增殖作用呈浓度依赖关系,且60U/ml组作用明显高于其他各组。邓新立等[11]报道了不同浓度血小板激活剂激活血小板微粒膜表达PAC-1、CD62p的比较,结果显示随着激活剂浓度的增加,CD62p+PMP、PAC-1+PMP的百分率都在逐渐增加。目前国内外对抗凝剂和促凝激活剂并无统一标准。本实验研究的目的是找出最佳的抗凝剂和激活剂组合。通过本实验可以得出结论:EDTA与凝血酶组别自体富血小板血浆(PRP)对促进脂肪干细胞增殖效果最好,是最佳的抗凝剂和激活剂组合。
综上所述,本研究将抗凝剂和激活剂两种变量进行联合研究,更好地探索多变量情况下PRP对细胞培养的影响以及自身释放生长因子的影响,也弥补了以往实验中只对单一变量的研究,忽略了试剂间的协同效应或拮抗效应,通过本实验论证,为下一步体内试验试剂的选择提供了依据。本实验不足之处在于抗凝剂和促凝剂的种类太少,对实验人员操作要求高,但限于实验条件以及工作量,有可能忽略了其他更好的试剂。由于本实验是动物体外实验,实验结果是否与人类相似,或者有可能相反,需进一步研究。
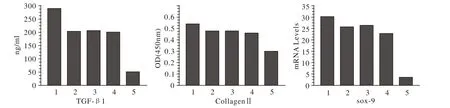
图 2 各组别TGF-β1、Ⅱ胶原量和sox-9基因的表达量Fig 2 Expression of markers of TGF-β1, col1gen-2 and sox-9 1: EDTA and thrombin; 2: EDTA and collagenⅠ; 3: Heparin and thrombin; 4: Heparin and collagenⅠ; 5: Control group
1 Schnabel LV,Mohammed HO,Miller BJ,et al. Platelet rich plasma (PRP) enhances anabolic gene expression patterns in flexor digitorum superficialis tendons[J]. J Orthop Res,2007,25(2):230-240.
2 Whitman DH,Berry RL,Green DM. Platelet gel:an autologous alternative to fibrin glue with applications in oral and maxillofacial surgery[J]. J Oral Maxillofac Surg,1997,55(11):1294-1299.
3 Marx RE. Platelet-rich plasma:evidence to support its use[J]. J Oral Maxillofac Surg,2004,62(4):489-496.
4 Weibrich G,Kleis WK,Hafner G,et al. Growth factor levels in platelet-rich plasma and correlations with donor age,sex,and platelet count[J]. J Craniomaxillofac Surg,2002,30(2):97-102.
5 Landesberg R,Roy M,Glickman RS. Quantification of growth factor levels using a simplified method of platelet-rich plasma gel preparation[J]. J Oral Maxillofac Surg,2000,58(3):297-300.
6 马健,李放,任大江,等. 富含血小板血浆凝胶复合脂肪间充质干细胞构建可注射组织工程髓核[J]. 中国脊柱脊髓杂志,2011,21(5):353-357.
7 Wahlström O,Linder C,Kal é n A,et al. Variation of pH in lysed platelet concentrates influence proliferation and alkaline phosphatase activity in human osteoblast-like cells[J]. Platelets,2007,18(2):113-118.
8 Mishra A,Tummala P,King A,et al. Buffered platelet-rich plasma enhances mesenchymal stem cell proliferation and chondrogenic differentiation[J]. Tissue Eng Part C Methods,2009,15(3):431-435.
9 Goto H,Matsuyama T,Miyamoto M,et al. Platelet-rich plasma/osteoblasts complex induces bone formation via osteoblastic differentiation following subcutaneous transplantation[J]. J Periodontal Res,2006,41(5):455-462.
10 陈小玲,林敏魁,闫福华,等. 不同浓度凝血酶对富血小板血浆促骨髓基质细胞增殖影响的研究[J]. 临床口腔医学杂志,2006,22(3):151-153.
11 邓新立,丛玉隆,殷宗健,等. 不同浓度血小板激活剂激活血小板微粒膜表达PAC-1,CD62p的比较[J]. 临床检验杂志,2004,22(3):181-183.

