合浦珠母贝肉短肽的分离及其抗氧化活性研究
吴燕燕,尚 军,2,李来好,杨贤庆,田 倩,3
(1.中国水产科学研究院南海水产研究所,国家水产品加工技术研发中心,广东广州 510300;2.广东海洋大学食品科技学院,广东湛江 524088;3.中国海洋大学,山东青岛 266003)
合浦珠母贝肉短肽的分离及其抗氧化活性研究
吴燕燕1,尚 军1,2,李来好1,杨贤庆1,田 倩1,3
(1.中国水产科学研究院南海水产研究所,国家水产品加工技术研发中心,广东广州 510300;2.广东海洋大学食品科技学院,广东湛江 524088;3.中国海洋大学,山东青岛 266003)
为制备具有抗氧化能力的合浦珠母贝肉活性肽,本文采用Sephadex G-25分子筛层析法对合浦珠母贝肉酶解产物进行分离,测定分离到的各活性组分分子量及其总抗氧化活性、DPPH自由基清除能力及羟自由基清除能力。结果表明,合浦珠母贝肉酶解产物经Sephadex G-25分离得到6个主要活性组分,相对分子量分别为1437.5、833.7、421.9、244.7、89.0、17.4u,其中功能短肽F1(1437.5u)、F2(833.7u)、F4(244.7u)的抗氧化效果较强,特别是F2(833.7u)短肽具有最强的总抗氧化能力、DPPH自由基清除能力及羟自由基清除能力。该研究为合浦珠母贝肉抗氧化活性肽的开发提供理论技术依据。
合浦珠母贝肉,短肽,分子量,抗氧化活性
近年来,功能性短肽已成为蛋白科学研究中的一个崭新领域,短肽是蛋白的水解产物,是由分子量小且具有很高活性的小肽分子组成,它不仅具有比氨基酸更容易被人体肠道吸收的特性,还具有多种功能[1],如降血压肽可抑制血压升高。自1956年Harman[2]提出自由基理论后,具有抑制生物大分子过氧化能力和清除体内自由基功能的抗氧化肽备受关注。水产品生物蛋白资源是21世纪人类重要蛋白类食物及生物活性物质的重要来源,Amarowicz等[3]利用Sephadex G-10凝胶层析色谱从capelin水解产物中分离到抗氧化肽,Kim等[4]从阿拉斯加青鳍鱼皮中提取到抗氧化活性较高的短肽P1、P2,其中P2能显著抑制亚油酸的氧化,并显著增强培养肝细胞的发育能力。合浦珠母贝(Pinctada fucata),属软体动物门双壳纲珍珠贝目珍珠贝科,又称马氏珠母贝,主要分布在海南、广西、广东和台湾海峡南部沿海一带,是主要的人工养殖海水珍珠贝类之一[5-7]。研究发现合浦珠母贝肉含有丰富的蛋白质和功能活性物质[8-9],但目前采珠后的珍珠贝肉因缺乏有效的加工手段而未能得到充分利用[10],合浦珠母贝肉抗氧化肽的研究鲜见报道。因此,本文采用Sephadex G-25分子筛层析对合浦珠母贝肉酶解产物[11]进行分离,并对分离到的短肽产物的总抗氧化活性、DPPH自由基清除能力及羟自由基清除能力加以分析,旨在为合浦珠母贝肉开发功能食品提供技术支持。
1 材料与方法
1.1 材料与仪器
合浦珠母贝肉酶解物 本实验室自制[11];Sephadex G-25 Pharmacia公司;DPPH(1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl)、邻苯三酚 Sigma公司;杆菌肽、氧化型谷胱甘肽、还原型谷胱甘肽、L-酪氨酸 Rochi公司;其他均为国产分析纯试剂。
玻璃层析柱(Φ1.6×60cm)、HD-3紫外检测仪、DHL-B电脑数显定时恒流泵、BSZ-30自动部分收集器 上海沪西分析仪器厂;3K30型高速冷冻离心机 德国Sigma公司;BS124S型电子天平 德国Sartorius公司;LNG-CM-101实验室小型陶瓷膜设备 上海朗极化工科技有限公司。
1.2 实验方法
1.2.1 合浦珠母贝肉短肽的制备工艺 合浦珠母贝肉酶解物[11]→超滤→葡聚糖凝胶分离纯化→抗氧化短肽
1.2.2 Sephadex G-25分离纯化及分子量分布的初步测定 酶解液经灭酶、离心、超滤后,将1ku超滤组分进行葡聚糖凝胶分离纯化,并初步测定其分子量范围大小,洗脱条件如下:凝胶型号:Sephadex G- 25;柱尺寸:1.6×60cm;柱料:Sephedax G- 15;上样量:1mL;流动相:pH7.0超纯水;洗脱液流速:0.5mL/min;检测波长:280nm;自动收集速度:4min/管。
1.2.3 标准曲线的制作 选择杆菌肽(MW1422.7)、氧化型谷胱甘肽(MW612.6)、还原型谷胱甘肽(MW307.32)及L-酪氨酸(MW181.19)作为分子量校正曲线标准品,按照样品洗脱分离条件分别上样分析,分别以洗脱体积和分子量的对数为横坐标和纵坐标作图,并求出回归方程及相关系数。
1.2.4 合浦珠母贝肉酶解物总抗氧化活性测定 取待测样液0.5mL,加入质量分数为1%的铁氰化钾[K3Fe(CN)6]溶液2mL,0.2mol/L pH6.6的磷酸缓冲液2mL,混匀后于50℃水浴下保温20min,再加入质量分数为10%的三氯乙酸(TCA)溶液2mL,振荡混匀后离心。取离心后的上清液2mL,加入2mL去离子水和0.4mL质量分数为0.1%的FeCl3溶液,振荡混匀后在50℃水浴下保温10min,体系溶液由黄色变为蓝色,在700nm下进行比色,以去离子水代替样品作为空白[12]。
1.2.5 合浦珠母贝肉酶解物的DPPH自由基清除能力测定 参考文献[13-14]并加以改进:在1.5mL离心管中依次加入0.1mL样品,0.5mL去离子水,0.5mL DPPH溶液(2×10-4mol/L,DPPH溶于无水乙醇),混匀后在室温下避光反应20min,10000r/min离心10min,在517nm下测吸光值Ai,空白组为0.5L无水乙醇代替DPPH溶液加入0.6mL去离子水测定吸光值为Aj,对照组为0.5mL DPPH溶液加入0.6L去离子水代替样品在517nm下测定吸光值A0,并以等体积去离子水和无水乙醇混合液空白调零,DPPH自由基清除率AOA按以下公式计算:
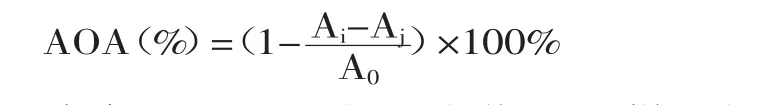
式中:A0—对照组吸光值;Ai—样品组吸光值;Aj—空白组吸光值。
1.2.6 合浦珠母贝肉酶解物清除羟自由基(·OH)能力测定[15]损伤管:取0.5mL 0.75mmol/L邻二氮菲的无水乙醇溶液加入1mL 0.15mol/L的磷酸盐缓冲液(pH7.4)和0.5mL去离子水,充分混匀后加入0.5mL 0.75mmol/L的FeSO4,混匀后再加入0.5mL 0.01%(V/V)的H2O2,37℃水浴60min后,536nm下测其吸光值为A损。未损伤管:以0.5mL的去离子水代替H2O2重复上述操作,在536nm测其吸光值为A未损。
样品管:取0.5mL 0.75mmol/L邻二氮菲的无水乙醇溶液加入1mL 0.15mol/L的磷酸盐缓冲液(pH7.4)和0.5mL样品溶液,充分混匀后加入0.5mL 0.75mmol/L的FeSO4,混匀后加入0.5mL 0.01%(V/V)的H2O2,37℃水浴60min,在536nm测其吸光值为A样。
样品参比:取1mL 0.15mol/L的磷酸盐缓冲液(pH7.4)和0.5mL 2.5mg/mL样品溶液混合,加入1.5mL去离子水,不需水浴,直接在536nm下测其吸光值为A参。
空白参比:取1mL 0.15mol/L的磷酸盐缓冲液(pH7.4)加入2mL去离子水,作为空白调零A空。计算不同水解度的样品对·OH的清除率:
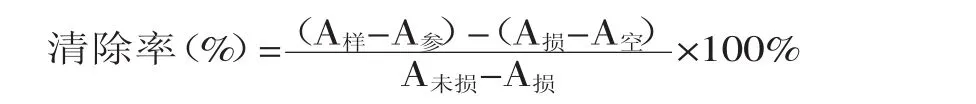
式中:A样—样品组的吸光值;A参—样品参比的吸光值;A损—损伤管的吸光值;A未损—未损伤管的吸光值;A空—空白对照组的吸光值。
2 结果与分析
2.1 标准曲线的制作
按照样品洗脱分离条件分别在Sephadex G-25上样分析,测定各已知分子量的标准物洗脱体积,结果如表1所示。分别以洗脱体积和分子量的对数为横坐标和纵坐标作图,并求出回归方程及相关系数,结果如图1所示。
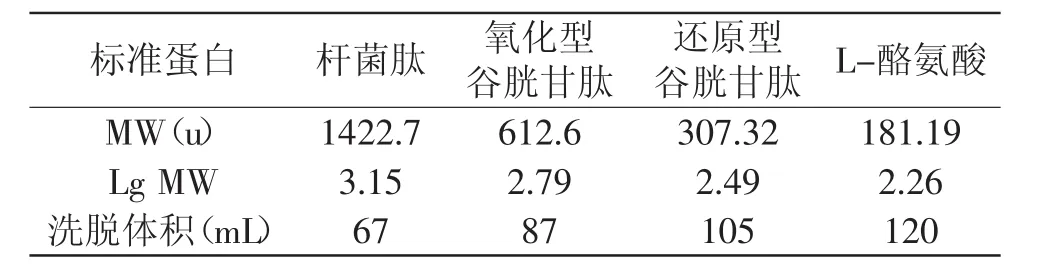
表1 标准物的分子量和洗脱体积Table 1 The molecular weight and elution volume of standard materials
2.2 合浦珠母贝肉酶解物分子量分析

图1 Sephadex G-25分子量测定标准曲线Fig.1 The standard curve of molecular weight distribution by Sephadex G-25
如图2所示为合浦珠母贝肉酶解产物经Sephadex G-25的洗脱曲线,依据分子量大小被分成六个组分,按出峰顺序即分子量从大到小排列分别命名为F1、F2、F3、F4、F5和F6,将F1~F6所对应6个峰的洗脱体积分别与标准曲线对比,计算其分子量,结果如表2所示。
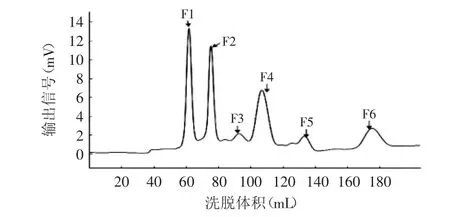
图2 合浦珠母贝肉酶解物的Sephadex G-25洗脱图谱Fig.2 The elution profile of Pinctada fucata muscle protein hydrolysate by Sephadex G-25
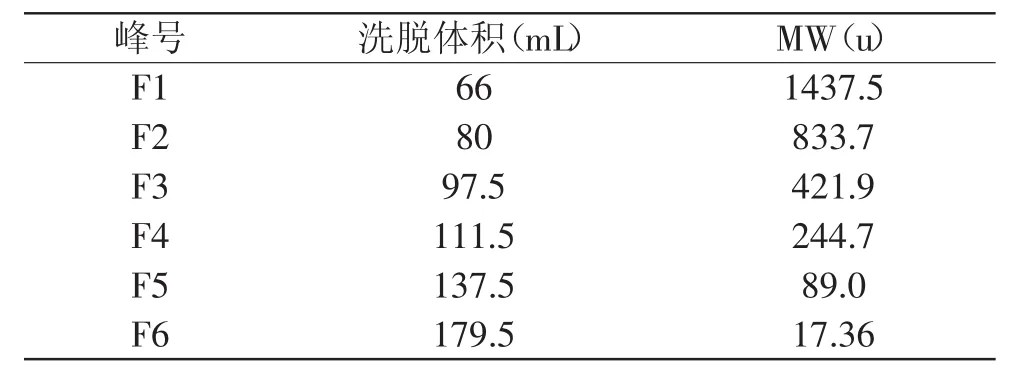
表2 合浦珠母贝肉酶解产物的分子量分布表Table 2 Pinctada fucata muscle protein hydrolysate ultrafiltrate molecular weight distribution
由图2及表2可知,合浦珠母贝肉酶解产物分子量主要集中在1ku以下,其中主要短肽组分为F1、F2及F4三个组分,分子量分别为1437.5、833.7、244.7u。F5组分和F6组分的分子量为89.0u和17.36u,由于氨基酸的平均分子量约为128u,所以这两个分离组分应该为氨基酸。
2.3 Sephadex G-25分离各组分抗氧化能力分析
如图3所示为组分F1至F6总抗氧化活性测定结果。在一般情况下,物质的还原能力与抗氧化能力呈正相关[16]。还原能力的测定,可检验待测物是否为良好的电子供体。待测物所提供的电子可以使Fe3+还原为Fe2+,使体系溶液颜色改变,在700nm处根据其吸光值的变化可以得知Fe3+含量的变化[16],从而反映出体系中氧化还原状态改变的情况。由图3可知,F2组分(833.7u)所对应的合浦珠母贝肉酶解产物总抗氧化能力最强,其次为F4组分(244.7u)。
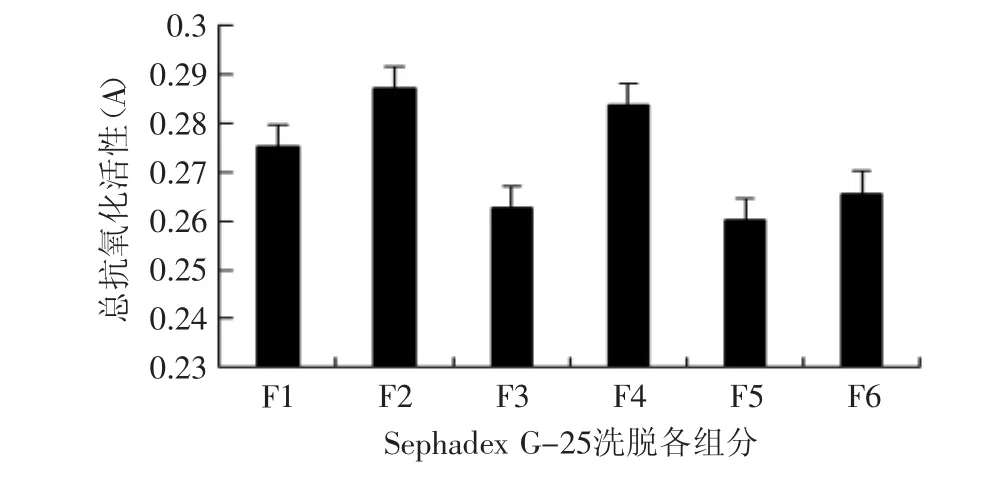
图3 组分F1~F6总抗氧化活性测定Fig.3 The total antioxidant activity of fraction F1~F6
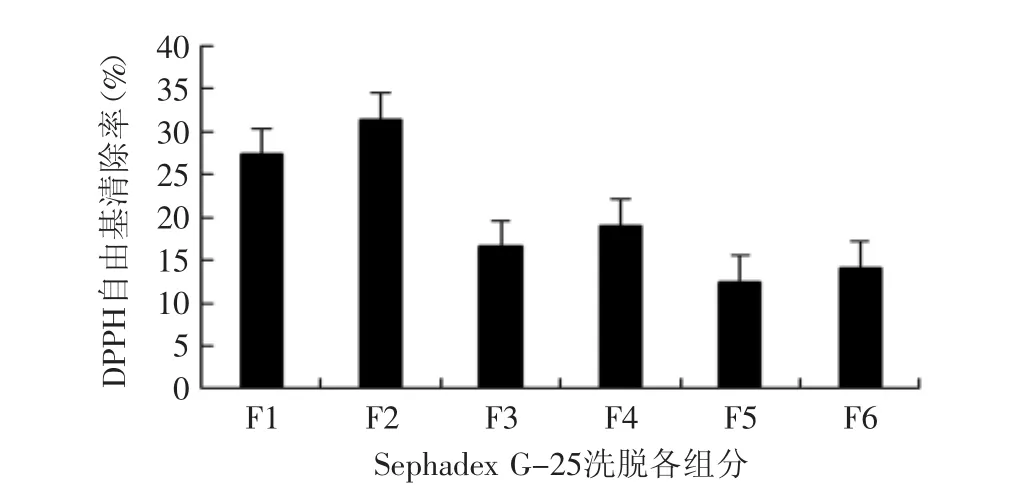
图4 组分F1~F6清除DPPH自由基能力测定Fig.4 DPPH radical scavenging abilities of fractions F1~F6
图4为各组分DPPH自由基清除能力测定结果。DPPH在乙醇中是一种深紫色稳定自由基,孤对电子在517nm有强吸收;随着DPPH与抗氧化剂释放的氢相结合,体系颜色由紫色变为淡黄,反应结束后达到稳定DPPH-H,剩余百分率与抗氧化剂的淬灭能力相对应[17]。
由图4可知,F2组分对DPPH自由基的清除能力同样表现出较强的活性,F4组分的总抗氧化能力强于F1组分,而对于DPPH自由基清除能力则相反,即F1组分(1437.5u)的DPPH自由基清除能力大于F4组分(244.7u)。F3、F5及F6三个组分清除DPPH自由基能力相差不大,清除DPPH自由基能力均小于F1、F2、F4组分。
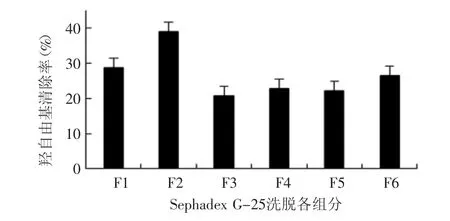
图5 组分F1~F6羟自由基清除能力测定Fig.5 Hydroxyl radical scavenging abilities of fractions F1~F6
图5为Sephadex G-25分离得到6个组分的羟自由基清除能力,羟自由基是化学性质最活泼的一种活性氧分子,几乎能和所有的生物大分子发生各种不同类型的反应,并有非常高的速率常数,是进攻性最强的化学物质之一,在活性氧中其危害性最大[18]。由图5可见,F2组分仍是活性最强组分,其次为F1组分,F3~ F6 4个分离组分对羟自由基的清除能力基本相当,综合以上结果,F2组分具有最强的抗氧化能力。从合浦珠母贝肉酶解产物中分离得到的短肽的清除自由基的能力比鳙鱼蛋白酶解液[18]的清除能力强。
3 结论
采用Sephadex G-25对合浦珠母贝肉酶解产物进行分离,并收集得到6个主要活性组分,相对分子量分别为1437.5、833.7、421.9、244.7、89.0、17.4u,其中功能短肽F1(1437.5u)、F2(833.7u)、F4(244.7u)的抗氧化效果较强,特别是相对分子量为833.7u的F2短肽具有最强的总抗氧化能力、DPPH自由基清除能力及羟自由基清除能力。说明合浦珠母贝肉抗氧化短肽是制备抗氧化功能食品或作为化妆品、食品等的天然抗氧化物剂的良好素材,下一步将对该短肽进行结构鉴定和应用上的研究。
[1]周涛.酶解鲐鱼蛋白制取低分子肽的初步研究[J].浙江水产学院学报,1997,16(1):12-18.
[2]Ashok BT,Ali R.The aging paradox:free radical theory of aging[J].Exp Gerontol,1999,34(3):293-303.
[3]Amarowicz R,Shahidi F.Antioxidant activity of peptide fractions of capelin protein hydrolysates[J].Food Chemistry,1997,58(4):355-359.
[4]Kim SK,Kim YT,Byun HG,et al.Isolation and characterization of antioxidative peptides from gelatin hydrolysate of allaska pollack skin[J].J Agric Food Chem,2001,49:1984-1989.
[5]王桢瑞.中国动物志无脊椎动物:第三十一卷软体动物门无壳纲珍珠贝亚目[M].北京:科学出版社,2002:68-98.
[6]张莉.世界珍珠产业的发展与我国的对策 [J].海洋科学,2002(11):10-13.
[7]王志成,梁志辉,杨家林,等.北海营盘近海区马氏珠母贝自然资源调查[J].广西科学,2008,15(2):205-208.
[8]刁石强,李来好,陈培基,等.马氏珠母贝肉营养成分分析及评价[J].浙江海洋学院学报,2000,19(1):42-46.
[9]吴燕燕,李来好,杨贤庆,等.栅栏技术优化即食调味珍珠贝肉工艺的研究[J].南方水产,2008,4(6):56-62.
[10]章超桦,吴红棉,洪鹏志,等.马氏珠母贝肉的营养成分及其游离氨基酸组成[J].水产学报,2000,24(2):180-184.
[11]尚军,李来好,吴燕燕,等.响应面法优化超声波辅助蛋白酶水解合浦珠母贝肉的条件研究[J].食品科学,2009,30(18):44-49.
[12]Wu HC,Chen HM,Shiau CY.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus)[J].Food Research International,2003,36(9-10):949-957.
[13]Li B,Chen F,Wang X.Isolation and identification of antioxidative peptides from porcine collagen hydrolysate by consecutive chromatography and electrospray ionization-mass spectrometry[J].Food Chemistry,2007,102(4):1135-1143.
[14]Rajapakse N,Mendis E,Jung WK.Purification of a radical scavenging peptide from fermented musselsauce and its antioxidant properties[J].Food Research International,2005,38:175-182.
[15]Richmond R,Halliwell B,Chauhan J,et al.Superoxidedependent formation of hydroxyl radicals:detection of hydroxyl radicals by the hydroxylation of aromatic compounds[J].Anal Biochem,1981,118(2):328-335.
[16]Ferreira ICFR,Baptista P,Vilas-Boas M,et al.Free-radical scavenging capacity and reducing power of wild edible mushrooms from northeast Portugal:Individual cap and stipe activity[J].Food Chem,2007,100(4):1511-1516.
[17]荣建华,李小定,谢笔钧.大豆肽体外抗氧化效果的研究[J].食品科学,2002,23(11):118-120.
[18]李琳,赵谋明.鳙鱼蛋白酶解液清除自由基的研究[J].水产科学,2005,10(24):15-18.
Study on isolation and antioxidation activity of oligopeptides from Pinctada fucata muscle
WU Yan-yan1,SHANG Jun1,2,LI Lai-hao1,YANG Xian-qing1,TIAN Qian1,3
(1.South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,National R&D Center for Aquatic Product Processing,Guangzhou 510300,China;2.Guangdong Ocean University,Zhanjiang 524088,China;3.Ocean University of China,Qingdao 266003,China)
For preparation of the antioxidation activity peptide from Pinctada fucata muscle,various peptides existed in the hydrolysate from Pinctada fucata muscle protein was fractionated by Sephadex G-25 gel filtration.The molecular weight,total antioxidant activity,DPPH free radical scavenging capacity and hydroxyl radical clear ability of each separated component of Pinctada fucata muscle oligopeptides were studied.The results showed that six fractional peptides were fractionated by Sephadex G-25 gel filtration from the Pinctada fucata muscle protein hydrolysate,and the relative molecular weight were 1437.5,833.7,421.9,244.7,89.0,17.4u,respectively.The functional active oligopeptides such as F1(1437.5u),F2(833.7u),F4(244.7u)antioxidant effect were strong,especially F2(833.7u)oligopeptide had the strongest total antioxidant ability,DPPH free radical scavenging capacity and hydroxyl radicals clear ability.The study provided a technical support for the development and utilization of antioxidation activity peptides from Pinctada fucata muscle.
Pinctada fucata muscle;oligopeptides;molecular weight;antioxidation activity
TS254.1
A
1002-0306(2012)07-0123-04
2011-06-29
吴燕燕(1969-),女,研究员,研究方向:水产品加工与质量安全控制。
海南省重点科技项目(070121、ZDXM20100005);广东省科技计划项目(2011B031200009)。

