产漆酶绿色木霉的筛选、鉴定和产酶条件优化
巫小丹,徐尔尼,刘玉环,阮榕生
(1.南昌大学生物质转化教育部工程研究中心,江西南昌330047;2.南昌大学生命科学与食品工程学院,江西南昌330031;3.南昌大学食品科学与技术国家重点实验室,江西南昌330047)
产漆酶绿色木霉的筛选、鉴定和产酶条件优化
巫小丹1,2,徐尔尼2,3,刘玉环1,3,阮榕生1,3
(1.南昌大学生物质转化教育部工程研究中心,江西南昌330047;2.南昌大学生命科学与食品工程学院,江西南昌330031;3.南昌大学食品科学与技术国家重点实验室,江西南昌330047)
木质素是稻草秸秆的主要成分之一,要实现稻草秸秆的糖化以达到开发利用的目的,首先要解除木质素的包裹阻碍作用。生物预处理去除木质素因具有温和、低耗和环保等优点而成为研究的热点。采用PDA-愈创木酚法筛选到一株能够高效产漆酶的木霉,鉴定结果为绿色木霉(Trichoderma viride)。对其进行单因素实验优化产纤维素酶发酵条件,最佳产酶发酵条件为:摇床转速120r/min、接种量为6%、pH5.5、培养温度28℃、培养时间3d,在此条件下CMCase、FPA和βG酶活力分别达(2.73±0.08)、(0.95±0.09)、(1.75±0.12)IU/mL。
木质素,漆酶,绿色木霉,优化
大量研究表明稻草秸秆的木质化结构会大大降低纤维素酶分子和纤维素分子之间的亲和性,影响纤维素酶有效降解纤维素的过程[1]。因此,要实现木质纤维素的酶解糖化,必须对木质纤维素进行预处理,木质纤维素预处理效率是限制纤维素资源应用的主要因素之一。木质纤维素原料预处理方法主要有物理法、化学法、物理化学法和生物法,其中生物法因处理过程温和、对设备要求较低、能耗低而越来越受到广大研究者的关注。目前报道的木质素降解菌多为白腐真菌、褐腐真菌和软腐真菌[2-5],尤其以白腐真菌为主,但因生长周期长而限制了利用白腐真菌进行木质纤维素生物预处理的发展。因此,筛选高效降解木质纤维素的菌株,确定其产酶发酵工艺,对秸秆生物质资源的开发利用具有重要意义。微生物降解木质素主要依赖于三种酶:木质素过氧化物酶(LiP)、锰过氧化物酶(MnP)和漆酶(Lac)。Ander等[6]研究发现Sporotrichum pulverulentum的野生型与酚氧化酶回复突变型菌株均具备降解木质素的能力,而突变型菌株只有在人为添加了漆酶后,才能将木质素降解,这充分证实了漆酶在木质素降解中的重要作用。微生物产生的漆酶可使原本在培养基中均匀分布的无色愈创木酚发生聚合,产生红褐色醌类化合物,形成肉眼可见的有色氧化环带。因此以添加了愈创木酚的PDA培养基为鉴别培养基进行漆酶产生菌的筛选[7],根据氧化带直径的大小和褐变速度的快慢可快速判断菌株产漆酶性能的高低。本研究筛选到了一株能高效产漆酶的绿色木霉(Trichoderma viride),并对其产纤维素酶条件进行了研究,以期为秸秆生物质工业化开发利用提供必要的理论依据。
1 材料与方法
1.1 材料与仪器
朽木 采自福建省龙岩市;平菇(Pleurotus ostreatus) 本实验室保存;增殖培养基 木屑2%、(NH4)2SO40.2%、KH2PO40.2%、MgSO4·7H2O 0.03%、CaCl20.3%、微量元素0.1mL/10mL(微量元素成分:FeSO4·7H2O 0.5%、MnSO40.16%、ZnCl20.17%、CoCl20.17%);筛选培养基(愈创木酚-PDA培养基[8]) 添加了0.04%愈创木酚的PDA固体培养基;种子培养基 PDA液体培养基;发酵培养基[9]稻草粉6%、麸皮3%、豆饼粉3%、玉米粉2%、KH2PO40.5%、CaCl20.3%。
150A型生化培养箱 广东省中山市富华电器有限公司;THZ-C型恒温振荡器 江苏省太仓实验设备厂;LXT-2型离心机 上海市医用分析仪器厂;DF-101S型恒温水浴锅 巩义市英峪予华仪器厂;UV 751GD型紫外/可见分光光度计 上海分析仪器厂。
1.2 实验方法
1.2.1 菌种的增殖、分离纯化和鉴定 增殖:取一定量的朽木置于装有50mL无菌水和玻璃珠的三角瓶中,振荡打散均匀后,取3mL悬浊液接种于增殖培养基中,28℃、120r/min振荡富集培养12d,实现木质素降解菌的选择性富集培养。
分离纯化:用接种环蘸取已增殖富集后的培养液于愈创木酚-PDA培养基上进行划线分离,选取菌落周围出现红褐色环带的菌落进行进一步的分离纯化,最后选取褐变速度快、褐变圈大的菌株进行斜面保藏。
鉴定:形态学鉴定:将纯化的菌株NSW-XM点种在PDA平板上,28℃培养,连续几天观察菌落外观形态、菌丝生长情况、孢子萌发情况等,并结合光学显微镜下的菌丝体、分生孢子形态观察,参考《真菌鉴定手册》[10]对菌株进行分类鉴定。18S rDNA测序鉴定:提取菌株NSW-XM的DNA,采用真菌通用引物进行特异性扩增18S rDNA,将纯化后的DNA片段连接到载体上,转化入大肠杆菌DH5α菌株感受态细胞,挑取阳性克隆子,交由南京金斯瑞生物科技有限公司进行测序,将序列进行BLAST比对,确定其在分类学上的地位。
1.2.2 绿色木霉NSW-XM发酵稻草秸秆产纤维素酶条件研究 采用单因素优化实验,从摇床转速、接种量、培养基初始pH、发酵温度、发酵时间等主要影响因素对绿色木霉NSW-XM进行发酵稻草产酶工艺的优化,通过测定FPA、CMC、β-Gluase的酶活,以酶活大小为考察指标优化产酶条件。方法如下:将发酵液先经两层纱布过滤,除去固形物和菌体,滤液4000r/min离心25min,所得上清液即为粗酶液,测其CMCase、 FPA和βG活力[9],综合分析绿色木霉NSW-XM在稻草粉发酵培养基中的产纤维素酶能力。
1.2.2.1 CMCase酶活的测定 吸取0.5mL稀释适当倍数的粗酶液,以1mL 1%CMC-Na溶液为底物,1.5mL pH4.8醋酸钠-醋酸缓冲溶液为反应环境,置于50℃水浴保温30min,取出用DNS比色法测定反应液中还原糖的含量,最后以产物的生成量来衡量酶活的大小。
1.2.2.2 FPA酶活的测定 吸取0.5mL稀释适当倍数的粗酶液,以新华滤纸条(1cm×6cm)为底物,2.5mL pH4.8醋酸钠-醋酸缓冲溶液为反应环境,置于50℃水浴保温60min,取出用DNS比色法测定反应液中还原糖的含量,最后以产物的生成量来衡量酶活的大小。
1.2.2.3 βG酶活的测定 吸取0.5mL稀释适当倍数的粗酶液,以1mL 1%水杨素溶液为底物,1.5mL pH4.8醋酸钠-醋酸缓冲溶液为反应环境,置于50℃水浴保温30min,取出用DNS比色法测定反应液中还原糖的含量,最后以产物的生成量来衡量酶活的大小。
酶活定义:在50℃,pH4.8条件下,每分钟分解底物生成1μmol葡萄糖的酶量定义为1个酶活单位(IU)。
2 结果与讨论
2.1 菌株的筛选和鉴定
2.1.1 筛选 依据愈创木酚-PDA培养基的褐变程度、褐变速度,从福建省龙岩市取样的朽木中筛选到一株产漆酶能力强的菌株,编号为NSW-XM,培养2d即可在愈创木酚-PDA培养基中形成直径达3.0~4.0cm的红褐色氧化带(见图1)。平菇是一种有效降解木质素的白腐真菌,对实验室保藏菌平菇进行产漆酶能力检测,结果表明平菇在愈创木酚-PDA培养基中培养7d,仅形成直径达3.0cm的红褐色氧化带(见图2)。由此可见菌株NSW-XM的漆酶活性比平菇强得多。

图1 培养2d时,菌株NSW-XM在愈创木酚-PDA培养基中的显色反应Fig.1 The tinctorial reaction of NSW-XM on the guaiacol-PDA plate after 2 days

图2 培养7d时,平菇在愈创木酚-PDA培养基中的显色反应Fig.2 The tinctorial reaction of Pleurotus ostreatus on the guaiacol-PDA plate after 7 days
2.1.2 菌株NSW-XM的鉴定
2.1.2.1 菌株平板菌落形态观察 见图3,PDA平板上,菌落先以白色绒毛样向四周扩展,后从菌落中央萌生绿色孢子,中央渐渐变成绿色,菌落周围仍有放射状白色菌丝生长带。菌丝体在培养基浅层伸展,和培养基结合较为牢固。菌落扩展迅速,培养2d菌落直径即可达7.0~8.0cm。
菌丝、分生孢子梗及孢子的显微形态观察(见图4~图7,放大倍数为10×40):菌丝白色,有横隔;分生孢子梗不规则,分枝繁复,分生孢子梗上有对生或互生分枝,产孢瓶体端部尖削,微弯;尖端生分生孢子团,含孢子4~12个;分生孢子球形至卵形。

图3 NSW-XM在PDA平板上的菌落形态Fig.3 The colony characteristic of NSW-XM on the PDA plate

图4 NSW-XM的菌丝Fig.4 The mycelia of NSW-XM

图5 NSW-XM的菌丝(示横隔结构)Fig.5 The mycelia of NSW-XM(show the transverse septa)

图6 NSW-XM的分生孢子梗Fig.6 The conidiophore of NSW-XM

图7 NSW-XM的分生孢子Fig.7 The conidia of NSW-XM
参照《真菌鉴定手册》的形态学描述与分类标准,初步鉴定菌株NSW-XM为半知菌亚门,丝孢纲,丝孢目,丛梗孢科,木霉属,绿色木霉(Trichoderma viride),命名为Trichoderma viride NSW-XM。
2.1.2.2 18S rDNA序列比对结果 菌株NSW-XM与木霉属相似度较高,与形态学鉴定结果相符。
2.2 绿色木霉NSW-XM发酵稻草秸秆产酶条件研究
2.2.1 摇床转速对产酶的影响 摇床转速对绿色木霉NSW-XM产纤维素酶的影响如图8所示。从图中可见,在一定范围内,随着摇床转速的加大,发酵液中溶解氧浓度提高,而且菌丝与发酵液中的营养充分接触,获得充足的营养,NSW-XM产纤维素酶能力逐渐增大,尤其在摇床转速从60r/min增至90r/min时,产酶活力迅速增加,但当振荡速度达到180r/min时,因振荡过于剧烈,菌丝受到伤害,产酶能力明显下降。由图可见NSW-XM的最佳摇床转速为120r/min。

图8 摇床转速对绿色木霉NSW-XM产纤维素酶的影响Fig.8 Effect of the rotational speed on cellulose production by Trichoderma viride NSW-XM
2.2.2 接种量对产酶的影响 接种量对绿色木霉NSW-XM产纤维素酶的影响如图9所示。从图中可见,接种量对NSW-XM发酵产酶的影响较小,可能是因为菌株NSW-XM生长速度快,少量种源即可实现快速增殖,但当接种量过大时,培养液黏度增加,易造成溶氧不足、菌丝营养不足,且产生大量的生物热,使产酶活力略微下降。由图可见NSW-XM的最适接种量为6%。

图9 接种量对绿色木霉NSW-XM产纤维素酶的影响Fig.9 Effect of inoculation amount on cellulose production by Trichoderma viride NSW-XM
2.2.3 培养基初始pH对产酶的影响 培养基初始pH对绿色木霉NSW-XM产纤维素酶的影响如图10所示。从图中可见,培养基初始pH对NSW-XM产酶活力影响较大,pH5.5时酶活力最大,过酸或过碱都会引起酶活的显著变化,这与一般认为霉菌在酸性条件下有利于产纤维素酶是比较符合的。由图可见NSW-XM的最适培养基初始pH为5.5。

图10 培养基初始pH对绿色木霉NSW-XM产纤维素酶的影响Fig.10 Effect of initial pH on cellulose production by Trichoderma viride NSW-XM
2.2.4 发酵温度对产酶的影响 发酵温度对绿色木霉NSW-XM产纤维素酶的影响如图11所示。从图中可见在一定的温度范围内,温度升高,NSW-XM代谢速率相应提高,酶活力得到提高。过高或过低的温度均会降低代谢速率,温度较低时(如20℃),NSW-XM菌体生长较慢,酶活力偏低;温度较高时(如34℃),菌体过早老化,酶活力亦偏低。由图可见NSW-XM的最适发酵温度为28℃。
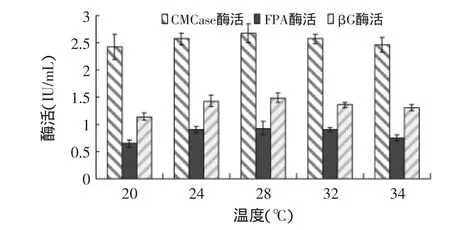
图11 发酵温度对绿色木霉NSW-XM产纤维素酶的影响Fig.11 Effect of fermentation temperature on cellulose production by Trichoderma viride NSW-XM
2.2.5 发酵时间对产酶的影响 发酵时间对绿色木霉NSW-XM产纤维素酶的影响如图12所示。从图中可见,培养初期,菌体生长较弱,酶分泌量少,酶活力较低,第3d纤维素酶活力达到高峰,继续培养,菌体发生老化,产酶能力逐渐下降,随着酶的失活而呈现酶活降低趋势,但在发酵产酶的第6d FPA和βG酶活力出现回复现象,可能是因为此时菌体发生自溶,细胞表面被膜束缚的纤维素酶被释放出来,这与肖舸等[11]的研究结果相类似。由图可见NSW-XM的最适发酵时间为3d。

图12 发酵时间对绿色木霉NSW-XM产纤维素酶的影响Fig.12 Effect of fermentation time on cellulose production by Trichoderma viride NSW-XM
3 结论
本文利用PDA-愈创木酚法可快速筛选到产漆酶能力强的菌株,从朽木中筛选出的高产漆酶菌株为绿色木霉NSW-XM(Trichoderma viride NSW-XM),该菌株生长速度快,产漆酶能力远远强于平菇。刘敏[12]、王丽娟[13]、姜明国[14]也筛选到了漆酶高产菌株绿色木霉,并对菌株的发酵产漆酶能力进行优化研究。本文通过平板培养初步比较了漆酶高产菌平菇和Trichoderma viride NSW-XM的产漆酶能力,确定了所筛菌株Trichoderma viride NSW-XM的产漆酶优越性,并结合稻草秸秆开发利用目的进一步详细研究该高产漆酶菌株的产纤维素酶能力。
单因素优化实验得到Trichoderma viride NSWXM的最佳发酵稻草秸秆产纤维素酶条件:摇床转速120r/min,接种量6%,培养基初始pH5.5,发酵温度28℃,发酵时间3d。在此最佳发酵培养条件下Trichoderma viride NSW-XM的FPA、CMCase、β-Gluase分别为(2.73±0.08)、(0.95±0.09)、(1.75±0.12)IU/mL。
根据以上实验结果,最终确定绿色木霉为高效木质纤维素降解菌,为后期进一步研究稻草秸秆降解工艺条件及混菌发酵奠定了良好的基础。
[1]张建安,张小勇,韩润林,等.木素对纤维素酶解的影响及纤维素酶解[J].化学工程,2000,28(1):37-39.
[2]Bumpus J A,Aust S D.Biodegradation of environmental pollutants by the white rot fungus Phanerochaete chrysosporium:Involvement of the lignin degrading system[J].Bioessays,2005,6(4):166-170.
[3]Gupte A,Huttermann A,Majcherczyk A,et al.Ligninolytic enzyme production under solid state fermentation by white-rot fungi[J].Journal of Scientific and Industrial Research,2007,66:611-614.
[4]Liang J F,Huang H S,Zhang K Q,et al.Study on the screening of the lignin-degrading fungus and the degradation of straws[J].Acta Agriculturae Boreali-Sinica,2009,24(5):206-209.
[5]Patel H,Gupte A,Gupte S.Laccase from Pleurotus ostreatus HP-1[J].Bioresources,2009,4(1):268-284.
[6]Ander P,Eriksson K E.The importance of phenol oxidase activity in lignin degradation by the white-rot fungus sporotrichum pulverulentum[J].Archives of Microbiology,1976,109:1-8.
[7]王宜磊,邓振旭,赵良田.彩绒革盖菌愈创木酚氧化酶活性研究[J].植物学通报,2000,17(5):462-465.
[8]王宜磊,朱陶,邓振旭.愈创木酚法快速筛选漆酶产生菌[J].生物技术,2007,17(12):40-42.
[9]汪金萍.单菌株发酵和混合菌株发酵产纤维素酶的研究[D].南昌:南昌大学,2007.
[10]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[11]肖舸,雷芳,喻东,等.一株产纤维素酶绿色木霉的筛选及发酵条件优化 [J].四川大学学报:自然科学版,2004,41(2):422-425.
[12]刘敏,张明.一株产漆酶菌株的筛选鉴定和发酵条件的研究[J].生物学杂志,2008,25(3):40-43.
[13]王丽娟,何培新,李明丽.漆酶高产菌株的筛选及产酶条件优化[J].郑州轻工业学院学报:自然科学版,2010,25(4):29-31.
[14]姜明国,黎海菲,陆冠颖,等.木质素降解菌Bax的筛选及特性研究[J].生物技术通报,2011(3):200-203.
Screening,identification and fermentation conditions optimization of Trichoderma viride in producing laccase
WU Xiao-dan1,2,XU Er-ni2,3,LIU Yu-huan1,3,RUAN Rong-sheng1,3
(1.EngineeringResearchCenterforBiomassConversion,MinistryofEducation,NanchangUniversity,Nanchang330047,China;2.School of Life Sciences and Food Engineering,Nanchang University,Nanchang 330031,China;3.The State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
Before saccharification of rice straw,the impediment of lignin which is a major component of rice straw should be removed above all.There are many pretreatment ways.The current study is focused on biological pretreatment which has many advantages such as mild,low consumption and environmental protection,etc.A strain named Trichoderma viride NSW-XM which could produce laccase efficiently was screened by the solid medium of PDA-guaiacol.The best fermentation conditions for cellulose enzyme production were studied by single-factor test.The results were as follows:shaking speed 120r/min,inoculum 6%,pH5.5,culture temperature 28℃,incubation time 3d.Under these conditions,the activity of CMCase,FPA,and βG reached(2.73±0.08),(0.95±0.09),(1.75±0.12)IU/mL respectively.
lignin;laccase;Trichoderma viride;optimization
TS201.2
A
1002-0306(2012)07-0165-05
2011-06-22
巫小丹(1984-),女,硕士,研究方向:生物质资源开发与利用。
江西省教育厅重点科技项目(GJJ09016)。

