一种植物乳杆菌对干酪模型成熟中微生物及蛋白质水解的影响
莫蓓红,赵 建,苗君莅,陈 卫
(1.光明乳业股份有限公司技术中心,乳业生物技术国家重点实验室,上海200072;2.江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡214122)
一种植物乳杆菌对干酪模型成熟中微生物及蛋白质水解的影响
莫蓓红1,赵 建2,苗君莅1,陈 卫2
(1.光明乳业股份有限公司技术中心,乳业生物技术国家重点实验室,上海200072;2.江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡214122)
采用无菌条件下生产的新鲜干酪凝块制作干酪模型,以WSN,12%TCASN和氨基酸含量等为指标测定植物乳杆菌SP-3对其的促熟作用。微生物测定表明SP-3在干酪模型的成熟过程中(12d)能保持较高的浓度;WSN结果表明SP-3对干酪中蛋白质的初级水解无显著影响;12%TCASN的结果表明SP-3影响了干酪中小肽的形成;5%PTA-SN和总游离氨基酸浓度测定结果表明植物乳杆菌SP-3促进了体系中游离氨基酸的产生;游离氨基酸的分析显示谷氨酸、亮氨酸、组氨酸的含量明显高于对照组,而丝氨酸、赖氨酸、脯氨酸的含量低于对照组。以上结果表明,植物乳杆菌SP-3能加快干酪体系中蛋白质的水解进程,具有促进干酪成熟的作用。
植物乳杆菌,干酪模型,蛋白质水解
干酪成熟是一个非常缓慢而且昂贵的过程,加速干酪成熟可以有效地降低生产成本,从而受到业界普遍的关注。在干酪生产中添加适合的附属发酵剂(adjunct cultures),是加快干酪后熟的常用方法之一,它能加快干酪生化反应的进程,并促进风味物质的形成,从而起到加快干酪成熟的目的。将乳杆菌作为附属发酵剂用于干酪生产[1],这已被许多研究者证实,并被应用于实际生产中。Milesi[2]等在2008年对植物乳杆菌I91在切达干酪和软质干酪两种模型成熟过程中的作用进行了研究,结果表明添加植物乳杆菌I91作为附属发酵剂,对干酪的产酸和成分没有影响,但加速了两种模型中蛋白质的次级水解进程。为了快速准确评价添加特定菌株对干酪成熟及品质的影响,许多研究者通过建立模型来模拟干酪环境。Kristoffersen等[3]报道了采用新鲜的浆状干酪可以加快成熟。浆状干酪体系(cheese slurry system)中含有较高的水分,并且由于采用了较高的成熟温度(30~32℃),达到了快速成熟的效果。许多研究者已采用或改进了此模型,将其作为一种快速可靠的工具用来评价不同的添加物对干酪成熟的影响[4-6]。为了消除外界野生非发酵剂乳酸菌(Non-Starter Latic Acid Bacteria,NSLAB)的影响,有些研究者曾采用超高温处理的牛乳来制作干酪模型。但超高温处理使乳中酪蛋白和乳清蛋白结构发生一定程度的变化,影响凝乳效果。本实验通过控制干酪凝乳以及干酪模型制备的环境,使外界野生非发酵剂乳酸菌的影响降到最低,来评价一株筛选到的附属发酵剂植物乳杆菌SP-3对干酪模型中微生物及蛋白质水解的影响,为考量其作为附属发酵剂应用于干酪生产的可行性。
1 材料与方法
1.1 材料与仪器
发酵剂菌种 丹麦Dansico嗜温性干酪发酵剂,含乳酸乳球菌乳脂亚种(Lactococcus lactis subsp. cremoris)和乳酸乳球菌乳酸亚种(Lactococcus lactis subsp.lactis);植物乳杆菌SP-3 光明乳业技术中心筛选并保藏;生鲜乳 采自上海第九牧场;MRS培养基、ROGOSA琼脂培养基 德国Merck公司;甲醇、三氟乙酸、乙腈 美国Sigma公司,色谱纯;凝乳酶 购于丹麦Dansico公司;其他试剂均为分析纯。
干酪槽FT20-A 美国Armfield;匀浆机TW20 Ultra TURRAX® 德国IKA公司;液相色谱仪HP1100 美国Agilent公司;紫外分光光度计UV-754 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 工作发酵剂的制备 主发酵剂的活化:将菌粉接种于10%灭菌脱脂乳中,30℃培养至凝乳,作为工作发酵剂,4℃冷藏保存。
受试植物乳杆菌SP-3的活化:将植物乳杆菌SP-3分别接入MRS培养基中,30℃下培养24h,连续活化两代,以2%(v/v)的接种量接入MRS液体培养基,增殖培养,待增殖至对数生长期时,将培养液取出,冷冻离心(5000r/min,15min,4℃),收集菌体。将菌体重新悬浮于10%灭菌脱脂乳中,作为实验用附属发酵剂,4℃冷藏保存。
1.2.2 干酪模型的制作
1.2.2.1 干酪凝块制作的环境要求[7]于无菌室内制作,制作过程中所用的搅拌器及切割刀具等器具在使用前采取137℃,5min蒸汽直喷灭菌。采用敞口的MRS平板法(平板敞口放置1h,32℃培养48h)检测环境的清洁状况。
1.2.2.2 干酪凝块的制作工艺 原料乳→巴氏杀菌(78℃,15s)→冷却(31℃)→接入菌种→充分搅拌→静置发酵→添加凝乳酶(溶于水,用0.22μm膜过滤除菌后加入)→搅拌→凝乳→切割→热烫、排乳清→凝块堆砌(持续至乳清pH达到5.5)→切块即得干酪凝块
1.2.2.3 干酪模型的制作 取新鲜干酪凝块100g装入专用无菌袋中,再加入50mL的5%的灭菌NaCl溶液(对照样)或47mL的灭菌NaCl溶液和3mL的1.2.1菌株脱脂乳悬浮液(实验样),于拍打机上打成浆状,封口。对照样与实验样同置于30℃下培养,分别于0、3、 6、9、12d取样分析。以上操作均在无菌室内进行。
1.2.3 干酪模型成分分析 脂肪、蛋白质:采用GB/T 5009.46-2003方法测定;pH:将10g干酪模型加入10mL去离子水,匀浆后用pH计直接测定;NaCl:采用硝酸银滴定法测定;水分:采用GB/T 5009.3-2003方法测定。
1.2.4 干酪模型成熟过程中的微生物变化分析 分别于0、3、6、9、12d取样,用ROGOSA琼脂培养基进行乳酸杆菌计数。
1.2.5 干酪模型成熟过程中的蛋白质水解情况的测定
1.2.5.1 可溶性氮(WSN)的测定方法[8]干酪模型与去离子水1∶2混合,在高速匀浆后,在50℃水浴保温40min,然后离心(9000r/min,30min,4℃),去除上层脂肪和下层沉淀,中层清液通过玻璃绒过滤后即得干酪模型的水溶性提取液(WSE)。水溶性氮(WSN)的测定采用凯氏定氮法测定。
1.2.5.2 12%三氯乙酸溶液中可溶性氮(12%TCA-SN)的测定方法[9]取1.2.5.1制备的提取液16mL,加4mL 48%(w/v)TCA溶液,离心(4000r/min,20min,4℃),除去上层脂肪和底层的蛋白质,取中层溶液进行凯氏定氮。
1.2.5.3 5%磷钨酸溶液中可溶性氮(5%PTA-SN)的测定方法 取1.2.5.1制备的提取液10mL,加2.5mL 20%(w/v)PTA溶液,离心(4000r/min,20min,4℃),除去上层脂肪和底层的蛋白质,取中层溶液进行凯氏定氮。
1.2.5.4 干酪模型成熟过程中总游离氨基酸含量的测定 采用镉-茚三酮法测定。WSE冻干粉重新溶解于去离子水中(1%,w/v),然后用0.1mol/L的氢氧化钠溶液调节pH至7.0。取0.2mL的溶液用去离子水稀释至1.0mL,然后加入2.0mL的镉-茚三酮溶液,84℃下加热5min,冷却10min后测定507nm下的吸光值(A507nm),根据总游离氨基酸标准曲线将A507nm值转化为亮氨酸浓度。
1.2.5.5 HPLC分析干酪模型中游离氨基酸含量 10mg WSE冻干粉溶于1mL去离子水中,用0.45μm膜过滤后,用液相色谱进行分离。
液相色谱条件:色谱柱:HYPERSIL ODS C18,5μm 4.0mm×125mm;流动相:A:2.72g醋酸钠(NaAc·3H2O)加水至1000mL,加180μL三乙胺,用1%醋酸调节pH至7.20,再加3.0mL四氢呋喃,混合,经滤膜过滤;B:2.72g醋酸钠(NaAc·3H2O)加水至200mL,用1%醋酸调节pH至7.20,加400mL乙腈、400mL甲醇,混合,经滤膜过滤;柱温:40℃;检测波长:0~17min时338nm,17min后262nm。洗脱条件见表1。

表1 HPLC测定干酪模型中游离氨基酸含量洗脱条件Table 1 HPLC gradient table for determination of free amino acid in cheese sample
结果计算:X=(As×Csd×Vsd×F×M×100)/(Asd×m×Vs)
式中:X-试样氨基酸的含量,mg/100g;As-试样峰面积;Csd-标样氨基酸浓度,mg/mL;Asd-标准溶液峰面积;Vsd-标准溶液进样量,μL;Vs-试样溶液进样量,μL;F-试样稀释倍数;m-试样质量,g;M-氨基酸的相对分子质量。
2 结果与讨论
2.1 干酪模型的组成分析结果

表2 干酪模型组成成分分析结果Table 2 Physico-chemical composition of cheese sample
一般切达干酪水分含量最高为36%,由表2结果可以看出,与切达干酪相比,干酪模型的水分含量较高,这样的环境有利于微生物的生长,特别供试乳杆菌的生长,并且能够提高酶的活性[10]。另外,本实验采用了较高的成熟温度,这些条件的改变可使干酪模型的成熟加速,缩短了实验时间。总体来说,本实验模型与切达干酪的脂肪、蛋白和盐分的组成较为接近,较高的水分又为成熟提供了良好的条件,加上该模型从建立至今,已为众多研究者所采用,并验证了它加速干酪风味的形成、蛋白的降解和脂肪的水解等成熟效果,因此,采用此模型来检验筛选的附属发酵剂菌种具有较好的可行性。
2.2 干酪模型成熟过程中的pH变化情况

表3 干酪模型成熟过程中的pH变化情况Table 3 Change of pH during cheese ripening
由表3可以看出,干酪模型在成熟过程中的pH范围为4.9~5.4,与普通切达干酪(pH5.1~5.4)相比略低,这是由于体系中水分含量的增加以及成熟温度的提高,使得干酪模型中残留的乳糖被快速利用。经方差分析,成熟过程中,两组干酪模型pH没有显著性差异(P>0.05),说明添加植物乳杆菌SP-3对体系的pH无显著性影响。这与Milesi[2]使用植物乳杆菌I91作为附属发酵剂用于两种干酪模型中得到的结果是一致的。
2.3 干酪模型成熟过程中微生物的变化
采用ROGOSA培养基对不同成熟期的干酪模型中乳杆菌进行平板计数。

图1 干酪模型成熟过程中微生物变化情况Fig.1 Change of microorganism during cheese ripening
用乳杆菌选择性培养基ROGOSA对未添加SP-3的对照组干酪模型进行稀释平板计数,结果显示其中乳杆菌浓度小于10cfu/mL。虽然实验组干酪模型在ROGOSA琼脂平板上的菌落未做鉴定,但由于对照组中非发酵剂菌株未检出,故可以认为,ROGOSA琼脂计数结果可以反映乳杆菌SP-3在干酪模型中的生存情况。从图1中可以看出,乳杆菌SP-3在干酪模型12d的成熟过程中一直保持较高的浓度,这与资料报道的许多附属发酵剂菌株在干酪成熟过程中的变化情况是一致的[1-2]。成熟6d后,乳杆菌的浓度有所下降,这可能是由于乳杆菌发生了自溶。
2.4 植物乳杆菌SP-3对干酪模型中蛋白质水解情况的影响
干酪的主要成分是蛋白质和脂肪,蛋白质的降解程度直接关系到干酪成熟过程中质构的变化和风味的形成。蛋白质的降解产物包括一系列大小的肽、游离氨基酸及它们的降解产物。
2.4.1 添加植物乳杆菌SP-3对干酪模型中WSN的影响 水溶性提取物中小肽和氨基酸对干酪的风味起着直接的影响。因此,通过分析干酪的水溶性提取物(WSE)可以考察干酪中发酵剂及其它菌群对其中蛋白质降解的作用,进而推断其对干酪风味及品质的影响[11-12]。由图2中可以看出,随着成熟时间的不断推移,干酪模型中水溶性氮(WSN)的浓度不断增加,并且在成熟初期增长速率较快。这是因为在干酪成熟初期,在残留凝乳酶、发酵剂胞壁蛋白酶和乳内源胞浆酶的作用下,酪蛋白被降解成水溶性多肽,WSN/TN作为干酪成熟的指标之一可以直观地反映酪蛋白被降解的情况,说明干酪成熟过程中蛋白质水解进程、蛋白酶和凝乳酶的活性。经方差分析,两组间WSN的浓度无显著性差异(P>0.05),说明乳杆菌SP-3对酪蛋白的初级水解基本没有影响,这可能与植物乳杆菌缺乏某些与蛋白质初级水解相关的蛋白酶有关。

图2 干酪模型成熟过程中WSN/TNFig.2 Change of WSN/TN during cheese ripening
2.4.2 添加植物乳杆菌SP-3对干酪模型中12%TCASN的影响 三氯乙酸(TCA)是一种常用的蛋白质沉淀剂,用来分离成熟干酪中的氮组分。大量研究表明,TCASN主要是残留的凝乳酶和干酪中微生物细胞中肽酶的共同作用下形成的。12%TCASN作为干酪成熟的指标之一反映了蛋白质降解的深度,可用来考察干酪中肽酶的酶活[13]。从图3结果可见,随着成熟时间的不断推移,由于干酪中发酵剂细胞发生自溶而释放出胞内肽酶,在肽酶及残留的凝乳酶的共同作用下,大分子的肽被进一步降解为小肽和游离氨基酸,两组干酪模型中12%TCASN浓度不断增加。添加乳杆菌SP-3的干酪模型在成熟过程中12%TCASN浓度明显高于对照组(P<0.05),这说明菌株SP-3在成熟过程中也发生了自溶,释放出胞内肽酶,使得体系中肽酶的活力有所增强,加速了体系中小肽和游离氨基酸的产生,在一定程度上能起到对干酪促熟的作用。本实验结果也与Milesi[2]等发现的植物乳杆菌在切达干酪和软质干酪成熟过程中对蛋白质的次级水解有明显作用相一致。

图3 干酪模型成熟过程中12%TCASN/TN的变化Fig.3 Change of 12%TCASN/TN during cheese ripening
2.4.3 添加植物乳杆菌SP-3对干酪模型中5%PTASN的影响 磷钨酸(PTA)是一种极有选择性的蛋白质沉淀剂,除氨基二羧酸外,所有的游离氨基酸都可在PTA中溶解,而分子量大于600u的肽则会被沉淀出来[14]。因此,PTASN常用来表征干酪成熟期间游离氨基酸含量的多少。游离氨基酸主要是微生物(发酵剂和非发酵剂)产生的酶对酪蛋白和酪蛋白肽降解产生的。本实验中,由于控制了外界微生物的污染,5%PTASN的差异可以认为是由于乳杆菌SP-3产生的酶造成的。
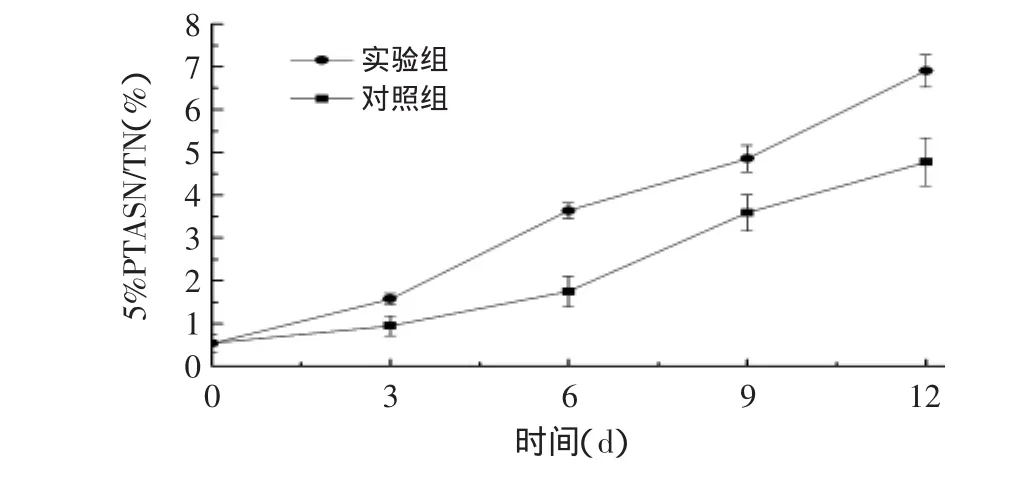
图4 干酪模型成熟过程中5%PTASN/TN的变化Fig.4 Change of 5%PTASN/TN during cheese ripening
由图4可见,干酪模型中5%PTASN的浓度随着成熟时间的推移呈显著性增加,添加乳杆菌SP-3的干酪模型中5%PTASN的浓度显然要比对照组高,说明SP-3能够促进体系中游离氨基酸的释放。游离氨基酸对切达干酪的风味有直接贡献,也是许多风味化合物形成的底物。
2.4.4 干酪模型成熟过程中总游离氨基酸含量测定镉-茚三酮试剂与干酪WSE中的游离氨基酸有专一性反应,因此A507nm的值与干酪中总游离氨基酸浓度直接相关。由于干酪中主要的游离氨基酸为亮氨酸和甘氨酸,本实验以亮氨酸的浓度代表体系中总游离氨基酸的浓度。干酪中游离氨基酸的产生主要是微生物胞内肽酶的作用。由图5可以看出,模型中总游离氨基酸的浓度随成熟时间的延长有显著性提高(P<0.001)。在干酪模型成熟初期,两实验组结果差异不太明显,随着成熟过程的不断进行,差异越来越明显。这可能是由于菌体细胞要在自溶后胞内肽酶才能释放,而这个过程是需要一定时间的[15]。经方差分析,在整个成熟过程中,两组结果具有显著性差异(P<0.001),SP-3的添加增加了模型内游离氨基酸的释放,这与2.4.2和2.4.3的分析结果一致。
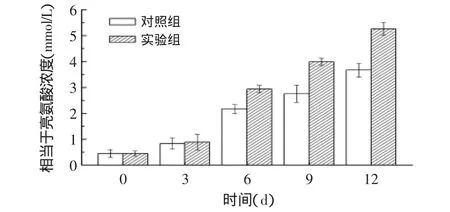
图5 干酪模型成熟过程中总游离氨基酸浓度的变化Fig.5 Change of total free amino acid concentration during cheese ripening
2.4.5 HPLC法分析干酪模型中的氨基酸组成 从图6可以看出,两组干酪模型中谷氨酸、亮氨酸、苯丙氨酸、缬氨酸和酪氨酸含量较高,这与成熟切达干酪的分析结果一致;添加乳杆菌SP-3的干酪模型与对照组相比,谷氨酸、组氨酸、亮氨酸的含量要明显高于对照组,而丝氨酸、脯氨酸、赖氨酸的含量则低于对照组。而Milesi[2]发现在添加了植物乳杆菌I91的干酪模型中60d后脯氨酸和酪氨酸的含量要显著高于对照组,这个结果与本实验结果有较大的差异,可见不同菌株的植物乳杆菌产生的胞内肽酶有所不同,因此,在水解蛋白质时产生的代谢产物也不尽相同。这有可能对干酪的风味产生影响。

图6 成熟12d后干酪模型中游离氨基酸的含量Fig.6 The content of free amino acid in cheese samples after 12 days ripening
3 结论
本实验将筛选到的具有附属发酵剂潜力的植物乳杆菌SP-3添加到干酪模型中,31℃培养12d,期间测定体系中乳杆菌和蛋白质水解情况来评价SP-3加速干酪成熟的效果。结果表明SP-3在干酪模型成熟过程中(12d)能保持较高的浓度,这与资料报道的许多附属发酵剂菌株在干酪成熟过程中变化是一致的。成熟6d后,乳杆菌的浓度有所下降,这可能是由于乳杆菌发生自溶引起的;WSN结果表明SP-3对酪蛋白初级水解无明显影响,这说明将其应用于干酪生产时,不会引起酪蛋白的过度水解,从而对干酪的产量无影响;12%TCASN浓度的测定结果显示,菌株SP-3的加入改变体系中的肽酶水平,增强了干酪模型中总肽酶的酶活;5%PTASN和总游离氨基酸浓度的测定结果显示,SP-3能加强酪蛋白的三级水解,促进干酪模型中游离氨基酸的产生;对比两组干酪成熟12d的氨基酸含量,添加SP-3的干酪模型与对照组相比,谷氨酸、组氨酸、亮氨酸的含量明显高于对照组,而丝氨酸、脯氨酸、赖氨酸的含量低于对照组。综上所述,菌株SP-3能促进干酪模型中蛋白质水解的进程,加快小肽和游离氨基酸的产生。缩短干酪浆成熟时间,证明了其作为附属发酵剂的潜力,为其应用于实际干酪生产打下了良好的基础。
[1]S A Madkor,P S Tong,M El Soda.Ripening of cheddar cheese with added attenuated adjunct cultures of lactobacilli[J].Journal of Dairy Science,2000,83(8):1684-1691.
[2]Milesi M M,McSweeney P L H,Hynes E R.Viability and contribution to proteolysis of an adjunct culture of Lactobacillus plantarum in two model cheese systems:cheddar cheese-type and soft-cheese type[J].J Appl Microbiol,2008,105(3):84-92.
[3]T Kristoffersen,E M Mikolajcik,I A Gould.Cheddar cheese flavor.IV.Directed and accelerated ripening process[J].Journal of Dairy Science,1967,50(3):292-297.
[4]A J Cliffe,B A Law.Peptide composition of enzyme-treated Cheddar cheese slurries,determined by reverse phase high performance liquid chromatography[J].Food Chemistry,1990,36(1):73-80.
[5]Morsi El Soda,Sithian Pandian.Recent developments in accelerated cheese ripening[J].Journal of Dairy Science,1991, 74(7):2317-2335.
[6]Nana Y Farkye,Sabry A Madkor,Harriet G Atkins.Proteolytic abilities of some Lactic acid bacteria in a model cheese system [J].International Dairy Journal,1995,5(7):715-725.
[7]M R Muehlenkamp-Ulate,J J Warthesen.Evaluation of several Nonstrater Lactobacilli for their influence on Cheddar cheese slurry proteolysis[J].Journal of Dairy Science,1999,82(7):1370-1378.
[8]Kuchroo C N,Fox P F.Soluble nitrogen in cheddar cheese:comparison of extraction procedures[J].Milchwissenschaft,1982,37(6):331-335.
[9]Sousa M J,Ardo Y,McSweeney P L H.Advances in the study of proteolysis during cheese ripening[J].International Dairy Journal,2001,11(4):327-345.
[10]Fox P F.Proteolysis during cheese manufacture and ripening [J].Journal of Dairy Science,1989,72(6):1379-1400.
[11]Parra L,Requena T,Casal V,et al.Proteolytic activity of lactobacilli in a model goats’milk curd system[J].Lett Appl Microbiol,1996:23(6):375-388.
[12]Antonsson M,Ardo Y,Nilsson B F,et al.Screening and selection of Lactobacillus strains for use as adjunct cultures in production of semi-hard cheese[J].J Dairy Res,2002,69(3):451-472.
[13]郭本恒.干酪[M].北京:中国轻工业出版社,2004:241-251.
[14]Hickey M W,A J Hillier,G R Jago.Peptidase activities in lactobacilli[J].Aust J Dairy Tech,1983,9:118-123.
[15]Weimer B,B Dias,M Ummadi J,et al.Influence of NaCl and pH on intracellular enzymes that influence Cheddar cheese ripening[J].Lait,1997,77(3):383-398.
Study on influence on microorganism and proteolysis of cheese model containing Lactobacillus plantarum
MO Bei-hong1,ZHAO Jian2,MIAO Jun-li1,CHEN Wei2
(1.State Key Laboratory of Dairy Biotechnology,Technology Center Bright Dairy&Food Co.,Ltd.,Shanghai 200072,China;2.State Key Laboratory of Food Science and Technology,School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Cheese model was made aseptically using fresh cheese curd.The effect of Lactobacillus plantarum SP-3 on cheese model ripening was rapidly evaluated by WSN,12%TCASN and free amino acids contents etc. measurement.The result showed that SP-3 could keep at high level of concentration during its ripening period(12 days).The value of WSN indicated SP-3 had no influence on casein primary proteolysis.The significant difference of 12%TCASN indicated differences in peptide profiles between models with SP-3 compared with the control.5%PTA-SN and total free amino acids concentrations suggested SP-3 could improve the yield of free amino acids.The analysis of individual amino acids showed that model containing SP-3 released more glutamic acid,leucine and histidine than the control,while control contained more free amino acids such as serine,lysine and proline.In conclusion,SP-3 could accaclerate the proteolysis in the cheese model and promote its ripening.
Lactobacillus plantarum;cheese model;proteolysis
TS201.3
A
1002-0306(2012)07-0100-05
2011-07-21
莫蓓红(1978-),女,硕士研究生,工程师,研究方向:乳品发酵技术与新型干酪的研究开发。
上海市科委浦江人才计划(08PJ1431500)。

