双重抗性筛选辅酶Q10高产菌株
尹 鹏,魏宝东
(沈阳农业大学食品学院,辽宁沈阳110866)
双重抗性筛选辅酶Q10高产菌株
尹 鹏,魏宝东*
(沈阳农业大学食品学院,辽宁沈阳110866)
以米曲霉(Aspergillus oryzae)Asp11为出发菌株,利用紫外线诱变处理,以制霉菌素和维生素K3双抗性为筛选标记,获得制霉菌素抗性突变株Asp11-N006和制霉菌素及维生素K3双重抗性突变株Asp11-N006-V01,其合成辅酶Q10的能力较出发菌株显著提高。Asp11-N006和Asp11-N006-V01的辅酶Q10产量分别为28.27mg/L和38.46mg/L,较出发菌株分别提高了0.34倍和0.82倍,且遗传性状稳定。
米曲霉,辅酶Q10,诱变,抗性筛选
辅酶Q10是生物体内广泛存在的脂溶性醌类化合物,又称泛醌、癸烯醌,它是呼吸链中NADH脱氢酶、Ain酸脱氢酶和维生素B-C复合物之间的脂溶性电子载体,是细胞能量代谢的生成要素[1-2]。作为与能量转换有关的若干酶系统的辅助因子之一,它不仅是呼吸链上的氧化还原成分,更是生成ATP的必需辅酶[3]。辅酶Q10可与线粒体内膜相结合,在呼吸链中起载体作用;另外,因其醌式及侧链异戊烯基结构等特点,还是重要递氢体和细胞能量生成要素,并具有抗氧化和控制细胞内氧气流动等性能,在生命体中发挥着重要的生理功能[4]。它不仅是细胞自身天然的抗氧化剂、细胞代谢的促进剂和呼吸的激活剂,对清除自由基及稳定生物膜功能有着重要作用,还具有增强人体免疫功能、预防心脏病、保护肝脏和抗癌等作用[5]。因此,辅酶Q10在用于临床治疗疾病、提高免疫力和延缓人体衰老等方面有着不可代替的作用[6]。利用微生物发酵生产辅酶Q10是最具发展前途的生产方式。但是,有很多因素制约着发酵法工业化生产,而导致产量相对较低。其中,高产菌株的选育是目前发酵法生产辅酶Q10的研究关键。本实验从筛选辅酶Q10高产菌株出发,以米曲霉为出发菌株,定向筛选得到抗性突变株,以期能有所突破,提高辅酶Q10产量。米曲霉作为发酵生产辅酶Q10的新菌种,在国内外尚未见到相关报道。因此,通过本研究,以期为工业化生产辅酶Q10提供新的实践基础和理论依据。
1 材料与方法
1.1 材料与仪器
米曲霉(Aspergillus oryzae) 本院实验室保存;斜面培养基 PDA培养基(新鲜马铃薯200g、葡萄糖20g、琼脂20g、蒸馏水1000mL,pH自然);发酵培养基(%) 葡萄糖2.5、蔗糖2.5、蛋白胨1、酵母浸粉2、KH2PO40.1、K2HPO40.05、MgSO40.05,pH6.5;抗性培养基 采用PDA培养基,分别加入一定量的制霉菌素和维生素K3;辅酶Q10标准品 北京夏斯生物技术有限公司;制霉菌素、维生素K3美国Genview;其他试剂 均为分析纯和生化试剂。
PB-10 pH计 Sartorius Co.Ltd;恒温振荡培养箱 北京沃德电子实验设备厂;CT14RD台式高速冷冻离心机 上海天美科学仪器有限公司;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;TU-1810紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 孢子悬液的制备 取一支新鲜培养至孢子成熟的出发菌株试管斜面,加入5mL去离子水,轻轻振荡试管,洗下斜面上的孢子,转移至装有10mL无菌水的三角瓶(内含玻璃珠)中,再加入5mL去离子水冲洗斜面,并一同转入三角瓶,然后摇床振荡30min以充分打散孢子团,最后通过血球计数板计数,调整孢子悬液的浓度为107个/mL。
1.2.2 制霉菌素和维生素K3最小抑制浓度的确定 在PDA培养基中分别添加质量浓度为70、80、90、100、110、120、130、140μg/mL的制霉菌素,制成抗性平板,取0.2mL出发菌株制备的孢子悬液涂布于该抗性平板上,同时以未加制霉菌素的平板作为对照,30℃培养3~4d后观察菌落的生长状况。
在PDA培养基中分别添加质量浓度为120、130、140、150、160、170μg/mL的制霉菌素,制成抗性平板,将诱变得到的抗性菌株Asp11-N006制备孢子悬液,取0.2mL涂布于该抗性平板上,确定最小抑制浓度。在确定该浓度之后,在PDA培养基中添加该浓度的制霉菌素,同时添加质量浓度为320、340、360、380、400、420、440、460μg/mL的维生素K3制成抗性平板,取0.2mL抗性菌株Asp11-N006制备的孢子悬液涂布于该平板,同时以未加维生素K3的平板作为对照,30℃培养3~4d后观察菌落的生长状况。
1.2.3 紫外诱变 将20W的紫外灯开启预热20min,取5mL制备的孢子悬液于9cm的无菌培养皿中,置于紫外灯下垂直距离30cm处边磁力搅拌边照射,照射时间为5min,然后在红灯下吸取1mL紫外照射的孢子悬液适当稀释,涂布平板进行抗性筛选,同时以未经照射的空白组为平行对照。
1.2.4 平板初筛 将诱变后的孢子悬液适当稀释涂布于抗性平板上,30℃培养3~4d,挑取菌落生长快、孢子数量多的单菌落转接入斜面培养基,30℃培养后冷藏保藏,以备进一步摇瓶复筛。
1.2.5 摇瓶复筛 将初筛得到的抗性菌株按1.2.1的方法制备孢子悬液,调整浓度为109个/mL,然后按12%的接种量,直接将孢子悬液接到发酵培养基中,30℃、180r/min恒温振荡培养72h。离心收集菌体,测定辅酶Q10产量。
1.2.6 产物分离测定 利用碱醇皂化法[7]从菌体中提取辅酶Q10。采用薄层层析(TLC)分离浓缩发酵液中的辅酶Q10,并用紫外分光光度法[8]测定发酵液中辅酶Q10的产量。
2 结果与分析
2.1 米曲霉产辅酶Q10的确定
米曲霉为好氧型真菌,是重要且安全的工业发酵菌株[9]。将米曲霉作为出发菌株发酵培养后,对其菌体的萃取液进行浓缩,并定容于1mL无水乙醇中进行薄层层析分离,结果见图1。
由图1可以看出,出发菌株粗提品经TLC(薄层层析)分离,在与辅酶Q10标准品色带相同的Rf值处,也分离出了色带,刮下标准品色带和出发菌株粗提品色带,分别定容于3mL无水乙醇中,在190~330nm波长范围内进行紫外扫描,结果见图2。
由图2可以看出,出发菌株粗提品的紫外吸收峰型和辅酶Q10标准品的吸收峰型相一致,这说明米曲霉能合成辅酶Q10,其出发菌株的产量为21.09mg/L。

图1 辅酶Q10标准品与出发菌株粗提品的薄层层析图Fig.1 Thin-layer chromatogram of coenzyme Q10standard and the starting strains crude products

图2 出发菌株粗提品的紫外吸收光谱Fig.2 Ultraviolet absorption spectra of starting strain crude products
2.2 制霉菌素抗性突变株的筛选
在PDA培养基中分别添加质量浓度为70、80、90、100、110、120、130、140μg/mL的制霉菌素,制成抗性平板,取出发菌株制备的孢子悬液涂布于该抗性平板上,同时以未加制霉菌素的平板作为对照,30℃培养3~4d后观察菌落的生长情况,见表1。

表1 制霉菌素对菌体生长的影响Table 1 Effect of nystatin on cell growth
通过表1可以确定制霉菌素的最小抑制浓度为130μg/mL,并以此浓度作为抗性筛选标记。出发菌株Asp11的孢子悬液经紫外诱变处理,适当稀释后涂布于含制霉菌素浓度130μg/mL的抗性平板上,30℃培养3~4d,挑取生长良好的单菌落转接于PDA斜面。再经摇瓶复筛,得到8株产量高于出发菌株25%的制霉菌素抗性菌株,见表2。其中,抗性菌株Asp11-N006的产量提高幅度最大,辅酶Q10产量为28.27mg/L,较出发菌株提高了0.34倍。再对该抗性菌株连续传代十次,进行遗传稳定性实验。结果显示,随着传代次数的增加,各代菌株辅酶Q10产量从28.27mg/L到27.06mg/L,产量无明显减少,说明该突变株的性状能稳定遗传。

表2 抗性菌株的辅酶Q10产量Table 2 The production of coenzyme Q10from resistant strains
结果表明,选育制霉菌素抗性突变株,可以在一定程度上提高辅酶Q10产量。推测原因,制霉菌素作为一种大环内酯类真菌抑制剂,能和真菌细胞膜中的麦角固醇结合,引起细胞膜损伤,从而使细胞膜的通透性增加。可能由于制霉菌素抗性突变株的细胞膜通透性发生改变,从而增加了菌体对营养物质的吸收,有利于进一步合成辅酶Q10。
2.3 制霉菌素及维生素K3双重抗性突变株的筛选
在PDA培养基中分别添加质量浓度为120、130、140、150、160、170μg/mL的制霉菌素,制成抗性平板,取上述诱变得到的抗性菌株Asp11-N006制备的孢子悬液涂布于该抗性平板上,同时以未加制霉菌素的平板作为对照,30℃培养3~4d后观察菌落的生长状况,确定制霉菌素的最小抑制浓度,见表3。
在确定该浓度之后,在PDA培养基中添加该浓度的制霉菌素,同时添加质量浓度为320、340、360、380、400、420、440、460μg/mL的维生素K3制成双重抗性平板,取抗性菌株Asp11-N006制备的孢子悬液涂布于该平板,同时以未加维生素K3的平板作为对照,30℃培养3~4d后观察菌落的生长状况,见表3。
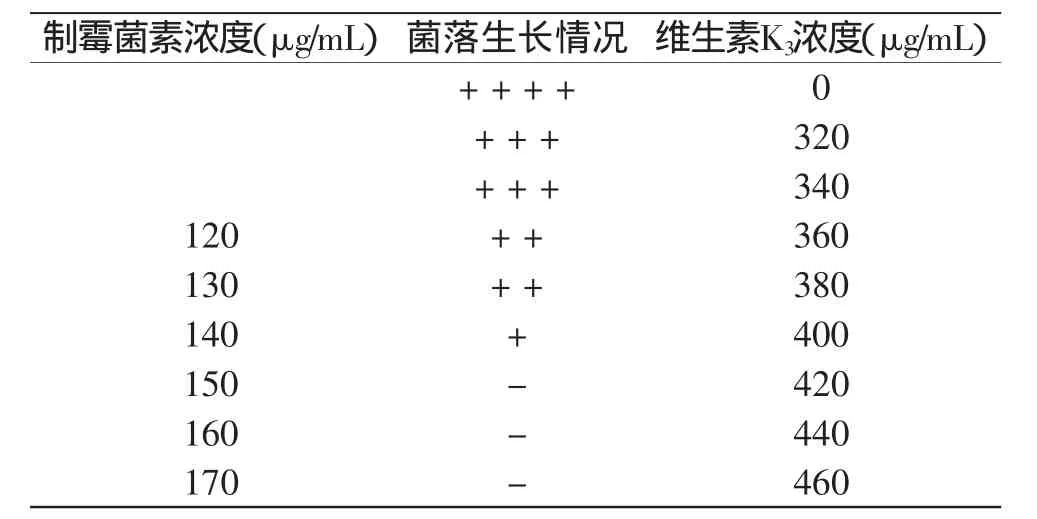
表3 维生素K3对菌体生长的影响Table 3 Effect of Vitamin K3on strain growth
通过表3可以确定制霉菌素的最小抑制浓度为150μg/mL、维生素K3的最小抑制浓度为420μg/mL,并以此浓度作为抗性筛选标记。将抗性菌株Asp11- N006的孢子悬液进行紫外诱变处理,适当稀释后涂布于含制霉菌素浓度150μg/mL和维生素K3浓度420μg/mL的抗性平板上,30℃培养3~4d,挑取生长良好、孢子数量多的单菌落转接于PDA斜面。再经摇瓶复筛,得到5株产量高于出发菌株50%的制霉菌素及维生素K3双重抗性菌株,其中,抗性菌株Asp11-N006-V01的产量提高幅度最大,辅酶Q10产量为38.46mg/L,较抗性菌株Asp11-N006提高了0.36倍,较出发菌株提高了0.82倍。再对该抗性菌株连续传代十次,进行遗传稳定性实验。结果显示,随着传代次数的增加,各代菌株辅酶Q10产量从38.46mg/L到37.23mg/L,产量无明显减少,说明该突变株的性状能稳定遗传。
结果表明,以制霉菌素抗性突变株为出发菌株,进一步筛选得到制霉菌素及维生素K3双重抗性突变株,有利于进一步提高辅酶Q10产量。在辅酶Q10合成过程中可能存在终产物抑制,筛选抗结构类似物突变株可从遗传角度解除微生物的正常代谢调控,有利于目的产物的合成。维生素K3是辅酶Q10的结构类似物,筛选出的突变株对维生素K3的耐受浓度提高,可能部分解除了终产物对参与辅酶Q10生物合成的有关酶的反馈抑制,从而提高了辅酶Q10的生物合成量。
2.4 抗性菌株产辅酶Q10的分离测定
图3 辅酶Q10标准品与抗性菌株粗提品的薄层层析图Fig.3 Thin-layer chromatogram of coenzyme Q10standard and resistant strains crude products
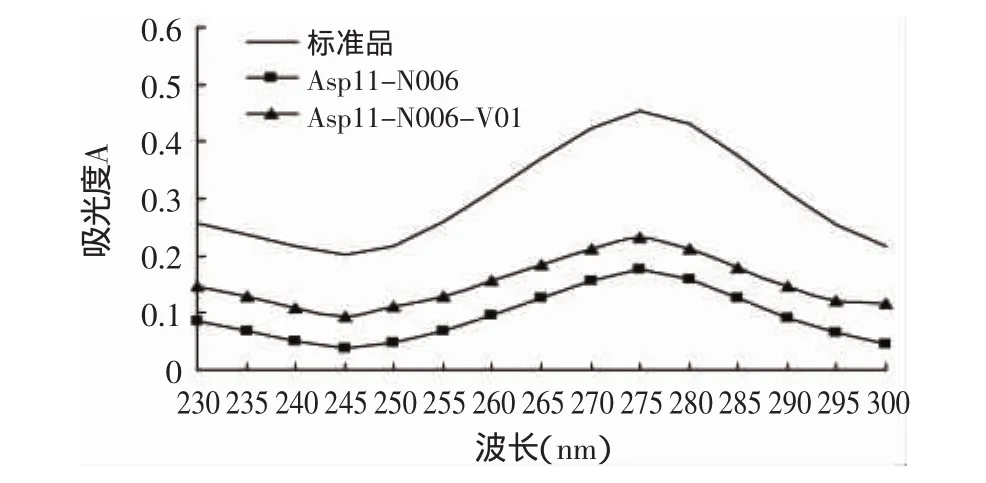
图4 抗性菌株粗体品的紫外吸收光谱Fig.4 Ultraviolet absorption spectra of resistant strain crude products
将上述筛选得到的抗性菌株Asp11-N006和Asp11-N006-V01进行发酵培养,发酵结束后离心收集菌体,采用碱醇皂化法提取菌体中的辅酶Q10,将所得粗提品定容至1mL无水乙醇中,进行薄层层析分离(见图3),定性测定辅酶Q10产量,并用紫外分光光度法定量测定发酵液中辅酶Q10的产量,结果见图4和表4。

表4 抗性菌株的辅酶Q10产量Table 4 The production of coenzyme Q10from resistant strains
3 结论
3.1 米曲霉为好氧型微生物,通过TLC(薄层层析分离)说明,在其生长代谢过程中能够合成辅酶Q10。
3.2 本实验选取了两个抗性筛选标记,通过紫外诱变选育到制霉菌素抗性突变株Asp11-N006和制霉菌素及维生素K3双重抗性突变株Asp11-N006-V01,对该菌株进行发酵培养,其辅酶Q10产量分别为28.27mg/L和38.46mg/L。相较出发菌株而言,产辅酶Q10能力分别提高了0.34倍和0.82倍,为实现工业化生产奠定了一定的基础。
[1]薛茂云.辅酶Q10的营养作用及应用[J].江苏调味副食品,2010,27(1):13-16.
[2]张惠展.途径工程[M].北京:中国轻工业出版社,2002.
[3]石若夫,熊璐璐.产辅酶Q10热带假丝酵母菌株C-1发酵过程优化[J].南京理工大学学报,2008,32(5):651-654.
[4]许芳,张淑荣,张鹏.酶解和冻融辅助超声提取光合细菌中辅酶Q10的研究[J].化学与生物工程,2008(8):43-45.
[5]KelsoGF,PorteousCM,HughesG.Prevention of mitochondrial oxidative damage using targeted antioxidants[J].AnnN YAcad Sci,2002,959:263.
[6]孟妤,单志萍.三孢布拉氏霉菌体中辅酶Q10测定方法的条件优化[J].食品工业科技,2009,30(9):162-164.
[7]张延静,袁其朋,梁浩.产辅酶Q10酵母的发酵条件研究[J].微生物学通报,2003,30(2):65-69.
[8]柴瑞震,姜仕华,蒋顺国,等.中国药品检验标准规范与药品质控工作法规全书[M].成都:成都科技大学出版社,1995:620.
[9]刘川顺,李平,李健.谷氨酰胺合成酶产酶菌株的筛选及酶学性质[J].农产品加工·学刊,2010(7):4-7.
Screening coenzyme Q10high-yielding strain with double resistance screening label
YIN Peng,WEI Bao-dong*
(College of Food Science,Shenyang Agricultural University,Shenyang 110866,China)
Aspergillus oryzae(Asp11)was used as the starting strain,through UV mutagenesis,obtained resistant mutants Asp11-N006 and Asp11-N006-V01 with double resistance of Nystatin and vitamin K3as screening label,and production of coenzyme Q10performance marked higher than the starting strain.The production of coenzyme Q10reached to 28.27mg/L and 38.46mg/L,improved into 0.34 times and 0.82 times by comparing with the starting strain.The mutant strains had stable genetic traits.
Aspergillus oryzae;coenzyme Q10;mutagenesis;resistance screening
TS201.3
A
1002-0306(2012)07-0150-04
2011-06-01 *通讯联系人
尹鹏(1985-),女,硕士研究生,研究方向:食品科学。

