TPX2在宫颈癌中的表达及意义
常海平,王敬芝,田 原,徐 杰,程建新*
(1.河北医科大学第四医院妇产科,河北石家庄050011;2.内蒙古医学院第一附属医院妇产科,内蒙古呼和浩特010059)
TPX2(targeting protein for Xenopus kinesin-like protein 2),是一个受细胞周期严格调控并在细胞有丝分裂纺锤体形成过程中发挥重要作用的微管相关蛋白[1]。近年有研究者发现其过表达与唾液腺癌[2]肺鳞癌[3]、乳腺癌[4]、口腔鳞癌[5]等的发生发展有关。降低其表达可抑制肿瘤细胞生长,有望成为肿瘤治疗的候选靶点[6]。
宫颈癌是妇科常见的恶性肿瘤之一,其发生、发展和转归与多种因素有关,TPX2是否参与其中,目前国内外尚未见报道。本研究探讨TPX2在子宫颈癌中的表达情况及其与子宫颈癌临床分期、分化程度及淋巴结转移的关系,为宫颈癌的诊治提供新的实验依据。
1 材料与方法
1.1 标本
收集河北医科大第四医院2009-2010年资料完整的手术切除的宫颈癌标本79例,新鲜的宫颈癌组织,取材后迅速放入液氮灌中,保存于-80℃冰箱,所有标本均经病理证实。宫颈癌患者年龄30~72岁,中位年龄49.5岁。鳞癌标本62例,组织学分级:Ⅰ级27例、Ⅱ级16例、Ⅲ级19例;腺癌17例,其中病理分级Ⅰ级11例,Ⅱ级5例,Ⅲ级1例。临床分期:Ⅰ期39例,Ⅱ期36例,Ⅲ期4例。其中淋巴结转移组17例,无淋巴结转移组62例。宫颈上皮内瘤变 (CIN)组30例,取自病理科存档蜡块。年龄34~57岁,中位年龄45岁,其中CINⅠ8例,CINⅡ13例,CINⅢ9例。对照组:因子宫肌瘤作全子宫切除的正常宫颈组织15例,年龄37~65岁,中位年龄52岁,所有肿瘤标本均在患者放、化疗治疗前采集并获得患者的知情同意。
1.2 试剂
兔抗人TPX2多克隆抗体(Bioward公司),SP试剂盒(北京四正柏生物科技有限公司),引物由上海捷瑞技术有限公司设计,Trizol试剂(Invitrogen公司),反转录系统试剂盒(Fermentas公司)。宫颈腺癌HeLa细胞系(河北医科大第4医院科研中心细胞库),宫颈鳞癌Siha细胞(上海中科院细胞库),1640细胞培养基(Gibco公司),胎牛血清(杭州四季清公司).
1.3 细胞培养
HeLa、Siha细胞分别培养于含10%FBS的RPMI1640培养基中,于37℃、5%CO2饱和湿度条件下培养,待细胞汇合至基本铺满瓶底时传代。
1.4 RT-PCR方法
取100 mg组织及已铺满25 cm2培养瓶的细胞,采用Trizol总RNA提取液提取总RNA,用1.5%的琼脂糖凝胶电泳分析其完整性,以DNA/RNA测定仪260/280 nm波长处测定RNA的吸光度(A)值,以测定RNA样品的纯度和浓度。cDNA的合成按反转录试剂盒说明书进行,1μL Oligo d(T)、2μg总RNA和1μL 10 mmol/L dNTP混合物加入灭菌蒸馏水至12μL,65℃加热5 min后,迅速置于冰上冷却。加入4μL 5×反应缓冲液和2μL 0.1 mmol/L DTT离心后37℃下孵育2 min,在室温下加入1μL M-MLV,37℃孵育50 min,70℃加热15 min以终止反应。最后于-20℃保存待用。PCR扩增:采用GAPDH作为内参照,目的片段为247 bp,引物序列为;5'-ACCTGACCTGCCGTCTAGAA-3'(上游),5'-TCCACCACCCTGTTGCTGTA-3'(下游)。TPX2目的片段为332 bp,序列为:5'-AACAATCCATTCCGTC AA-3'(上游),5'TGCAGGTGGCATACAAGG-3'(下游)。PCR扩增:TPX2反应条件为:95℃变性3 min后,95 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s,共35 个循环,最后72℃延伸6 min。GADPH为95℃变性5 min后,95 ℃ 15 s,58 ℃ 15 s,72 ℃ 20 s,共25 个循环,最后72℃延仲6 min。PCR反应产物置于1.5 g/L的琼脂糖凝胶中电泳(80 V,40 min),采用凝胶成像分析系统对条带进行扫描分析TPX2及GADPH的吸光度值。TPX2的表达量以其 A值与同一标本GADPH的A值的比来表示。
1.5 免疫组化检测及结果判定
采用免疫组化SP法检测:用PBS液(磷酸盐缓冲液)取代第一抗体作阴性对照。实验操作按SP试剂盒说明书进行。切片常规脱蜡,高压锅130℃修复13 min,3%H2O2作用15 min消除内源性过氧化物酶,正常山羊血清37℃封闭30 min,滴加TPX2一抗(1∶75),4℃过夜,37℃孵育30 min,滴加二抗,37℃孵育30 min,PBS洗5 min×3次,滴加三抗,37℃孵育30 min,DAB显色,苏木素复染,封片。免疫细胞化学步骤:细胞爬片不进行高压修复,其余同免疫组化。结果判断:根据染色阳性细胞数和染色强度综合评定。TPX2的阳性表达定位于胞核。随机选择5个高倍视野,每个视野计数100个瘤细胞,计数阳性细胞百分比。无染色计0分;弱染色(浅黄色)计1分;中等染色(棕黄色)计2分;强染色(黄褐色)计3分,细胞阳性率≤5%计0分,5%~25%计1分,25% ~50%计2分,>50%计3分。上述二项相加,0分为阴性(-),1~2分为(+),3~4分为(++),5~6分为(+++)。
1.6 统计学分析
采用SPSS13.0统计学软件,其中免疫组织化学染色结果为等级资料采用秩和检验分析,RTPCR结果采用均数±标准差 (x—±s)表示,各表达指标的组间差异在进行方差齐性检验后,进行t检验分析。
2 结果
2.1 TPX2的RT-PCR检测
正常宫颈组织中TPX2的mRNA几乎不表达为0.080±0.030,而宫颈腺癌组织中TPX2 mRNA表达为0.467±0.031,宫颈鳞癌组织TPX2 mRNA表达为0.441±0.011,HeLa细胞的表达为1.923±0.040,Siha细胞的表达为1.679±0.042,各组与正常宫颈组织比较均有明显差异(p<0.01),(图1)。
2.2 免疫组化法检测TPX2蛋白在不同宫颈组织及细胞中的表达
TPX2蛋白在不同宫颈组织的表达 (表1),TPX2蛋白表达定位于胞核,TPX2蛋白在CIN和宫颈鳞癌组织中表达渐增强 (图2A,图2B),但在正常宫颈鳞状上皮未见表达 (图2C),p<0.05,宫颈腺癌组织呈阳性表达 (图2D),正常宫颈腺上皮未见表达 (图2E)。TPX2蛋白均表达于细胞核,宫颈腺癌HeLa细胞系的表达强于鳞癌Siha细胞系 (p<0.05)(图3)。
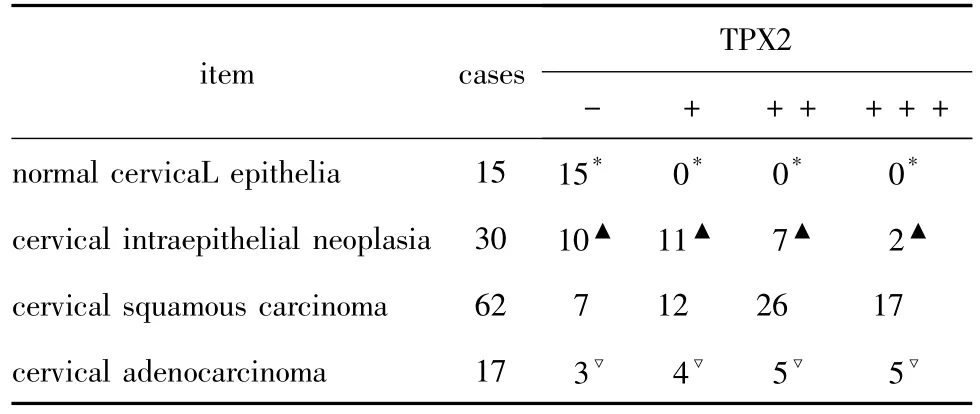
表1 TPX2蛋白在不同宫颈组织的表达Table 1 Expression of TPX2 protein in different cervical tissue
2.3 TPX2蛋白在宫颈癌的表达与临床病理参数之间的关系(表2)
TPX2蛋白在宫颈癌中,随着病理分级增加其表达增强,中低分化的表达强于高分化(p<0.05),临床分期Ⅱ,Ⅲ期强于Ⅰ期(p<0.05),有淋巴转移组强于未有淋巴转移组(p<0.05)。尚不能证明表达强度与年龄有关系(P>0.05)。
3 讨论

图1 TPX2 mRNA在宫颈癌组织和宫颈癌细胞系中的表达Fig 1 The expression of TPX2 mRNA in cervical cancer Cell lines and cervical cancer tissue

图2 TPX2蛋白在不同宫颈组织的表达Fig 2 Expression of TPX2 protein in different cervical tissue(×400)

表2 TPX2与宫颈癌各临床病理因素的关系Table 2 Correlation of TPX2 expression to clinicopathologic factors of cervical carcinoma

图3 TPX2蛋白在不同宫颈细胞系中的表达Fig 3 Expression of TPX2 protein in different cervical cancer cell lines(×400)
TPX2是一种受细胞周期严格调控的核增殖相关蛋白,参与细胞有丝分裂的纺锤体微管功能,它在细胞有丝分裂纺锤体的组装时发挥重要的作用,在组装完成后它又在维持纺锤体的完整性方面起作用[1]。它主要表达于 S期,其次是 G2期和M 期[7]。有研究者认为它在肺癌进展中起致癌作用,表达强度与肺鳞癌的临床分期、病理分级以及是否有淋巴转移相关,其高表达与5年生存率的降低相关[3]。有人用RNA干扰方法抑制TPX2的表达后致细胞增殖能力降低及发生S期细胞周期停顿现象和细胞凋亡[6]。有研究者利用 RNA干扰技术靶向抑制TPX2用以治疗小鼠胰腺癌取得了满意的效果[8],本研究我们发现,TPX2在宫颈腺癌HeLa细胞中表达极高,宫颈鳞癌Siha细胞中的表达略弱于HeLa细胞,TPX2是否在腺癌的进展中发挥更重要的作用,还有待于进一步研究。TPX2在正常宫颈腺上皮和鳞状上皮均不表达,而在鳞癌和腺癌组织中却明显呈阳性表达,而且随着肿瘤分期越晚及组织病理学分级越差,TPX2蛋白的表达水平越高。TPX2蛋白的表达水平在是否有淋巴转移的两组中有显著性差异,提示该蛋白是宫颈癌淋巴转移的危险因素,其高表达可能成为研究宫颈癌淋巴转移新的分子标志。在正常宫颈鳞状上皮、CIN、宫颈鳞癌组织中,TPX2蛋白由不表达到表达递增趋势,提示TPX2可能在宫颈癌发生过程中起重要的促进作用,监测其表达可能成为宫颈癌及宫颈癌前病变的一种辅助诊断指标。以TPX2为研究点,可能为宫颈癌的诊治提供一条新的思路。
[1]Gruss OJ,Wittmann M,Yokoyama H,et al.Chromosome-induced microtubule assembly mediated by TPX2 is required for spindle formation in HeLa cells [J].Nat Cell Biol,2002,10:41 -49.
[2] Shigeishi H,Ohta K,Hiraoka M,et al.Expression of TPX2 in salivary gland carcinomas[J].Oncol Rep,2009,21:341-344.
[3]Ma Y,Lin D,Sun W,et al.Expression of targeting protein for Xklp2 associatedwith both malignant transformation of respiratory epitheliumand progression of squamous cell lung cancer[J].Clin Cancer Res,2006,12:1121 -1127.
[4]Mohsenifar J,Almassi-Aghdam M,Mohammad-Taheri Z,et al.Prognostic values of proliferative markers ki-67 and repp86 in breast cancer[J].Arch Iran Med,2007,10:27-31.
[5]Shigeishi H,Fujimoto S,Hiraoka M,et al.Overexpression of the receptor for hyaluronan-mediated motility,correlates with expression of microtubule-associated protein in human oral squamous cell carcinomas[J].Int J Oncol,2009,34:1565-1571.
[6]Zhang LJ,Huang H,Deng L,et al.TPX2 in malignantly transformed human bronchial epithelial cells by anti-benzo[a]pyrene-7,8-diol-9,10-epoxide [J].Toxicology,2008,252:49-55.
[7]Tonon G,Wong KK,Maulik G,et al.High-resolution genomic profiles of human lung cancer[J].Proc Natl Acad Sci USA,2005,102:9625 -9630.
[8]Warner SL,Stephens BJ,Nwokenkwo S,et al.Validation of TPX2 as a potential therapeutic target in pancreatic cancer cells[J].Clin Cancer Res,2009,15:6519 -6528.

