内脏高敏感大鼠结肠Cajal间质细胞C-KIT表达增加
丁瑞峰,王爱鱼,王宏杰,郭元虎,赵鹏程
(包头医学院第一附属医院消化科,内蒙古包头014010)
功能性胃肠病(functional gastrointestinal disorders,FGIDs)是以消化系统症状为临床表现,而应用生化、影像学和内镜检查等并未发现器质性病变的一类胃肠道疾病[1]。认为其发病与内脏感觉、炎性反应、肠神经系统甚至中枢神经系统调节功能等因素有关,而内脏高敏感是功能性胃肠病症状产生的主要原因之一。Cajal间质细胞(interstitial celIs of cajal,ICC)被认为是胃肠慢波的起搏细胞,是调节胃肠运动的重要环节[2]。本研究通过直肠注射冰醋酸建立内脏高敏感大鼠模型[3-4],探讨ICC在内脏高敏感中的作用。
1 材料与方法
1.1 材料
清洁级新生Wistar大鼠[内蒙古大学实验动物中心提供,生产许可证号:SCXK(蒙)2007-0001],每8~10只与其母鼠共同饲养在同一箱内,发育至25 d后,将母鼠与幼鼠分离。分离后的大鼠雌雄分离,每4只∕笼,给予足够的食物、水。所有大鼠均在安静室温下饲养,昼夜控制为12 h周期。C-KIT一抗和 β-actin为兔多克隆抗体(武汉博士德公司),二抗为辣根酶标记山羊抗兔IgG(北京中杉金桥公司)。
1.2 方法
1.2.1 动物模型的建立:参照文献[3-4],新生大鼠16只随机分为2组,对照组大鼠自出生后8~21 d每日上午将石蜡油润滑后的连续硬膜外导管(直径1.0 mm)缓慢经肛门插入0.5~1.0 cm,注入0.9%氯化钠注射液0.3~0.5 mL,实验组注入0.6%冰醋酸溶液0.3~0.5 mL。从第21天后不进行任何实验操作。
1.2.2 肠道敏感性评估:8周龄时行直肠扩张(colorectal distention,CRD),观察大鼠腹部撤离反射(abdominal withdrawal reflex,AWR)评分。清醒状态下,将石蜡油润滑后的8F导尿管经肛门插人,气囊末端距离肛门1.0 cm。用胶布把导管和大鼠尾巴根部缠在一起,固定气囊,将其放在特制的透明塑料笼(20 cm×8 cm×8 cm)内,大鼠在此笼内只能前后运动,不能转身。大鼠适应环境20 min后,进行直肠扩张。导管球囊内快速注人0.9%氯化钠注射液,观察大鼠腹部撤离反射为3分时的注水量(腹背部肌肉较强收缩并把腹部抬离地面)。每次直肠扩张持续20 s,间隔3 min,重复进行3次,数据取均值。
1.2.3 取材:对大鼠进行评分后,予5%戊巴比妥过量麻醉处死。剖腹手术分离远端结肠,切除降结肠组织2.0 cm,一部分标本液氮冷冻过夜后-80℃冰箱保存,一部分标本置入4%多聚甲醛液24 h固定,石蜡包埋,制成5μm厚的切片,贴在经APES处理的载玻片,37℃温箱烘干备检。
1.2.4 免疫组化:石蜡切片梯度脱腊,0.3%甲醇-H2O2室温孵育,封闭内源性过氧化物酶;0.01 mol/L PBS漂洗,抗原修复标本于柠檬酸缓冲液微锅炉加热,1%山羊血清封闭背景,吸去多余血清;加1∶50 C-KIT一抗,4℃冰箱孵育过夜,PBS漂洗;1∶100生物素标记的羊抗兔 IgG,室温孵育2 h,PBS漂洗;新鲜配制DAB溶液显色,DPX封片。显微镜下胞质出现棕黄色片状或颗粒状物为C-KIT阳性反应,每例取3张切片,每张切片取5个高倍镜视野下的阳性细胞计数,取其平均值计算均数及标准差。
1.2.5 蛋白印迹法:提取蛋白样品80μg,SDSPAGE凝胶电泳分离,凝胶电泳仪初始电压80 V,后提高电压至100 V,用PVDF膜进行蛋白质的电转移,用5%TBS-T脱脂奶粉封闭。用TBS-T漂洗液洗膜,加入用适当漂洗液稀释的抗体(C-KIT为1∶200;β-actin 为1∶5 000),4 ℃ 孵育过夜。TBS-T漂洗液洗膜3次,然后将PVDF膜移入另一新的杂交袋,加入漂洗液稀释的辣根过氧化物酶标记的二抗(C-KIT 为1∶2 000;β-actin 为1∶10 000),37 ℃ 振荡60 min,TBS-T漂洗液洗膜。加入化学发光剂曝光、显影。蛋白图像分析用IPP软件对扫描图象的目的条带进行吸光度分析。
1.3 统计学分析
2 结果
2.1 AWR评分
实验组大鼠AWR为3分时的注水量为(1.37±0.31)mL,显著低于对照组的(1.84±0.22)mL(P <0.05)。
2.2 C-KIT阳性细胞染色和C-KIT蛋白印迹
对照组与实验组结肠组织中C-KIT阳性细胞分布、形态相似。主要分布在黏膜下ICC(ICC-SM)和肌间神经丛ICC(ICC-MY),在环肌层和纵肌层内ICC(ICC-IM)也有分布。正常ICC多呈纺锤形,有2~5条长突起。实验组大鼠结肠组织中C-KIT阳性细胞数显著高于对照组(p<0.05)(图1,表1)。实验组大鼠结肠组织中C-KIT蛋白表达明显高于对照组(P <0.01)(图2,表1)。
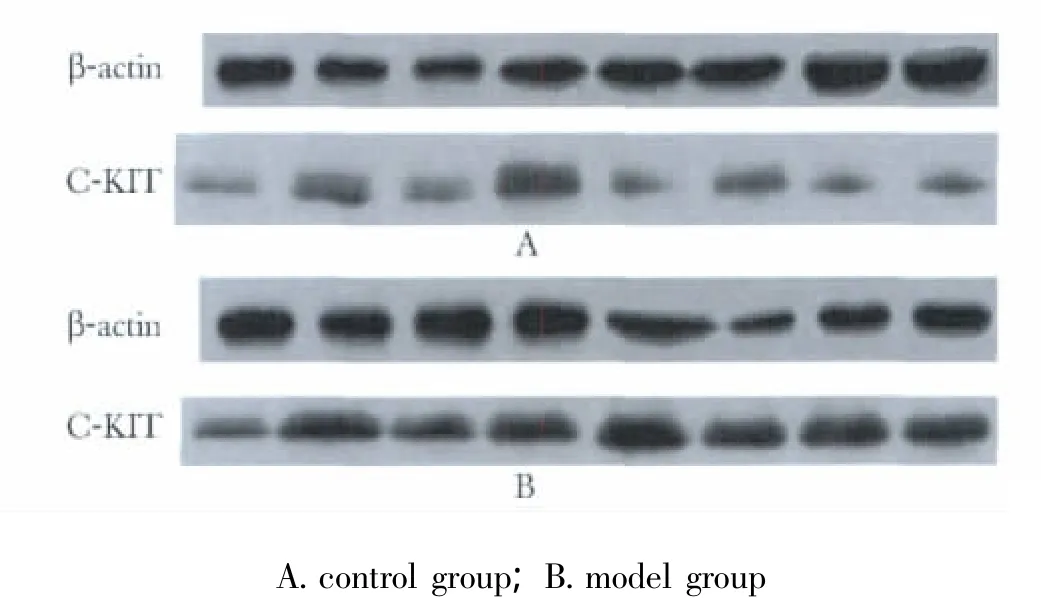
图2 Western blot检测大鼠结肠C-KIT蛋白表达Fig 2 Expression of C-KIT protein measured by Western blot in rat colon
3 讨论
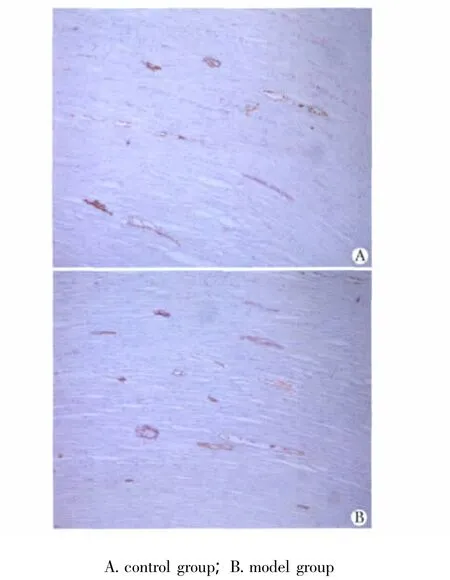
图1 大鼠结肠C-KIT免疫组化Fig 1 C-KIT immunohistochemistry staining of colon of rats(×400)
表1 对照组和实验组C-KIT阳性细胞计数和蛋白吸光度值比较Table 1 Comparison of C-KIT masculine cell counting and C-KIT protein absorbance value of control group and model group,n=8)

表1 对照组和实验组C-KIT阳性细胞计数和蛋白吸光度值比较Table 1 Comparison of C-KIT masculine cell counting and C-KIT protein absorbance value of control group and model group,n=8)
*P <0.05,**P <0.01 compared with control group.
group C-KIT masculine cell counting C-KIT pro tein A value control 15.33±1.57 40.6±30.5 model 23.37±1.88* 134.5±47.5**
内脏高敏感表现为患者对胃肠刺激的疼痛阈值降低.甚至对正常胃肠功能状态的敏感性增高,即异常性疼痛,与内脏相对应的躯体牵涉痛范围扩大[5]。内脏感觉由初级传入神经元产生,其神经末梢与肠神经系统的神经末梢相互混合。ICC是胃肠慢波的起搏细胞,ICC周围常伴有肠神经纤维环绕,而且内脏初级感觉神经纤维还与ICC密切联系,这为神经信号传递提供了解剖基础。ICC的一个重要功能是接收肠神经系统神经元的信号传递,神经的传导不是通过神经肌肉间松散的突触结构而是通过神经末端和ICC之间的突触样连接。新近有研究证实环肌层和纵肌层内ICC还与肌内迷走神经的膨体之间是以突触样联系传递信号的[6]。ICC是肠神经作用的首要靶细胞,担当了接受与传递兴奋和抑制性神经递质的作用,ICC细胞膜上存在多种受体如毒蕈碱 M2、M3受体、神经激肽受体、VIP受体和5-HT受体,并可观察到ICC对乙酰胆碱、NO、VIP、P物质等神经递质均有反应性[7]。目前已证实肠神经系统及多种神经递质在外周、脊髓及中枢参与内脏高敏感的调控。本实验通过冰醋酸连续刺激新生期大鼠结肠致内脏高敏感动物模型。该模型不影响大鼠的生长发育,成年后大鼠结肠组织学无明显炎性反应改变,适用于内脏高敏感性的研究。本研究发现ICC在内脏高敏感大鼠结肠中较对照组明显增多,C-KIT蛋白表达在内脏高敏感大鼠结肠中较对照组明显增强。由于ICC与肠神经系统、内脏初级感觉神经纤维有紧密的联系,ICC细胞膜上存在VIP、5-HT等多种神经递质受体,因此,推测ICC可能参与了内脏高敏感的形成,但其机制还有待进一步研究。
[1]余晓云,侯晓华.功能性胃肠病的发病机制[J].医学与哲学,2008,29:7 -9,30.
[2]Gibbons SJ,De Giorgio R,Pellegrini MSF,et al.Apoptotic cell death of human interstitial cells of Cajal[J].Neurogastroenterol Motil,2009,2l:85 -93.
[3]刘雁冰,袁耀宗,陶然君,等.大鼠肠道高敏性模型的建立及其内脏敏感性评估[J].中华消化杂志,2003,23:34-37.
[4]孙程程,王化虹,迟雁.直肠注射醋酸致内脏高敏感大鼠TNF-α mRNA表达的变化[J].中国医药导刊,2008,10:127-129.
[5]Drossman DA.功能性胃肠病与罗马Ⅲ的制定[M]//柯美云,方秀才.罗马Ⅲ:功能性胃肠病.北京:科学出版社,2008:1-26.
[6] Powley TL,Wang XY,Fox EA,et al.Ultrastructural evidence for communication between intramuscular vagal mechanoreceptors and interstitial cells of Caial in the rat fundus[J].Neurogastroenterol Motif,2008,20:69 -79.
[7]Koh SD,Kin TW,Yan JV,et al.Regulation of pacemaker current in interstitial cells of Cajal from murine small intestine by cyclic nucleotides[J].J Physiol,2000,277:127 -149.

