无患子皂苷的提取、类型及药理活性
李 芳,霍光华 ,叶亚建,陈明辉
江西农业大学生物与工程学院,南昌330045
无患子(Sapindus mukorossi Gaertn.)也叫肥皂树或洗手果,为无患子科无患子属的一种落叶乔木,东南亚各国、我国的台湾省及淮河以南各省均有分布[1]。无患子的干燥成熟果皮,始记载于《本草纲目》,具有清热祛痰,消积杀虫等作用,用于喉痹肿痛、咳喘、食滞、白带、疳积、疮癣、肿毒[2]。无患子皂苷还是一种天然温和型非离子表面活性物质,具有较好的起泡、去污性能,易降解,且无有害残留,对皮肤刺激性小,是洗发香波、化妆品以及各种生物洗涤剂的优良原料[3]。近年国内外研究表明,无患子所含皂苷成分具有抗炎症作用[4]、抗细菌和真菌[5]、抗肿瘤[6]、灭螺活性[7]、杀虫活性[8]、保肝[9]、抗精子[10]及促进抗生素吸收和提高药效等活性。本文对无患子皂苷近年来的提取方法、化学成分及药理作用这三方面的研究进展作一综述,为开发利用有药用价值的天然产物提供科学依据。
1 无患子皂苷的提取和初步纯化
无患子皂苷的提取方法主要包括水提法或有机溶剂提取法。魏凤玉等人[11,12]采用水提-大孔树脂吸附分离工艺和水提-超滤法从天然无患子果皮中提取分离无患子皂苷,前者正交实验结果表明,当水与原料的质量比为5∶1,在55 ℃下提取3 次时,无患子皂苷的产率达到11.36%,产品纯度达85.0%以上,后者实验结果表明在水提液中加入体积分数为2. 0% 的壳聚糖-醋酸絮凝剂时,预处理效果较好,正交实验表明,采用截留分子量为20 K~50 K的超滤膜,在温度25 ℃、膜面流速2.78 ×10-5m/s、压力0.08 MPa 的条件下,所得无患子总皂苷的纯度可达67.02%;而采用6 K 超滤膜所得无患子皂苷的产品纯度可达72.42%。朱亚红等人[13]对无患子皂苷的甲醇提取法、无水乙醇提取法、无患子果皮剪碎甲醇提取法及水提取法进行了比较,结果表明出用甲醇浸泡4 d,组织捣碎机捣碎,甲醇浸泡液循环使用2 次,皂苷粗提物提取率为59.85%,优于水浸泡(51. 6%)和无患子果皮剪碎后甲醇浸泡(48.1%)。黄素梅等人[14]通过单因素试验和正交试验研究各种提取条件对无患子皂苷得率的影响,得出乙醇提取法的最佳提取工艺为:提取溶剂为乙醇,提取温度为60 ℃时,料液比为1∶9,提取时间为3 h,提取为3 次,在该条件下,无患子皂苷得率为9.32%。饶厚曾等人[15]用索氏提取法比较了50%乙醇、95%乙醇、正丁醇等对水预处理后的无患子的提取效果,结果表明用乙醇提取时,提取率在72%~74%,而正丁醇的提取率仅为34. 77%。Huang 等人[16]用乙醇提取法获得无患子皂苷的乙醇粗提物,然后用己烷、正丁醇和氯仿对其进行萃取,过柱达到分离纯化的目的。Supradip 等人[8]用己烷对无患子果皮进行脱脂处理后,用甲醇进行浸提,再用正丁醇进行萃取,最后用丙酮沉淀获得无患子皂苷粗体物。魏凤玉等人[17]采用酶法提取无患子皂苷,研究了酶的类型对无患子皂苷提取的影响,并通过正交实验优化酶法提取工艺,结果表明,纤维素酶有助于无患子皂苷的提取,酶提法的较优工艺条件为:纤维素酶用量为无患子粉末质量的0.1%,酶提时间2.5 h,酶提温度50 ℃,pH 值4.7,此时无患子皂苷的提取率达到86.59%,比未加酶处理时提高了19.63%。饶厚曾等人[18]还采用微波萃取法从无患子果皮中萃取无患子皂苷,得出微波萃取皂苷较佳的工艺条件:微波炉采用低火档,选用正丁醇作萃取剂,体积为30 mL,萃取时间控制在30 min。解辉[19]采用超滤膜分离和泡沫分离等新型分离技术对无患子皂苷进行分离纯化,在无患子水提液中加入体积分数为2.0%的壳聚糖一醋酸絮凝剂时,除杂效果较好,20~50 K 超滤膜正交实验表明,影响超滤分离的大小顺序为:膜面流速>压力>温度;超滤分离的最优条件是:温度25 ℃,膜面流速2.78 ×10-5,压力0.08 MPa,在此条件下,所得无患子总皂昔的纯度为67.02%,与20~50K 超滤膜相比,6K 超滤膜对无患子皂昔的富集程度更高,产品纯度可达72.42%,由泡沫分离的正交实验可知,影响泡沫分离的大小顺序为:气体流速>进料浓度>温度>pH 值,气体流速与进料浓度的交互作用并不显著,最佳泡沫分离条件是:进料浓度2.5 g/mL,气体流速0.9 L/min,温度30 ℃,pH 值4.8,在此条件下,所得无患子总皂昔的收率是69.42%,纯度“66. 24%,富集比为2.48。魏凤玉等人[20]用泡沫分离法纯化无患子皂苷,当原始料液浓度2.5 g/L、气体流速0.9 L/min、温度30 ℃、pH 值4. 8 时,无患子皂苷的收率为69.42%,富集比为2.48,纯度达67.78%。虽然研究者们对无患子的分离提取做了不少工作,但总的来说都还处于初步研究阶段,要实现规模化生产还存在纯度低(如水提法,水提法的提取率较高,但是往往会将一些单糖、寡糖、氨基酸、蛋白质、黏液质等也被提取出来,从而导致提取物中的皂苷纯度降低,或是成本高、可操作性差等缺点。因此很有必要对无患子皂苷提取工艺进行更深入的研究,以获得低成本、高纯度、操作简便、绿色环保的提取工艺,实现或完善无患子皂苷的工业化生产。
2 无患子皂苷化学成分
无患子皂苷含有五环三萜类齐墩果烷型皂苷[21,22](如常春藤皂苷)、五环三萜类甘遂烷型皂苷[23,24]和四环三萜类达玛烷型皂苷[25]。查阅相关参考文献可以发现,无患子皂苷侧链主要有糖基和酰基组成,还有羧基、羟基、甲氧基和甲基等,其中糖类,常见的有葡萄糖、阿拉伯糖、鼠李糖、木糖等。这些侧链基团中,糖基和酰基主要连接在C-3 位置,也有一些连接在C-2、28,甲氧基主要连接在C-25、21、23,羧基主要连接在C-17、28,羟基主要连接在C-20、22、23,甲基主要在C-20。五环三萜类齐墩果皂苷主要来源于无患子果实,四环三萜类达玛烷型皂苷主要来源于无患子虫瘿,而五环三萜类甘遂烷型皂苷主要来源于无患子根和无患子虫瘿。无患子皂苷的名称、分布以及结构式分别见表1、2、3 和图1、2、3。

表1 五环三萜类齐墩果烷型皂苷Table 1 Saponin of oleanane quinque cyclic triterpenoids

4 Hederagenin-3-O-(4-O-Acetyl-β-D-xylopyranosyl)-(1 →3)-α-L-rhamnopyranosyl-(1 →2)-α-Larabinopyranoside 无患子果实 7 5 Hederagenin-3-O-(3,4-O-di-Acetyl-β-D-xylopyranosyl)-(1→3)-α -L-rhamnopyranosyl-(1→2)-α -L-arabinopyranoside 无患子果实 7 6 Hederagenin-3-O-β-D-Xylopyranosyl-(1 →3)-α-L-rhamnopyranosyl-(1 →2)-α-L-arabinopyranoside 无患子果实 7 7 Hederagenin-3-O-β -L-arabinopyranoside 无患子果实 7 8 hederagenin-3-O-(3-O-acetyl-a-L-arabinopyranosyl)-(1 →3)-a-L-rhamnopyranosyl-(1 →2)-a-Larabinopyranoside 无患子果实 16 9 hederagenin-3-O-(4-O-acetyl-a-L-arabinopyranosyl)-(1 →3)-a-L-rhamnopyranosyl-(1 →2)-a-Larabinopyranoside 无患子果实 16 10 hederagenin-3-O-(2,3-O-diacetyl-β-D-xylopyranosyl)-(1 →3)-a-L-rhamnopyranosyl-(1 →2)-a-L-arabinopyranoside 无患子果实 16 11 hederagenin-3-O-(2,4-O-diacetyl-β-D-xylopyranosyl)-(1 →3)-a-L-rhamnopyranosyl-(1 →2)-a-L-arabinopyranoside 无患子果实 16 12 3-O-[O-acetyl-β-D-xylopyranosyl-β-D-arabinopyranosyl-β-D-rhamnopyranosyl] hederagenin-28-O[β-D-glucopyranosyl-β-D-glucopyranosyl-β-D-rhamnopyranosyl]ester 无患子果实 29 13 3-O-(3,4-O-di-acetyl-a-L-arabinopyranoside)-(1 →3)-a-L-rhamnopyranosyl-(1 →2)-a-L-arabinopyranoside 无患子果实4
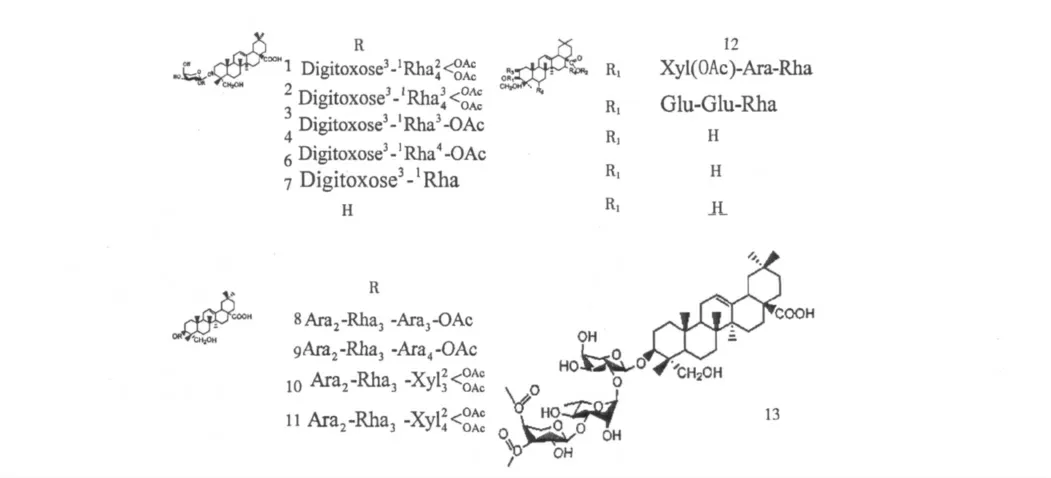
图1 五环三萜类齐墩果烷型皂苷结构式Fig.1 Structures of saponin of oleanane quinque cyclic triterpenoids

表2 四环三萜类达玛烷型皂苷Table 2 Dammarane Sapogenin of tetracyclic triterpenoid

4 25-Methoxy-3β,7β,20(S),22-tetrahydroxydammar-23-ene-3-O-α–L-rhamnopyranosyl-(1→2)-β-D-glucopyranoside 无患子虫瘿 6 5 25-Methoxy-3β,7β,20(R)-trihydroxydammar-23-ene-3-O-α-L-rhamnopyranosyl-(1→2)-β-D-glucopyranoside 无患子虫瘿 6 6 12,3,7,20(S)-trihydroxydammar-24-ene-3-O-a-L-rhamnopyrnosyl-(1 →2)-β-D-glucopyranoside 无患子虫瘿 16 7 3,7,20(R)-trihydroxydammar-24-ene-3-O-a-L-rhamnopyrnosyl-(1 →2)-β-D-glucopyranoside 无患子虫瘿16
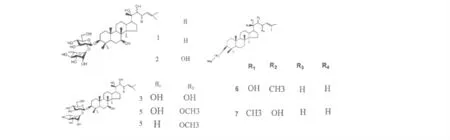
图2 四环三萜达玛烷型皂苷结构式Fig.2 Structures of dammarane saponin of tetracyclic triterpenoid

表3 五环三萜类甘遂烷型皂苷Table 3 Tirucallane saponin of pentacyclic triterpenoid
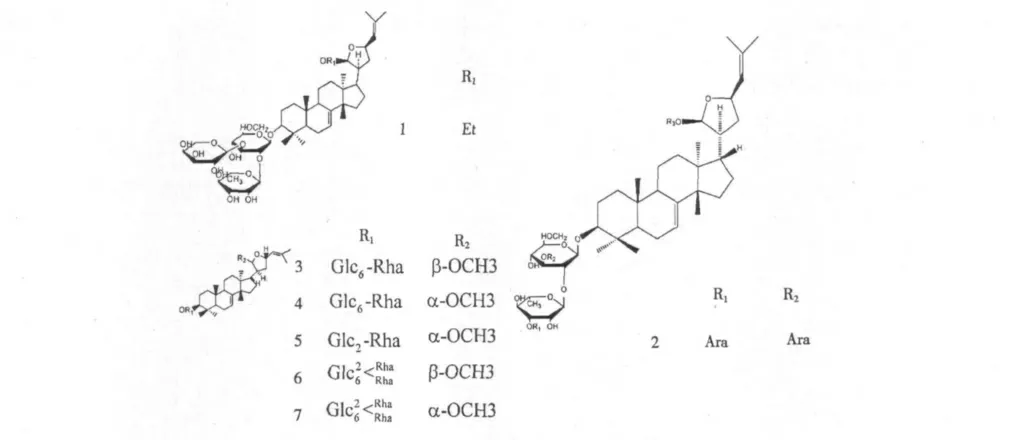
图3 五环三萜类甘遂烷型皂苷结构式Fig.3 Structures of tirucallane saponin of pentacyclic triterpenoid
3 无患子皂苷的药理作用
3.1 抗细菌和真菌作用
3.1.1 抗细菌作用
G.P.等人[5]用纯化的无患子皂苷、姜黄色素以及印度醋栗的提取物配置成的一种新颖、多面杀微生物制剂倍欣,它能抑制WHO 菌株和临床分离到的淋病奈瑟氏菌(其中包括对盘尼西林(青霉素)、四环霉素、萘啶酮酸和环丙氟哌酸有抗性的淋球菌),人类已经确定倍欣对从患有外阴阴道假丝酵母菌病的女性身上分离到的假丝菌、光滑念珠菌、白色念珠菌、热带念珠菌有抑制作用(其中包括对唑类药物和两性霉素B 有抗性的菌株)。Mohammed等人[27]研究发现,无患子乙醇提取物对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、普通变形杆菌和幽门螺旋杆菌(H.pylori)有抑制作用。体外试验结果表明无患子醇提取物在非常低的浓度时(10 μg/mL)对幽门螺旋杆菌有抑制作用。体内试验发现无患子提取物在2.5 mg/mL 时能清除H. pylori 对模型小鼠的感染,而且这些受试菌株未产生耐药性。研究发现,浓度为10 μg/mL 的无患子提取物能抑制30 株临床分离的抗药性幽门螺旋杆菌菌株,这些菌株分离自十二指肠溃疡、胃溃疡、非溃疡消化不良和胃癌患者的活体标本,包括敏感型和有抗药性H.pylori 菌株。这一抑菌浓度能与以前报道的蒜素6~12 μg/mL,蒜油8~32 μg/mL 和从大蒜中提取的阿焦烯(ajoene )10~25 μg/mL 相比。实验证明,无患子提取物比磺胺甲噻二唑40 μg/mL,乙烯二噻烯(vinyldithiins)<100 μg/mL 以及大蒜粉250 μg/mL更有潜力。而且幽门螺旋杆菌在连续传代10 次后易对阿莫西林、甲基红霉素抗生素等产生抗性,但不会对无患子提取物产生抗性。另外,Moammed 等人还发现无患子醇提取物不论对抗生素敏感型H.pylori 菌株还是抗药性菌株均有相同的生物活性。动物试验显示口服无患子醇提取物有抗炎症和抗溃疡作用,有助于防治胃溃疡。
3.1.2 抗真菌作用
Tamura 等[28]研究了无患子果皮中皂苷的抗皮真菌活性及其构效关系。研究发现,从无患子果皮中用甲醇提取的粗皂苷对酿酒酵母菌和产朊假丝酵母有明显的抗菌活性。70%和85%甲醇洗脱液混合后的皂苷混合物(包括单链和双链苷)的抗皮真菌作用显著(单链苷抑制作用较强,而双链苷无效),对酵母菌抑制作用较强,对一般真菌无效;对革兰氏阳性菌有中度抑制作用,而对革兰氏阴性菌无效。该皂苷混合物不仅可以作为清洁剂成分加人化妆品,而且具有抗皮真菌、念珠菌和防止头屑产生的作用。Supradip 等人[29]用发现无患子皂苷对两种真菌(Rhizoctonia bataticola (Taub.)Briton Jones和Sclerotiumrolfsii Sacc.)有明显的抗菌活性(EC50在181~407 ug/mL),他们还发现单糖链常春藤皂苷要比双糖链常春藤皂苷对真菌的抗性明显下降,如果去除糖链部分会使活性完全丧失。
3.2 灭螺活性
Huang 等人[7]用无患子的提取物来处理福寿螺,结果无患子皂苷的粗提物表现出灭螺活性,用无患子皂苷粗提物分别处理24,48 和72 h 之后的LC50(Lethal Concentration 50)分别为85,22 和17 ppm,而且从无患子中分离出一种新的乙酰化的常春藤皂苷,同时还有六种已知的常春藤皂苷。实验数据表明这七种皂苷(Sapinmusaponin K (1)、Sapinmusaponin L (2)、Sapinmusaponin M (3)、Sapinmusaponin N (4)、Sapinmusaponin O (5)、Sapinmusaponin P (6)和hederagenin 3-O-(2,4-O-di-acetyl-R-L-arabinopyranoside)-(1f3)-R-L-rhamnopyranosyl-(1f2)-R-L-arabinopyranoside)用10 ppm 的剂量就可导致金苹果螺100%的死亡率。
3.3 杀虫活性
Supradip 等人[8]在实验室研究了无患子皂苷及它的水解产物对害虫斜纹夜盗蛾的拒食和害虫生长调节效应,用无患子皂苷及其水解产物处理5 d 后,结果表明无患子皂苷的水解产物能够提高害虫的生长调节活性。录丽平等人[30]通过浸渍法、饲料混药法、无限量取食法提取无患子中的皂苷,再进行对小菜蛾、玉米象、果蝇的室内毒力测定,结果表明无患子粗提取物皂苷对玉米象没有活性,对小菜蛾和果蝇有毒杀活性,但对果蝇的毒力较高,浓度为50.000 mg/mL 时,72 h 果蝇的死亡率为100%,72 h对果蝇的LC50(Lethal Concentration)为4. 06 mg/mL。
3.4 抗炎症作用
研究发现,活化的嗜中性粒细胞能产生高浓度的超氧阴离子和弹性蛋白酶,这涉及到导管粘液过量分泌,进而能引起慢性肺炎等疾病,Hwang 等人[4]在人类嗜中性粒细胞中研究SMG-1(一种从无患子中分离到的皂苷)的消炎功能和根本的作用机制时发现,SMG-1 能抑制N-甲酰基-蛋氨酸-亮氨酸-苯丙氨酸(FMLP)活化的人类嗜中性粒细胞中超氧阴离子的产生和弹性蛋白酶的释放,而且SMG-1 能减少FMLP 诱导的完整嗜中性粒细胞中和膜相连的p47phox的表达,但是却不能改变重组体系中亚细胞NADPH 氧化酶的活性。SMG-1 能减弱FMLP 诱导的细胞溶质Ca 浓度的增加和p38 MAPK,ERK,JNK,and AKT 磷酸化作用,然而SMG-1 对细胞中cAMP 水平和腺苷酸酶和磷酸二酯酶的活性并没有影响,受体结合分析表明SMG-1 抑制FMLP 和相应的受体结合,SMG-1 是一种天然的FMLP 受体抑制剂,很有潜力发展成为一种有用的治疗嗜中性粒细胞的炎症疾病的治疗剂。
3.5 抗肿瘤作用
无患子的甲醇提取物对小鼠黑素瘤、hela、人胃癌细胞增殖具有抑制作用,其中单皂苷具有抑制肿瘤活性,而双皂苷则完全没有活性[31]。长尾常敦发现无患子的甲醇提取物对小鼠黑素瘤、Hela 、MK-1(人胃癌)细胞增殖具有抑制活性[32]。从甲醇提取物中分离得到的无患子皂苷A 及B、常春藤皂苷E,及G 和3-O-乙酰无患子皂苷B ,对以上三种肿瘤细胞增殖的抑制程度与常春藤皂苷元相同。并且糖链中乙酰基结合时有使活性增强的趋势。Huang 等[16]的研究也表明以常春藤皂苷元为苷元的10 种单皂苷对Hela、WiDr、KB 等6 种人类肿瘤细胞具有细胞毒性。Kuo 等人[6]用MTT 处理Hepa59T/VGH,NCI,Hela 和Med 肿瘤细胞,初步的试验数据表明无患子皂苷1,3-5(ED50~9~18 μg/mL)对其有中度的细胞毒性。G.P.等人[5]用纯化的无患子皂苷、姜黄色素以及印度醋栗的提取物配置成的一种新颖、多面杀微生物制剂倍欣,其表现出高度的抗病毒活性,它对人类免疫缺陷病毒HIV-1NL4.3,EC50(Effective Concentration)的稀释度为1∶20000,当稀释度为1∶1000 时,它的抑菌率高达98%;它也能阻止病毒HIV-1(IIIB)进入P4-CCR5 细胞(EC50~1 ∶2492)。
3.6 保肝作用
时京珍等人研究了α-常春藤皂苷(α-hederin)和无患子皂苷(sapindoside)对小鼠肝细胞色素p-450 的影响与保肝作用的关系[9]。研究结果显示,α-常春藤皂苷20 mg/kg,无患子皂苷20 mg/kg 和常春藤皂苷 + 无患子皂苷B20 mg/kg 使肝细胞色素p-450 分别降低了40%,55%和50%,这种抑制作用在3 d 后基本恢复正常。苯巴比妥腹腔注射50 mg/kg 使小鼠肝细胞色素p-450 增加2.5 倍,常春藤皂苷 +无患子皂苷B 使苯巴比妥诱导的p-450 降低了50%,小鼠肝微粒体体外与常春藤皂苷+无患子皂苷B 共孵对p-450 没有影响,推测常春藤皂苷和无患子皂苷B 的保肝作用至少在某一方面是由于降低了肝细胞色素p-450 而产生的。
3.7 抗精子作用
Manish 等人[10]研究了无患子水提取物在雄性实验鼠精子成熟过程中对精子膜的改变作用。研究结果显示:用50 mg/kg/d 剂量的无患子水提取物给雄性实验鼠灌胃45 d,灌胃组实验鼠的附睾头、体、尾部精子活力均低于对照组,并观察到灌胃组实验鼠精子中的超氧化物歧化酶活性呈现非常态分布:附睾头部活性最低,附睾尾部最高,与对照组实验鼠精子中的超氧化物歧化酶活性分布相反。但对照组和灌胃组实验鼠的精子数量和形态没有差异,实验鼠睾丸和附睾未见组织病变。
3.8 促进抗生素吸收和提高药效的作用
Tanaka 等人[33]用含三萜皂苷的无患子提取物和β-内酰胺类抗生素同时喂养实验动物,发现无患子提取物能提高口服或直肠给药时抗生素的吸收和药理活性,并能将血中抗生素浓度较长时间地维持在最低有效浓度以上。
3.9 表面活性作用
Raghava 等人[34,35]用从无患子果实中提取到的天然表面活性剂溶液来除去土壤中的疏水性有机化合物(HOC),以六氯代苯(HCB)为代表,结果表明和传统的表面活性剂、水相比,HCB 的除去率会随着无患子天然表面活性剂浓度的增加而提高。Chen 等人[36]对无患子皂苷和油茶皂苷的去污能力进行了比较发现无患子皂苷的去污能力优于油茶皂苷。Rao 等人[37]比较了无患子表面活性剂、人工合成的表面活性剂(Triton-X100,Tx-100 等)和两者两两的混合溶液对萘的溶解效率,结果表明人工合成的表面活性剂优于两者两两的混合溶液,两者两两的混合溶液优于无患子表面活性剂。
除了以上列举的几种药理活性外,无患子皂苷还具有抗血小板聚集[38](大戟烷型皂苷)、降血压[39]等作用。
4 展望
无患子皂苷的提取分离工艺主要有水提和醇提取溶剂萃取工艺。醇提萃取工艺技术成熟,但有机溶剂量耗费较大,投资较高,但产率不高,纯度有限,此工艺的推广受到一定限制。水提取工艺操作简单,溶剂易得,投资小,且无污染,缺点是收集的溶液量大,对其进行进一步的分离精制较困难。从文献报道的无患子皂苷提取分离方法可以看出,分离方法的选择,能很好的提高无患子皂苷的提取效率,所以如果能够设计出一种新型的无患子皂苷提取分离方法,就可以解决水提和醇提溶剂萃取中的不足,为无患子的有效利用提供更加广阔的前景。
由于无患子中皂苷成分独特的生物活性,引起了人们的很大兴趣,人类通过各种先进的技术手段(如羟基磷灰石柱层析、高效液相层析法、中压液相层析法、低压液相层析法和双向高高效薄层色谱等),分离到各种无患子皂苷成分,并采用化学方法、土壤细菌法、紫外光分解法、四醋酸铅氧化碱水解法、醋酐吡啶分解法、x-射线晶体衍射法以及各种光谱方法等新技术对已分离到的无患子皂苷的结构进行了鉴定[40]。随着人类对各种技术的进一步探索和应用,相信人类会发现更多的有效的无患子皂苷成分,并利用各种手段对生物活性大的无患子皂苷成分进行结构或生化改造,以找到活性更强、更特异的化合物。加快无患子皂苷成分的工业化生产及应用研究,进一步研究无患子皂苷的药理作用,明确有效成分和活性的相互关系也将成为未来关注的焦点。
1 中国植物志编辑委员会. 中国植物志四十七卷(第一分册).北京:科学出版社,1998.
2 中国常用中草药彩色图谱,贵州科技出版社,371.
3 Zhang MJ,et al.无患子的开发利用.Nat prod Res Dev(天然产物研究与开发),1993,5(4):76-78.
4 Hwang TL,et al.The hederagenin saponin SMG-1 is a natural FMLP receptor inhibitor that suppresses human neutrophil activation.Biochem Pharm,2010,80:1190-1200.
5 GPT,et al. A novel polyherbal microbicide with inhibitory effect on bacterial,fungal and viral genital pathogens. Int J Antimicrob Agents,2008(32):180-185.
6 Kuo YH,et al.New dammarane-type saponins from the galls of Sapindus mukorossi. J Agric Food Chem,2005,53:4722-4727.
7 Huang HC,et al. Molluscicidal Saponins from Sapindus mukorossi,Inhibitory Agents of Golden Apple Snails,Pomacea canaliculata.J Agric Food Chem,2003,51:4916-4919.
8 Supradip S,et al. Screening for feeding deterrent and insect growth regulatory activity of triterpenic saponins from Diploknema butyracea and Sapindus mukorossi. J Agric Food Chem,2010,58:434-440.
9 Shi JZ,Liu G.Effect of a hederin and sapindoside B on hepatic microsomal cytochrome P-450 in mice.Acta Pharmacol Sin,1996,17:264-266.
10 Nivsarkar M,et al.Sperm membrane modulation by sapindus mukorossi during sperm maturation. Asian J Andrology,2002,4:233-235.
11 Wei FY,et al. 天然无患子皂苷的提取分离. 安徽化工,2007,33(3):15-17.
12 Wei FY,et al.超滤法分离提纯无患子皂苷.膜科学与技术,2008,28(2):85-88.
13 Zhu YH,et al.无患子皂苷粗提物提取方法比较. 浙江农业科学,2008(2):247-248.
14 Huang SM,et al.无患子总皂苷的提取工艺研究,安徽农业科学,2010,38:354-356.
15 Rao CH,Guo LH.无患子皂苷提取工艺研究. 江西科学,2002,20:55-58.
16 Huang HC,et al.Triterpenoid saponins from the fruits and galls of Sapindus mukorossi,Phytochemistry 69 2008:1609-1616.
17 Wei FY,Fang C.酶法提取无患子皂苷的工艺研究,应用化工,2010,39:1150-1151.
18 Rao HC,Sang CT.微波萃取法提取无患子皂苷工艺.辽宁石油化工大学学报,2006,26(4):70-72.
19 Xie H.无患子皂昔分离纯化的研究.2007.
20 Wei FY,et al. 泡沫分离法纯化无患子皂苷,中成药,2009.
21 Nakayama K,et al.Saponins of pericarps of Chinese Sapindus delabayi(Pyi-shiau-tzu),a source of natara surfactants.Chem Pharm Bull,1986,34:2209-2213.
22 Kimata H,et al.Saponins of pericarps of Sapindus mukorossi Gaertn and solubilization of monodesmosides by bisdesmosides.Chem Pharm Bull,1983,31:1998-2002.
23 Huang HC,et al. Sapinmusaponins F-J,Bioactive Tirucallane-Type Saponins from the Galls of Sapindusmukorossi. J Nat Prod,2006,69:763,767.
24 Wei N,et al.New tIirucallane-type triterpenoid saponins from sapindus mukorossi gaetn,J Asian Nat Prod Res,2004,6:205-209.
25 Kuo YH,et al. New Dammarane-Type Saponins from the Galls of Sapindus mukorossi,J Agric Food Chem,2005,53:4722-4727.
26 Wei N,et al.Tirucallane-Type Triterpenoid Saponins from the Roots of Sapindus mukorossi,Chem Pharm Bull,2006,54:1443-1446.
27 Ibrahim M,et al.Antimierobial activity of sapindus mukorossi and Rheum emodi extracts against H. Pylori:in vitro and in vivo studies.World J Gastroenterol,2006,14:7136-7142.
28 Tamura Y.无患子果皮中皂苷的抗皮真菌活性.Nat Med,2001,55:11-16.
29 Supradip S,et al.Structure-biological activity relationships in triterpenic saponins:the relative activity of protobassic acid and its derivatives against plant pathogenic fungi.Pest Manag Sci,2010,66:825-831.
30 Lu LP,et al.无患子皂苷粗提物杀虫活性研究.安徽农业科学,2010,38:10755-10756.
31 Supradip S,et al.Synergistic/potentiation interaction between nematostatic constituents from Azadirachta indica,Madhuca indica and Sapindus mukorossi,Archives of Phytopathology and Plant Protection.2010,43:357-367.
32 Chang WC.关于肿瘤细胞增殖抑制成分的研究. 无患子果皮中的活性成分. 国外医学:中医中药分册,2002,24:246-247.
33 Osamu T,Noboru Y.Promotion of absorption of drugs administered through the alimentary system,United States Patent 4501734,1985-02-26.
34 Raghava RK,et al. Soil flushing using colloidal gas aphron suspensions rgeneated from a plant-based surfactant. J Hazardous Mater,1998,60:73-87.
35 Raghava RK,et al. Aqueous solubility and desorption of hexachlorobenzene from soil using a plant-based surfactant.Wat Res,1997,31:2161-2170.
36 Chen YF,et al. Foam Properties and Detergent Abilities of the Saponins from Camellia oleifera.Int J Mol Sci,2010,11,4417-4425.
37 Jagajjanani KR,Santanu P. Solubilization of Naphthalene in the Presence of Plant Synthetic Mixed Surfactant Systems. J Phys Chem B,2009,113:474-481.
38 Huang HC,et al.Chem Pharm Bull,2007:1412-1415.
39 Wang WS.无患子皂苷对肾性高血压大鼠血压及血管活性物质的影响.中国中药杂志,2007,32:1703-1705.
40 Zhong LM.三萜皂苷提取分离和结构鉴定技术.中医药学刊,2004,4(4).

